奇楠与传统沉香特征成分的差异性分析及其生物活性研究
胡泽坤, 晏婷婷, 李改云, 秦嘉惠, 吴新文, 陈 媛*
(1.中国林业科学研究院 木材工业研究所,北京 100091; 2.海南那大农业开发有限公司,海南 儋州 571724)
沉香是一味名贵中药,具有抗菌、抗氧化、消炎、助眠、止咳等药理作用[1-3],基于沉香开发的中成药有上百种,衍生的系列产品在中医药、康养保健等领域发挥着重要作用。白木香(Aquilariasinensis(Lour.)Gilg)是我国唯一的生产沉香的基源植物[4],主要产于我国海南、广东、广西等地。奇楠沉香(奇楠,QN)被认为是最高品质的沉香,国产奇楠的基源植物仍为白木香[5]。化学成分决定着沉香的品质与特征,也是沉香具有多种生物活性的物质基础,其主要化学成分为倍半萜类化合物和2-(2-苯乙基)色酮类化合物。根据色酮类化合物的骨架结构,可将其分为5,6,7,8-四氢-2-(2-苯乙基)色酮(THPECs)、单环氧-2-(2-苯乙基)色酮(EPECs)、双环氧-2-(2-苯乙基)色酮(DEPECs)和Flidersia型2-(2-苯乙基)色酮(FTPECs)这4类[6]。QN与传统沉香(TA)化学成分存在显著差异,QN中含有大量的2-[2-(4-甲氧基苯)乙基]色酮和2-(2-苯乙基)色酮[7-8],而TA中沉香四醇含量丰富[9]。此外,化学成分的有效提取对于沉香的合理利用至关重要。乙醇具有来源广泛、价格低、毒性弱以及提取效率高等优点,被认为是沉香提取溶剂的理想选择,多项研究表明乙醇体积分数会影响提取物的化学成分种类和含量[10-11],进而可能会影响其生物活性。为进一步探究奇楠与传统沉香内在成分差异,本研究以奇楠和传统沉香为对象,探讨了热提法(HE)、冷提法(CE)以及乙醇体积分数对二者提取物化学成分种类和含量的影响。此外,还分析了不同提取物的ABTS自由基清除能力和铁离子还原能力,以及对大肠杆菌、白色念珠菌的抑制能力,以期为奇楠的进一步开发利用和潜在价值挖掘提供理论依据。
1 实 验
1.1 原料、试剂与仪器
奇楠沉香(QN)与传统沉香(TA)样品均产自广东省,奇楠样品结香树龄4年,结香时间15个月;传统沉香样品结香树龄12年,结香时间36个月,经鉴定两者均为瑞香科沉香属。大肠杆菌(Escherichiacoil)CICC 10899和白色念珠菌(Candidaalbicans)CICC 32380,购于中国工业微生物菌种保藏中心。2,2’-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)法总抗氧化能力(T-AOC)检测试剂盒、Fe3+还原能力(FRAP)法T-AOC检测试剂盒,购于上海碧云天生物技术有限公司;沉香四醇(纯度≥98%)、异沉香四醇(纯度≥98%),购于成都菲德生物技术有限公司;4’-甲氧基沉香四醇(纯度≥90%)、 6-羟基-2-(2-苯乙基)色酮(纯度≥98%)、 6,7-二甲氧基-2-(2-苯乙基)色酮(纯度≥98%)、 2-(2-苯乙基)色酮(纯度≥98%),购于成都普思生物科技股份有限公司;α-石竹烯(纯度≥93%),购于阿拉丁试剂有限公司;蓝桉醇(纯度≥85%),购于上海甄准生物科技有限公司。
旋转蒸发仪;LC-20A型高效液相色谱(HPLC)仪、QP2010型气相色谱-质谱(GC-MS)联用仪,日本SHIMADZU公司;G6510型超高效液相色谱-高分辨飞行时间质谱(UPLC-Q-Tof-MS),美国Agilent公司;SpectraMax 190型酶标仪,美国Molecular Devices公司。
1.2 奇楠与传统沉香特征成分的提取
1.2.1热提(HE)法 取样品粉末2.000 g(精确至0.001)于250 mL圆底烧瓶中,加入100 mL乙醇,称质量,常温静置1 h。连接冷凝回流装置,加热并保持微沸60 min。冷却至室温后再次称质量,用相应的提取溶剂补足质量,滤纸过滤。
1.2.2冷提(CE)法 取样品粉末2.000 g(精确至0.001)置于300 mL锥形瓶中,加入100 mL乙醇,同时加入转子,磁力搅拌6 h(转速400 r/min),然后再静置18 h,摇匀后过滤。
1.2.3提取物得率测定 乙醇体积分数分别为0%(即水)、 35%、 45%、 55%、 65%、 75%和85%,提取物含量的测定参照《药典》附录[12]中浸出物含量测定方法。取滤液25 mL于已干燥至质量恒定(m1)的蒸发皿中,水浴蒸干,103 ℃鼓风烘箱干燥3 h。干燥后的蒸发皿于干燥器中冷却至室温,称质量(m2),每组测试重复3次取平均值。提取物得率(X)按照式(1)进行计算。
(1)
式中:m1—蒸发皿的质量,g;m2—提取物与蒸发皿质量之和,g;ms—样品质量,g;W—样品含水率[13],%。
1.3 倍半萜类化合物分析
1.3.1样品制备 取1.2节中样品滤液25 mL,用旋转蒸发仪减压浓缩至约5 mL,加入25 mL无水乙醚萃取,连续萃取4次,合并萃取液并将溶剂挥干,并用乙酸乙酯定容至5 mL,过0.45 μm滤膜,制得水提取样品,备用。取10 mL样品滤液采用旋转蒸发仪减压浓缩,将溶剂挥干,采用乙酸乙酯定容至2 mL,过0.45 μm滤膜,制得乙醇提取样品,备用。
1.3.2GC-MS测试条件 选用DB-5HT色谱柱,载气(99.999%高纯氦气)流速为0.5 mL/min,进样量1 μL,分流比20∶1,色谱柱升温程序为90 ℃保持1 min,以2.0 ℃/min的速率升温至150 ℃并保持5 min,最后以2.0 ℃/min速率升温至280 ℃并保持10 min。MS条件:离子源温度230 ℃,电离能70 eV,全扫描模式,m/z扫描范围50~500。采用同一程序对正构烷烃混标(C9~C40)对照品进行分析。
1.3.3标准曲线的绘制 将蓝桉醇和α-石竹烯对照品配制成不同质量浓度溶液,进行GC-MS分析,以质量浓度为自变量,峰面积为因变量,计算2个对照品的线性方程。其中,蓝桉醇线性回归方程为y=38 242x-521 484,线性范围22.5~360 mg/L,R2=0.999 4;α-石竹烯线性回归方程为y=40 329x-500 100,线性范围20~320 mg/L,R2=0.998 4。
1.4 色酮类化合物分析
1.4.1测试条件 HPLC分析选用Phenomenex luna C18色谱柱(250 mm×4.6 mm, i.d.0.1 μm),流动相为乙腈/0.1%甲酸溶液。HPLC程序按照课题组前期建立的方法[6]进行。UPLC-Q-Tof-MS定性分析的色谱条件与HPLC分析方法相同,质谱条件按照文献[14]方法进行。
1.4.2标准曲线的绘制 取沉香四醇、 4’-甲氧基沉香四醇、异沉香四醇、 6-羟基-2-(2-苯乙基)色酮、 6,7-二甲氧基-2-(2-苯乙基)色酮、 2-(2-苯乙基)色酮6个对照品,配制成不同质量浓度对照品溶液,按照1.4.1节中的程序进行HPLC分析,以质量浓度为自变量,峰面积为因变量,计算6个对照品的线性回归方程(表1)。

表1 对照品的线性回归方程
1.5 抗氧化活性测试
1.5.1样品 选择乙醇体积分数为0%、 35%、 55%的HE法QN与TA样品滤液进行抗氧化活性分析。
1.5.2ABTS自由基清除率 测定方法参考文献[2]进行。将试剂盒中氧化剂溶液和ABTS溶液按照1∶1比例混合制成ABTS工作母液,锡箔纸遮光,室温反应12 h,使ABTS自由基(ABTS·)产生完全。用80%乙醇将ABTS工作母液稀释,使其在734 nm处的吸光度为(0.70±0.05),制成测试溶液。将10 μL样品溶液或空白对照液(80%乙醇)与200 μL的ABTS·溶液加入96孔酶标板中,室温反应6 min,采用酶标仪测定溶液吸光度(734 nm)。以Trolox为阳性对照。试验重复3次取平均值,ABTS·清除率(W)计算如式(2)所示:
W=(A0-A)/A0×100%
(2)
式中:A0—空白对照液加入ABTS·溶液后的吸光度;A—样品溶液加入ABTS·溶液后的吸光度。
1.5.3总抗氧化能力 参照文献[15]采用FRAP法分析奇楠和传统沉香的总抗氧化能力。采用FeSO4·7H2O标准品绘制Fe2+浓度(0.15~1.5 mmol/L)与吸光度(593 nm)之间的标准曲线,得到回归方程y=0.474 7x+0.086 7,R2=0.994。取5 μL样品溶液或对空白照液(80%乙醇)与180 μL的FRAP工作液(37 ℃孵育)加入96孔酶标板中,室温反应5 min,采用酶标仪记录反应体系的吸光度(593 nm)。最后,根据标准曲线计算反应溶液中的Fe2+浓度,测试重复3次取平均值。以Trolox为阳性对照。
1.6 抑菌活性测试
1.6.1样品制备 选择乙醇体积分数为0%、 35%、 55%的HE法QN与TA样品滤液,取50 mL减压浓缩成浸膏后用DMSO溶解,制成样品溶液。
1.6.2菌悬液的制备 将大肠杆菌接种于溶菌肉汤(LB)培养基中,白色念珠菌接种于沙式葡萄糖液体(SDB)培养基中,大肠杆菌置于37 ℃摇床中培养,白色念珠菌置于28 ℃摇床中培养,摇床转速200 r/min,培养时间10 h。通过与0.5 mol/L麦氏比浊管对比浊度,用无菌水将菌液稀释至1×108cfu/mL,再将菌悬液稀释100倍即为试验用菌悬液(1×106cfu/mL)。
现阶段的企业竞争是人、钱、物、信息、时间的综合竞争,尤其以时间为竞争的核心。丰田公司很早就意识到了这点,并将时间要素统筹考虑进生产系统中。在丰田公司,生产时间的范围相对较宽,从取得材料到制成产品,再到获得现金收益,不仅包括加工产品的时间,而且包括产品停滞的时间,如产品在各个生产环节的停顿以及库存时间。
1.6.3抑菌圈的测定 大肠杆菌采用LB平板培养基培养,白色念珠菌采用马铃薯葡萄糖琼脂(PDA)培养基培养。首先用6 mm打孔器在琼脂平板培养基上均匀打4个孔,用移液枪分别吸取样品溶液或空白对照溶液(蒸馏水)20 μL于各孔中。将带有大肠杆菌的平板培养基置于37 ℃生化培养箱中培养,带有白色念珠菌的平板培养基置于28 ℃生化培养箱中培养,培养时间24~48 h,之后用游标卡尺从4个不同方向测量抑菌圈直径。
2 结果与讨论
2.1 提取方法和乙醇体积分数的影响
2.1.1提取物得率 提取物得率是评价化学成分有效提取的重要指标,提取方法和乙醇体积分数对提取物得率的影响如图1所示。采用单因素方差分析乙醇体积分数对提取物得率的影响,结果表明:乙醇体积分数相同时,奇楠(QN)和传统沉香(TA)的热提(HE)法提取物得率大于冷提(CE)法。采用热提法时,乙醇体积分数在0%(即水)~55%范围内,乙醇体积分数越高,奇楠和传统沉香的提取物得率越高,且提取物得率与乙醇体积分数具有显著相关性(p<0.05);但乙醇体积分数在55%~75%范围内,提取物得率与乙醇体积分数不具有显著相关性。采用冷提法时,乙醇体积分数在0~75%范围内,乙醇体积分数越高,奇楠和传统沉香的提取物得率越高,且提取物得率与乙醇体积分数具有显著的相关性(p<0.05);但当乙醇体积分数在75%~85%范围内,提取物得率与乙醇体积分数不具有显著相关性。

图1 奇楠和传统沉香不同提取方法的提取物得率Fig.1 The yield of extracts of Qinan and traditional agarwood in different extraction methods
当提取溶剂为水时,无论是热提法还是冷提法,传统沉香的提取物得率均大于奇楠,这是因为水提取物多为极性化合物,而奇楠的主成分2-(2-苯乙基)色酮难以通过水溶液提取出来。随着乙醇体积分数的升高,奇楠提取物得率逐渐大于传统沉香。当乙醇体积分数为35%时,热提法奇楠的提取物得率仍然低于传统沉香,但是冷提法奇楠的提取物得率已经高于传统沉香。当乙醇体积分数高于35%时,相同的提取条件下奇楠的提取物得率始终高于传统沉香,这说明相比于传统沉香,奇楠具有乙醇提取物得率高的明显优势[14]。
2.1.2倍半萜类化合物 对奇楠和传统沉香提取物进行GC-MS分析。通过“一标多测”的方法[14,16],对主要色谱峰进行定性、定量分析,其中烯类倍半萜采用α-石竹烯进行半定量,烯类倍半萜衍生物包括醇类和醛类倍半萜采用蓝桉醇进行半定量,结果如表2和表3所示。
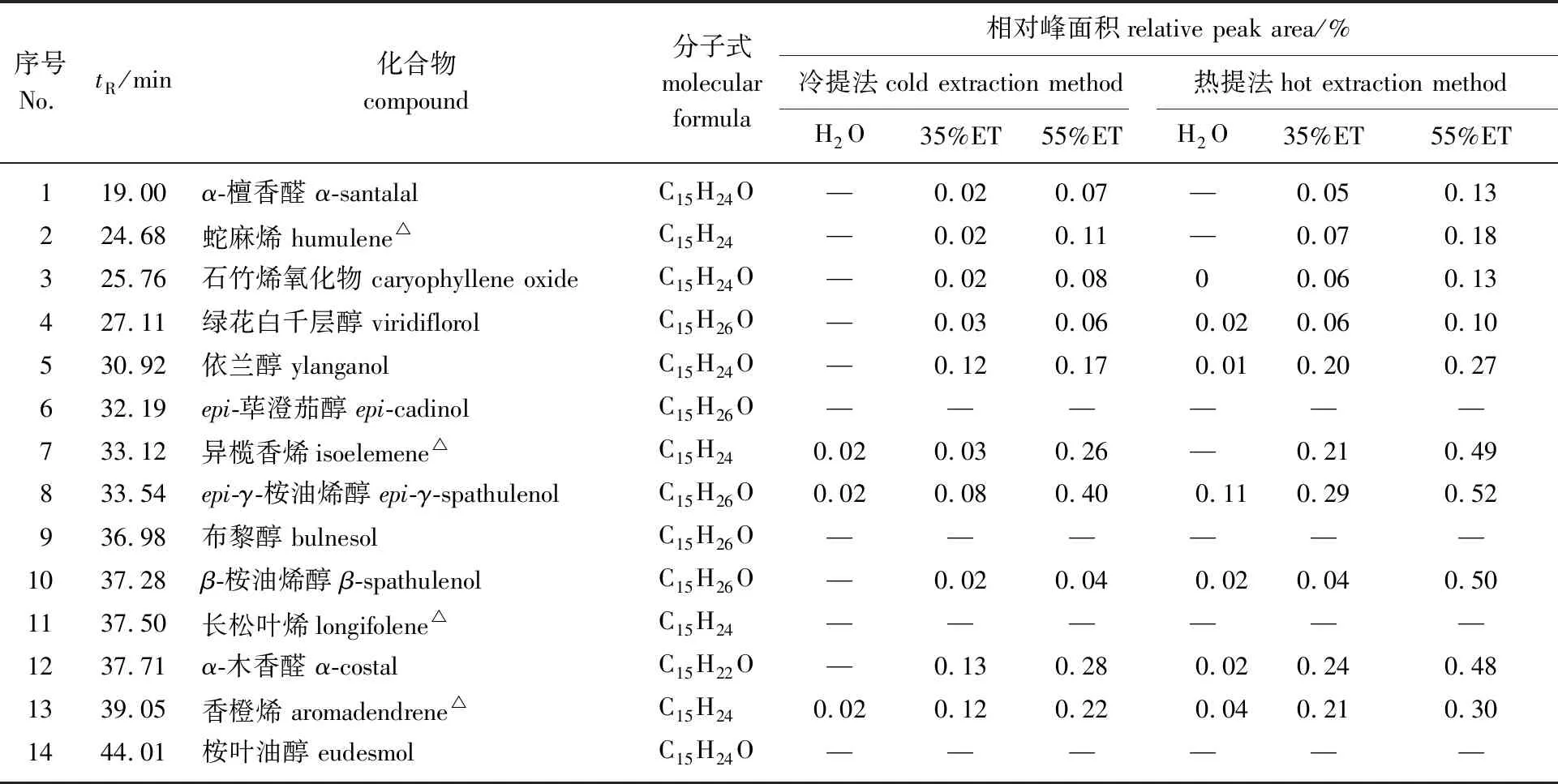
表2 奇楠提取物中倍半萜类化合物的GC-MS分析1)
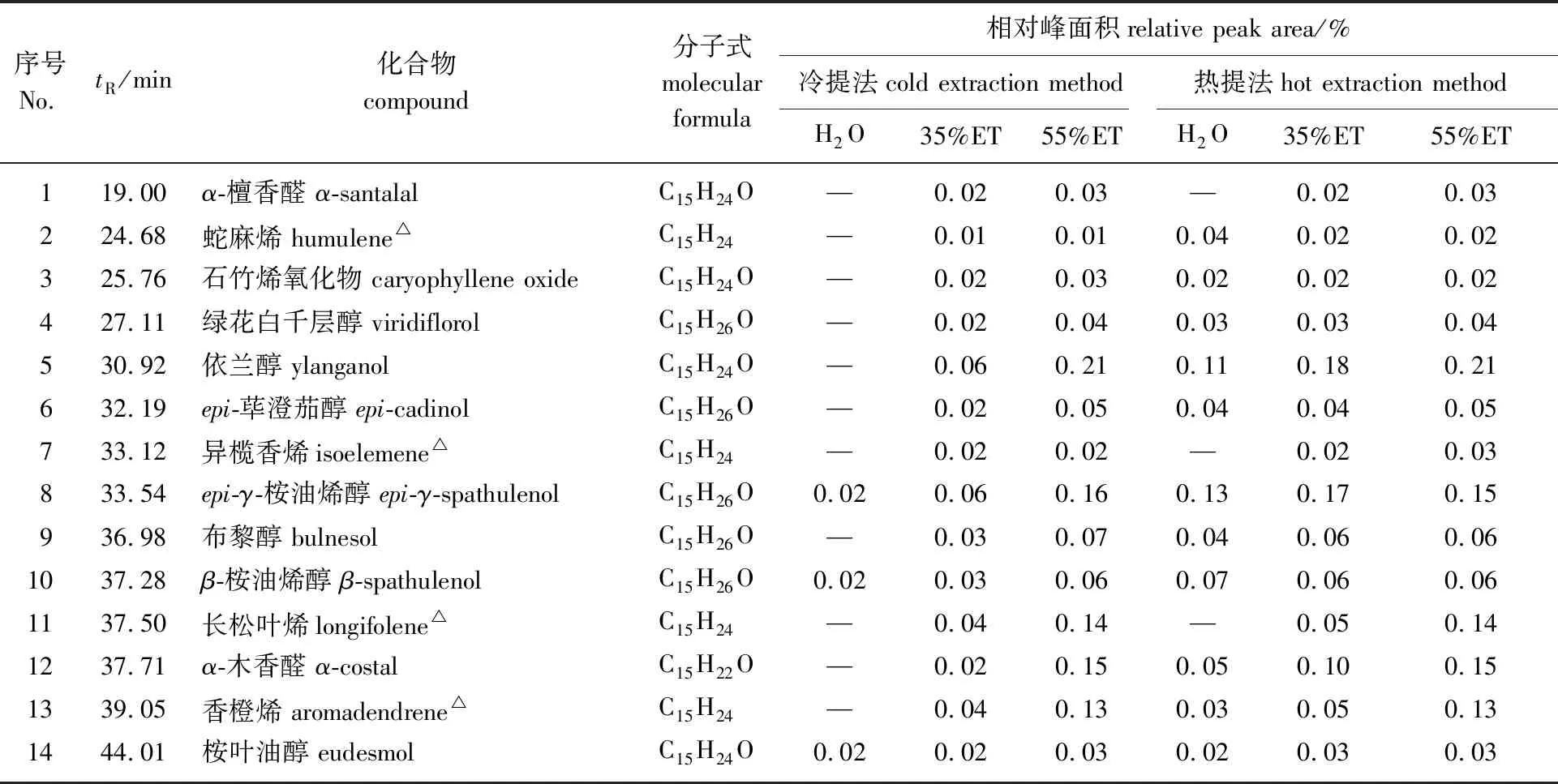
表3 传统沉香提取物中倍半萜类化合物的GC-MS分析
1)tR:保留时间retention time; 35%ET:提取溶剂为体积分数35%乙醇the extraction solvent was volume fraction 35% ethanol; 55%ET:提取溶剂为体积分数55%乙醇the extraction solvent was volume fraction 55% ethanol;:α-石竹烯定量quantification withα-caryophyllene,其余以蓝桉醇定量others were quantified as globulol;下同similarly hereinafter
由表可知,奇楠和传统沉香水提取物中倍半萜类化合物的种类与含量显著低于乙醇提取物,在水提取物中仅鉴定出少量的倍半萜类化合物,如epi-γ-桉油烯醇、香橙烯等。随着乙醇体积分数的升高,倍半萜类化合物的种类与含量逐渐增加,35%乙醇和55%乙醇提取物化学成分的种类差异较小,但含量存在显著差异。55%乙醇提取物化学成分含量高于35%乙醇提取物,同时热提法提取物化学成分的含量高于冷提法,采用55%乙醇热提时倍半萜类化合物的含量达到最大。这是因为倍半萜类化合物极性中等,易溶于乙醇而不易溶于水[17],因而奇楠与传统沉香水提取物中倍半萜类化合物含量较低。
2.1.3色酮类化合物 图2为不同提取条件下奇楠和传统沉香提取物的HPLC分析结果。

a.55% ET,HE; b.55% ET,CE; c.35% ET,HE; d.35% ET,CE; e.H2O,HE; f.H2O,CE
根据色酮化合物的结构,可将其分为3部分,其中保留时间在5~17 min主要为5,6,7,8-四氢-2-(2-苯乙基)色酮(THPECs),18~36 min主要为双环氧-2-(2-苯乙基)色酮(DEPECs)和单环氧-2-(2-苯乙基)色酮(EPECs),37~85 min主要为Flidersia型2-(2-苯乙基)色酮(FTPECs)。通过与相应对照品的保留时间比对,鉴定出沉香四醇、 4-甲氧基沉香四醇、异沉香四醇、 6-羟基-2-(2-苯乙基)色酮、 6,7-二甲氧基-2-(2-苯乙基)色酮、 2-(2-苯乙基)色酮6个化合物,并对这6种化合物采用外标法定量,标准曲线如表1所示。此外,通过质谱离子碎片信息并结合文献[18]鉴定出7个化合物,色酮类化合物结构具有相似性,因此以沉香四醇为内参物采用“一线多评法”[14]对这7个化合物进行半定量,结果见表4、表5。

表4 奇楠提取物中2-(2-苯乙基)色酮类化合物
由表4可知,奇楠水提取物中基本不含色酮类化合物。随着乙醇体积分数的升高,奇楠中DEPECs、EPECs以及FTPECs色酮含量逐渐增加,尤其是出现了2-(2-苯乙基)色酮与2-[2-(4-甲氧基苯)乙基]色酮2个含量极高的FTPECs色酮,当热提法乙醇体积分数达到55%时,2-(2-苯乙基)色酮质量分数达到10.87%,2-[2-(4-甲氧基苯)乙基]色酮质量分数达到4.80%。究其原因,奇楠中易被水提取的极性较大的THPECs型色酮含量极低,而极性较小的FTPECs型色酮,如2-(2-苯乙基)色酮和2-[2-(4-甲氧基苯)乙基]色酮虽然含量高,但是易溶于乙醇而不易溶于水,因而导致奇楠水提取物中色酮类化合物含量极低,且随着乙醇体积分数的升高奇楠乙醇提取物中色酮类化合物含量增加。
由表5可知,相比于奇楠,传统沉香提取物中THPECs型色酮含量丰富,并鉴别出其中的3个THPECs型色酮分别为沉香四醇、 4’-甲氧基沉香四醇、异沉香四醇。3个化合物在传统沉香热提法水提取物中质量分数最高,分别为1.50%、 0.26%、 0.17%,而55%乙醇热提法提取时,3个化合物的质量分数分别为1.23%、 0.20%、 0.16%。可以发现水提取物中THPECs型色酮的含量高于乙醇提取物,因此水提法适用于提取THPECs型色酮[19]。然而,奇楠中不存在4-甲氧基沉香四醇、异沉香四醇,仅检测到微量的沉香四醇。相比于奇楠,传统沉香提取物中FTPECs型色酮含量较低,奇楠中含量较高的2-(2-苯乙基)色酮和2-[2-(4-甲氧基苯)乙基]色酮在传统沉香中最高质量分数仅为0.70%和0.44%。
2.2 提取物的抗氧化活性
2.2.1ABTS自由基清除率 乙醇体积分数越高,奇楠和传统沉香提取物对ABTS·的清除率也越高,但二者对ABTS·的清除率有一定差异。当乙醇体积分数分别为0%(即水)、 35%和55%时,奇楠热提法提取物对ABTS·的清除率分别为40.1%、 82.4%和94.0%,传统沉香的清除率分别为66.1%、 76.8%和88.2%。提取溶剂为水时,传统沉香提取物对ABTS·的清除率要高于奇楠,当乙醇体积分数分别为35%和55%时,奇楠提取物对ABTS·的清除率要高于传统沉香,与提取物得率关系一致,这说明对ABTS·的清除率与提取物得率存在正相关。
2.2.2总抗氧化能力 奇楠与传统沉香提取物铁原子还原能力结果表明:0%(即水)、 35%乙醇和55%乙醇的奇楠热提法提取物对铁离子的还原能力分别为0.36、 1.50和3.45 mmol/L,传统沉香为0.64、 1.17和1.35 mmol/L。奇楠和传统沉香提取物的铁离子还原能力随着乙醇体积分数的增加而增加,这说明对铁离子还原能力也与提取物得率存在正相关。
乙醇体积分数对奇楠和传统沉香提取物中化学成分的种类和含量产生影响,进而导致其抗氧化能力的不同。倍半萜类化合物和色酮类化合物被认为是沉香具有抗氧化活性的主要成分,以倍半萜为主要成分的沉香精油在一定浓度下具有较好的抗氧化活性[20],且研究表明萜烯类化合物在抗氧化活性上具有一定的协同作用[21]。此外,奇楠与传统沉香中的部分色酮类化合物如6-羟基-2-[2-(4-羟基-3-甲氧基苯)乙基]色酮也具有抗氧化活性[22]。奇楠水提取中未检测到此物质,但其存在于传统沉香水提取物中,并且奇楠醇提物中6-羟基-2-[2-(4-羟基-3-甲氧基苯)乙基]色酮的含量高于传统沉香,这可能也是传统沉香水提取物抗氧化活性高于奇楠,但是醇提取物抗氧化活性低于奇楠的重要原因。
2.3 提取物的抑菌活性
采用琼脂打孔法对奇楠和传统沉香0%(即水)、 35%乙醇、 55%乙醇的热提法提取物抑菌活性进行评价,结果表明:奇楠与传统沉香提取物对大肠杆菌均未显示出抑菌活性,与Wetwitayaklung等[23]研究结果一致。对于白色念珠菌,奇楠和传统沉香水提取物均具有抑制作用,抑菌圈直径分别为11.13和12.82 mm,传统沉香水提取物的抑制效果优于奇楠。但是奇楠和传统沉香乙醇提取物对白色念珠菌均未显示出抑制效果,杨德兰[24]同样发现国产绿奇楠的乙醚提取物和乙醇提取物对白色念珠菌未显示出抑菌活性,与本研究的结果一致。由此可见,沉香提取物具有抑菌活性[1,25],但不具有广谱抑菌性,因此后续研究需要进一步明确奇楠和传统沉香提取物对不同细菌和真菌的抑菌活性。
3 结 论
3.1采用热提法提取时,乙醇体积分数在0%~55%范围内,提取物得率与乙醇体积分数具有显著的相关性;采用冷提法提取时,乙醇体积分数在0%~75%范围内,提取物得率与乙醇体积分数具有显著的相关性;传统沉香的水提取物得率高于奇楠,随着乙醇体积分数的增加,奇楠提取物得率逐渐高于传统沉香。
3.2奇楠提取物中倍半萜类化合物的种类少于传统沉香,但是两者共有的倍半萜类化合物含量奇楠高于传统沉香。奇楠提取物中基本不含THPECs,主要为FTPECs,其中2-(2-苯乙基)色酮质量分数可达10.87%,2-[2-(4-甲氧基苯)乙基]色酮质量分数为4.80%。传统沉香提取物中THPECs种类和含量丰富,沉香四醇质量分数可达1.50%。
3.3热提法奇楠与传统沉香提取物均具有显著的抗氧化活性,且ABTS自由基清除能力和铁离子还原能力都随乙醇体积分数提高而增加。奇楠水提取物的抗氧化活性低于传统沉香,但乙醇提取物抗氧化活性高于传统沉香。
3.4奇楠与传统沉香水提取物和乙醇提取物均对大肠杆菌无显著的抑菌活性,奇楠和传统沉香水提取物对白色念珠具有抑菌活性,但乙醇提取物对白色念珠菌无明显抑制作用。
——青蒿素

