血清miR-125a-3p、miR-224-3p 表达与脑梗死患者颈动脉粥样硬化斑块的关系
李 星 刘京锋 李 博
北京市和平里医院神经内科,北京 100013
调查数据显示,我国脑梗死年发病率为144.8/10万,死亡率为62.2/10 万,已成为居民死亡的主要原因之一[1]。动脉粥样硬化(atherosclerosis,AS)斑块破裂引起的血管狭窄或阻塞是脑梗死发生的重要原因[2]。目前临床主要依靠影像学检查颈动脉粥样硬化(carotid atherosclerosis,CAS)斑块判断斑块稳定性,尚缺乏理想的生物标志物[3]。研究表明,炎症反应和微RNA(microRNA,miRNA)在AS 发生发展中扮演重要角色[4-5]。miR-125a-3p 和miR-224-3p 是新近发现的广泛保守的miRNA 分子,研究报道miR-125a-3p和miR-224-3p参与炎症反应过程[6-7]。同时有研究指出,miR-125a-3p 能通过加重血管狭窄促进AS 发生[8],miR-224-3p能通过抑制炎症反应抑制AS 形成[9]。然而关于血清miR-125a-3p、miR-224-3p 表达与脑梗死患者CAS斑块稳定性的关系尚不清楚,本研究对此进行分析。
1 资料与方法
1.1 一般资料
选取2019 年3 月至2021 年12 月北京市和平里医院(以下简称“我院”)收治的120 例脑梗死患者。纳入标准:①符合脑梗死诊断标准[10];②年龄≥18 岁;③经超声检查证实存在CAS 斑块;④首次诊治;⑤资料完整。排除标准:①脑出血或近3 个月内颅脑手术史或外伤史;②合并造血、免疫系统损害、恶性肿瘤;③合并严重实质性脏器损伤;④近3 个月内有急慢性感染;⑤近6 个月内有免疫抑制剂、激素使用史。参考《中国脑卒中血管超声检查指导规范》[11],将不规则斑块(斑块表面不光滑和纤维帽不全,管腔血流充盈不全)和溃疡性斑块(斑块表面纤维帽不连续破裂,形成“火山口”征)判定为不稳定斑块。根据CAS 斑块稳定性将患者分为不稳定组(75 例)和稳定组(45例)。本研究经我院科教科伦理审批(2022-0015)。
1.2 研究方法
1.2.1 资料收集 收集患者资料,包括性别、年龄、体重指数、吸烟史、病史(高血压、糖尿病)、总胆固醇、甘油三酯、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)。
1.2.2 血清miR-125a-3p、miR-224-3p 检测 患者入院次日采集空腹静脉血3 ml,3 000 r/min 离心15 min(半径为10 cm),分离血清置于-80℃冰箱保存。Trizol 法提取血清总RNA,TaKaRa 反转录试剂盒(北京智杰方远科技有限公司,RR036A)合成cDNA。以cDNA 为模板,按照SYBRPremix Ex TaqTM试剂盒(上海赫果生物科技有限公司,DRR820A)说明书,采用PCR 仪(美国ABI,型号:ABI7500)进行PCR 扩增。反应体系共20.0 μl:cDNA 模板1.0 μl、2×Master mix 8 μl、正向引物0.5 μl,反向引物0.5 μl、SYBRPremix Ex Taq 5.0 μl、RNase-free ddH2O 5.0 μl。反应条件:95℃90 s、95℃30 s、63℃30 s、72℃15 s,循环40 次后收集 Ct 值,2-ΔΔCT法计算血清 miR-125a-3p、miR-224-3p 相对表达量。引物设计和合成由上海剑钝生物科技有限公司完成,miR-125a-3p 正向引物序列为5’-TAACCGCAGAGGTCACACTCAG-3’,反向引物序列为5’-CTCAGAAACTGTGGCATCCCGA-3’。miR-224-3p 正向引物序列为 5’-TAATCTCAGCTGGCAACTGTG-3’,反向引物序列为5’-GAACATGTCTGCGTA-TCTC-3’。miR-125a-3p内参U6 正向引物序列为5’-ACTTTCACGCCGCTCATCCAGT-3’,反向引物序列为5’-TCTCAGGACTGGTTCACAG-CGT-3’。miR-224-3p 内参U6 正向引物序列为5’-CTCGCTTCGGCAGCACAT-3’,反向引物序列为5’-TTTGCGTGTCATCCTT-GCG-3’。
1.3 统计学方法
采用SPSS 28.0 统计学软件进行数据分析。计量资料采用均数±标准差()表示,比较采用t 检验;计数资料采用例数和百分率表示,比较采用χ2检验。采用logistic 回归模型分析影响因素;Hosmer-Lemeshow检验模型拟合度;采用受试者操作特征曲线分析诊断价值。以P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床资料比较
不稳定组吸烟者占比、糖尿病患者占比、LDL-C、miR-125a-3p 表达高于稳定组,miR-224-3p 表达低于稳定组,差异有统计学意义(P<0.05)。见表1。

表1 两组临床资料比较
2.2 脑梗死患者CAS 斑块稳定情况的影响因素分析
以吸烟(是=1;否=0)、糖尿病(有=1;无=0)、LDL-C(原值录入)、miR-125a-3p(原值录入)、miR-224-3p(原值录入)为自变量,CAS 斑块稳定性(不稳定=1;稳定=0)为因变量进行多因素分析,结果显示,吸烟、糖尿病、LDL-C、miR-125a-3p、miR-224-3p 为脑梗死患者CAS 斑块不稳定的影响因素(P<0.05)。见表2。
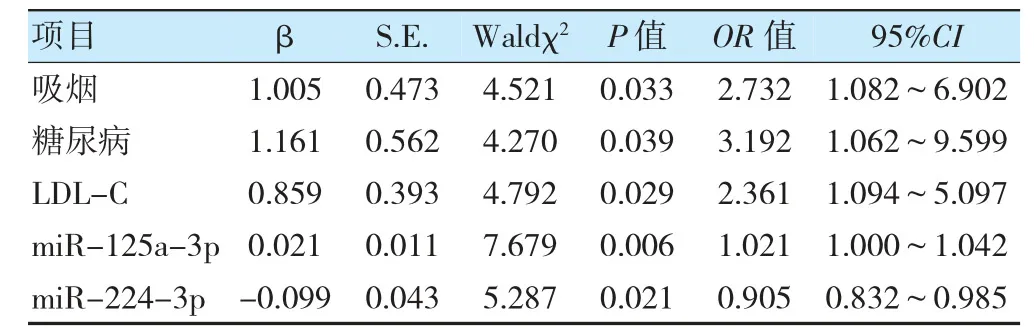
表2 脑梗死患者CAS 斑块稳定情况的影响因素分析
2.3 脑梗死患者CAS 斑块不稳定的预测模型及其诊断价值
以CAS 斑块不稳定的独立影响因素构建预测模型Log=P/(1-P)=0.973×吸烟+1.161×糖尿病+1.866×LDL-C+0.034×miR-125a-3p-0.668×miR-224-3p。Hosmer-Lemeshow 检验结果显示模型拟合效果良好(χ2=14.377,P=0.072)。受试者操作特征曲线分析显示,该模型预测脑梗死患者CAS 斑块不稳定的曲线下面积为0.915(95%CI:0.850~0.958,P<0.05),截断值为0.625,约登指数、灵敏度、特异度分别为0.751、84.00%、91.11%。见图2。

图1 脑梗死患者颈动脉粥样硬化斑块不稳定预测模型的受试者操作特征曲线
3 讨论
炎症反应贯穿AS 发生发展的全过程,在AS 初期炎症反应能损害血管内皮和促进血管平滑肌增殖、迁移等促进AS 形成和发展,在AS 后期炎症反应能诱导细胞外基质降解增加和合成减少,导致斑块纤维帽变薄,最终引起斑块不稳定和破裂[12-17]。近年来随着生命科学的快速发展,研究发现,miRNA 能通过引发mRNA 降解或转录后沉默,通过调控炎症反应等参与AS 发生发展[18-20]。miR-125a-3p 定位于人染色体19q13.41,参与炎症反应发生发展,Wang 等[21]研究报道,下调miR-125a-3p 能靶向Wnt/β-连环蛋白和核因子κB 通路抑制成纤维细胞样滑膜细胞的炎症反应。Wang 等[22]研究报道,下调miR-125a-3p 能靶向酪氨酸蛋白激酶Fyn 抑制核因子κB 通路,抑制成牙母细胞的炎症反应。上述研究提示,miR-125a-3p 具有促炎作用。同时有研究指出,miR-125a-3p 表达上调会加重低密度脂蛋白诱导血管内皮细胞损害,促进AS 形成[23]。本研究显示,不稳定组血清miR-125a-3p表达升高,进一步分析发现,血清miR-125a-3p 表达升高为脑梗死患者CAS 斑块不稳定的独立危险因素,提示血清miR-125a-3p 表达上调与脑梗死患者斑块不稳定有关,分析原因可能与miR-125a-3p 表达上调通过促进炎症反应发展,诱导AS 斑块不稳定有关。刘演龙等[24]研究也发现,抑制miR-125a-3p 能减轻AS 斑块炎症反应和细胞外基质降解,增强AS斑块稳定性。
miR-224-3p 定位于人染色体Xq28,研究报道[25]miR-224-3p 能通过抑制白细胞介素-1β 减轻软骨细胞炎症反应。Wang 等[26]研究指出,上调miR-224-3p能减轻血管内皮炎症反应,发挥内皮保护和抗AS 作用。这些研究提示,miR-224-3p 具有抗感染作用。本研究结果显示,不稳定组血清miR-224-3p 表达降低,进一步分析发现,血清miR-224-3p 表达升高为脑梗死患者CAS 斑块不稳定的保护因素,提示血清miR-224-3p 表达下调与脑梗死患者斑块不稳定有关,分析原因可能是miR-224-3p 表达下调导致炎症进展,进而引起AS 斑块不稳定。巨噬细胞在AS 炎症反应发生发展中发挥重要作用,研究表明,miR-224-3p 能靶向肿瘤坏死因子超家族成员14 抑制巨噬细胞向炎症表型转换,减轻巨噬细胞内脂质积聚,进而增强AS 斑块稳定性[27]。
本研究结果显示,吸烟、糖尿病和LDL-C 升高也会增加脑梗死患者CAS 斑块不稳定,分析原因可能是吸烟和糖尿病均能增强机体炎症反应,通过破坏斑块纤维帽导致斑块不稳定性增加[28];LDL-C 是AS 斑块形成的必要条件,LDL-C 升高会促进AS 进一步发展,导致斑块不稳定性风险增加[29-31]。本研究联合吸烟、糖尿病、LDL-C、miR-125a-3p、miR-224-3p 构建脑梗死患者CAS 斑块不稳定的预测模型,结果显示该模型的曲线下面积为0.915,提示其预测价值较高。
综上所述,脑梗死患者血清miR-125a-3p 表达升高,miR-224-3p 表达降低,可能成为脑梗死患者CAS斑块不稳定的辅助评估指标。但本研究结果还需多中心大样本研究证实。

