微RNA-142-5p 与E2F7 基因的关系及其影响胰腺癌增殖、侵袭、转移的机制研究
阿木提江·马合木提 郑坚江 迪里夏提·阿力木
新疆维吾尔自治区人民医院胰腺外科,新疆乌鲁木齐 830001
胰腺癌(pancreatic cancer,PC)相关死亡率居中国癌症相关死亡率的第六位[1],尽管手术、化疗和放疗等方法取得了巨大进步,但其5 年生存率仍较差[2-3]。微RNA(microRNA,miRNA)是短链非编码RNA 分子,其通过与靶基因结合的方式调节基因表达[4-5]。最近,许多研究发现miRNA 在肿瘤中表达异常[6-8],其中miR-142-5p 在疾病中存在表达失调[9-13]。E2F 转录因子家族在细胞周期和肿瘤进程中起作用[14-15],研究发现E2F7在许多类型的肿瘤中上调[16],但其在不同癌症中所起的作用存在争议。因此,本研究探讨miR-142-5p与E2F7 基因的关系及其影响PC 增殖、侵袭、转移的机制,为PC 的生物标志物筛选提供依据。
1 材料与方法
1.1 临床样本
选择2016 年12 月至2019 年1 月于新疆维吾尔自治区人民医院(以下简称“我院”)接受手术治疗的35 例PC 患者,患者术前未接受任何化疗、放疗或免疫治疗,其癌及癌旁组织切除后在液氮中保存。患者均签署广泛性知情同意书,本研究经过我院医学伦理委员会审批[2016 年(12)01 号]。
1.2 细胞培养
人PC 细胞系(CFPAC-1、SW1990、Capan-1、PANC-1)和正常胰管上皮细胞系(HPDE)购自北纳生物有限公司。细胞放置在5%CO2和37℃的培养箱中,在含有10%胎牛血清(美国Gibco,10099)的RPMI-1640 培养基(美国Gibco,A1049101)中培养。
1.3 细胞转染
1.4 实时荧光定量PCR 检测mRNA 相对表达量
使用SYBR Green PCR 试剂盒(日本TaKaRa,RR 407A)分析miR-142-5p 及E2F7 mRNA 的表达。U6和GAPDH 分别为miR-142-5p 和E2F7 mRNA 的内参基因。miR-142-5p 引物正向序列为5’-CAUAAAGUAGAAAGCACUACU-3’,反向序列为5’-UAGUGCUUUCUACUUUAUGUU-3’;U6 引物正向序列为5’-CTCGCTTCGGCAGAC-3’,反向序列为5’-AACGCTTACGAATTT-3’;E2F7 mRNA 引物正向序列为5’-CAAGCTAGTAGTCCTTGGTTCAG-3’,反向序列为 5’-GGAATCTTCTATCGTTGGGTCAT-3’;GAPDH引物正向序列为5’-AACAGCAACTCCCACTC -TTC-3’,反向序列为5’-CCTGTTGCTGTAGCCGTATT-3’。循环条件:95℃变性10 min,随后95℃10 s、55℃10 s 和72℃30 s 40 个循环。PCR 反应体系为SYBR染色剂(2×)10 μl,正向引物(10 μmol/L)0.5 μl,反向引物(10 μmol/L)0.5 μl,cDNA 1.0 μl;ddH2O 9.0 μl。采用2-△△Ct法对基因表达进行相对定量。
1.5 蛋白质印迹法检测蛋白的相对表达量
蛋白质电泳转印后用5%脱脂牛奶的磷酸盐缓冲液封闭后用anti-E2F7(广州西格生物科技有限公司,XG-K9691),anti-GAPDH(美国Abcam,ab8245),浓度为1 μg/ml,孵育过夜后加入辣根过氧化物酶结合的二抗(Santa Cruz Company)(1∶5 000)。通过化学发光试剂盒(美国Millipore Company,mc175968)检测条带灰度值。
1.6 双萤光素酶报告基因检测
采用Starbase 数据库(https://starbase.sysu.edu.cn/)对miR-142-5p 和E2FE 基因的靶向位点和结合序列进行预测。合成miR-142-5p 预测靶位点内的E2F7 基因野生型(wild type,wt)或突变体(mutant,mut),并克隆到pGL3 控制载体(美国Promega Madison,WI)。将1×105个细胞接种到24 孔板中,待融合度达到80%后再转染。通过Lipofectamine2000 试剂(美国Life Technologies)将E2F7 的wt 或mut 的3’非翻译区(untranslated region,UTR)共转染到miR-142-5p minmics 组、NC 组中,通过双萤光素酶(美国Promega,E1960)报告系统评估萤光素酶活性。
1.7 细胞增殖实验
通过CCK-8 试剂盒(碧云天生物技术有限公司,C0037)来确定细胞活力,按照制造商的操作说明检测各细胞增殖情况。
1.8 细胞凋亡检测
收集各组细胞后用5 μl 膜联蛋白V 和5 μl 碘化丙啶稀释的100 μl 缓冲液,应用凋亡检测试剂盒(南京建成科技有限公司,G003-1-2)染色20 min 后,通过流式细胞仪(美国FACScan,FA-4570)检测凋亡率。
1.9 Transwell 侵袭实验
Transwell 上室涂有基质胶。将2×105个细胞与不含血清的培养基一起加入上室,下室含有DMEM 和20%胎牛血清(美国Gibco,10099)。然后将细胞在37℃、5%CO2条件下培养48 h。随后,使用棉签去除上室中的细胞,下室固定并用DAPI 染色5 min。基于显微镜捕获的数字图像,使用Image J 软件计算侵入膜的细胞数量。
1.10 划痕实验
将各处理组细胞接种到6 孔培养皿中,在适当条件下培养48 h。用消毒的移液管尖端在细胞单层上产生伤口,然后用磷酸盐缓冲液洗涤细胞并在含有10%FBS 的DMEM 中孵育48 h。在倒置显微镜下分别在0、24 h 观察划痕愈合情况,并通过从相应的原始划痕宽度中减去愈合后划痕宽度来测量。
1.11 裸鼠成瘤实验
20 只雄性BALB/c 裸鼠(4~6 周龄)购自北京维通利华实验动物有限公司,用于建立裸鼠异种移植模型采用随机数字表法将其分为NC 裸鼠组、si-E2F7裸鼠组、E2F7 裸鼠组及miR-142-5p mimics+E2F7 裸鼠组,每组5 只。在整个实验过程中,所有裸鼠都被置于无病原体的环境中,将5×106个不同处理组细胞与100 μl 的人工基膜混合后皮下注射于裸鼠前腿下方的皮肤。所有裸鼠于注射后第30 天处死,肿瘤体积每5 天用卡尺测量,肿瘤体积=长(mm)×宽(mm)×宽(mm)/2。
1.12 统计学方法
采用SPSS 22.0 统计学软件进行数据分析。计量资料采用均数±标准差()表示,比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 miR-142-5p 在PC 中的表达
PC 患者癌组织中miR-142-5p 表达低于癌旁组织,CFPAC-1、SW1990、Capan-1、PANC-1 细胞中miR-142-5p 表达低于HPDE 细胞(P<0.05)。见图1。

图1 miR-142-5p 在PC 中的表达
2.2 E2F7 基因在PC 中的表达及与miR-142-5p的关系
PC 患者癌组织中E2F7 mRNA 表达高于癌旁组织,Capan-1、PANC-1 细胞中E2F7 mRNA 及其蛋白表达高于HPDE 细胞(P<0.05)。Starbase 数据库分析结果显示,miR-142-5p 与E2F7 基因的3’UTR 存在互补。双萤光素酶报告基因结果显示,共转染E2F7-wt后,miR-142-5p mimics 组萤光素酶活性低于NC 组(P<0.05);共转染E2F7-mut 后,miR-142-5p mimics组萤光素酶活性与NC 组比较,差异无统计学意义(P>0.05)。见图2。
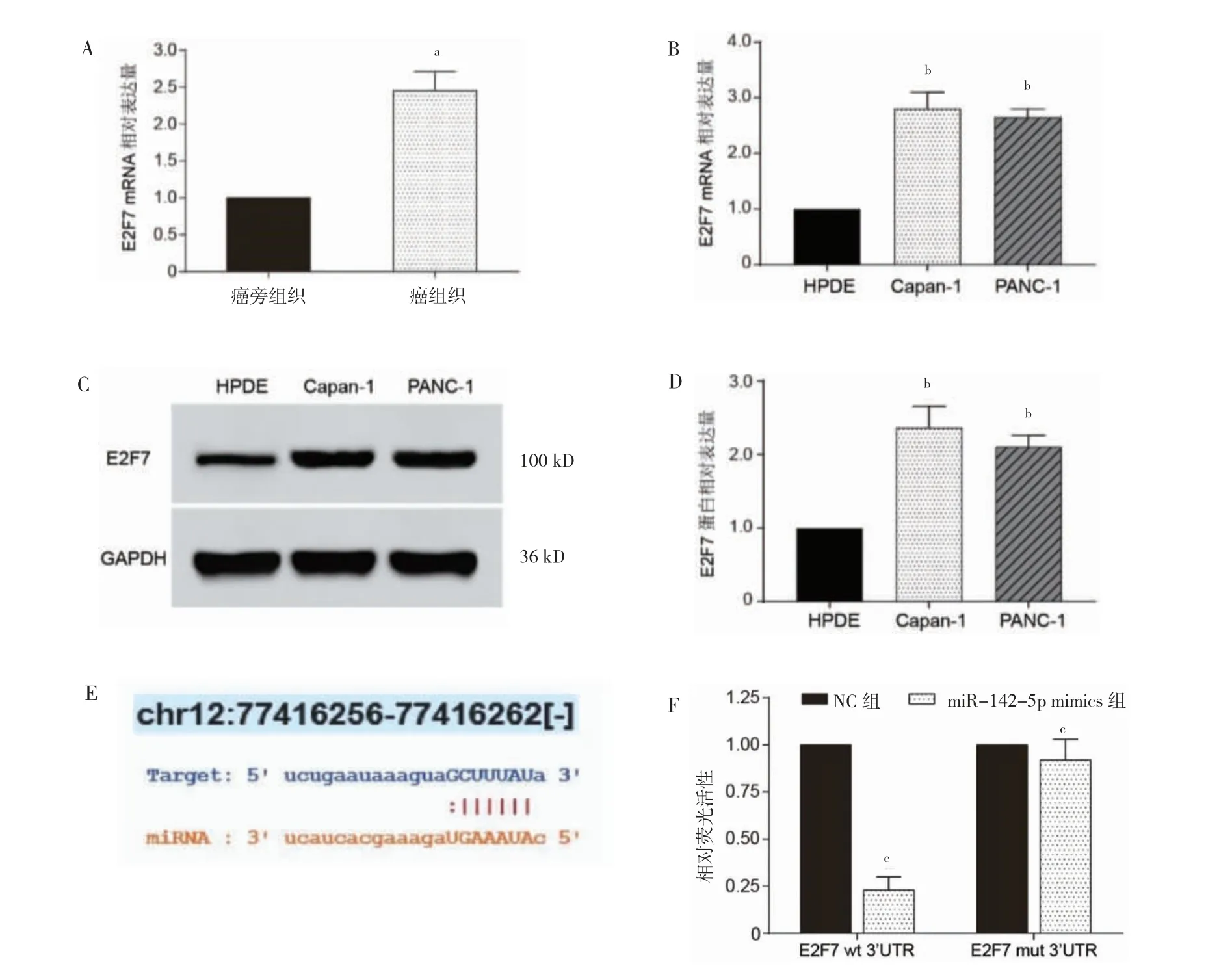
图2 E2F7 基因在PC 中的表达及与miR-142-5p 的关系
2.3 miR-142-5p 调控E2F7 基因对Capan-1 细胞功能的影响
E2F7 组E2F7 mRNA 及其蛋白表达、细胞活力、划痕愈合面积、相对侵袭细胞数高于NC 组,细胞凋亡率低于NC 组(P<0.05)。miR-142-5p mimics+E2F7 组mRNA 及其蛋白表达、细胞活力、划痕愈合面积、相对侵袭细胞数低于E2F7 组,细胞凋亡率高于E2F7 组(P<0.05)。见图3。
2.4 miR-142-5p 调控E2F7 基因对肿瘤生长的影响
E2F7 裸鼠组肿瘤体积、重量高于NC 裸鼠组,miR-142-5p mimics+E2F7 裸鼠组肿瘤体积、重量低于E2F7 裸鼠组(P<0.05)。苏木精-伊红染色显示,E2F7 裸鼠组肿瘤具有较强的转移能力,而miR-142-5p mimics+E2F7 裸鼠组肿瘤的转移能力较差。见图4。

图4 miR-142-5p 调控E2F7 基因对肿瘤生长的影响(n=5)
3 讨论
miRNA 调节癌症进展中的细胞增殖、凋亡、分化、侵袭和迁移,其通过调控不同靶基因发挥作用[17-18]。另有数据显示,miR-142-5p 过表达会抑制PC 生长[19]。本研究发现,miR-142-5p 在PC 中低表达,miR-142-5p能够抑制E2F7 基因过表达的PC 细胞增殖且促进细胞凋亡,可能原因为miRNA 通过降解mRNA 或抑制其翻译来调节基因表达[20-25]。本研究结果显示,E2F7基因是miR-142-5p 的靶基因之一,并且在PC 中高表达。转染miR-142-5p 模拟物的细胞活力受到抑制,而E2F7 基因过表达PC 细胞的活力增强。本研究结果显示,E2F7 组细胞凋亡率低于NC 组,miR-142-5p mimics+E2F7 组细胞凋亡率高于E2F7组,同时E2F7 组细胞具有更强的迁移和侵袭能力,而miR-142-5p mimics+E2F7 组细胞的迁移和侵袭能力受到抑制。
综上,本研究结果提示miR-142-5p 通过调控E2F7 基因表达抑制PC 细胞的增殖、迁移和侵袭,可为预测PC 的预后和治疗靶点提供新的生物标志物。

