基于网络药理学和分子对接探讨三黄泻心汤治疗阿尔茨海默病的机制
王一帆 张喆 田财军


摘要:運用网络药理学方法探讨三黄泻心汤治疗阿尔茨海默病(Alzheimer′s disease, AD)的作用机制。利用中药系统药理学数据库与分析平台检索并筛选出三黄泻心汤的有效成分及作用靶点。通过GeneCards数据库检索并筛选出AD相关靶点,维恩图获取药物与疾病交集靶点。使用STRING数据库得到蛋白质-蛋白质相互作用( protein-protein interaction, PPI)网络信息。使用Cytoscape构建药物-有效成分-靶点-疾病网络与PPI网络图,通过DAVID数据库对共同靶点进行GO( gene ontology)和KEGG ( Kyoto encyclopedia of genes and genomes)分析。使用SYBYL-X 2.1.1软件进行分子对接验证。筛选出三黄泻心汤47个有效成分,71个药物与疾病交集靶点,主要活性成分为槲皮素、β-谷甾醇、汉黄芩黄素、黄芩新素、半枝莲种素、苏荠苎黄酮,核心靶点为IL-6、TNF、IL-1β、VEGFA、TP53。GO功能分析主要涉及药物反应、缺氧反应、细胞迁移的正向调节、一氧化氮生物合成过程的正调控等生物过程,KEGG分析主要涉及癌症通路、HIF-1信号通路、TNF信号通路等通路。分子对接结果显示,β-谷甾醇、半枝莲种素等核心成分,与TP53、IL-6等核心靶点之间有着较强的结合能力。初步阐释了三黄泻心汤可通过调节HIF-1、TNF等信号通路,从而抑制Aβ聚集与tau磷酸化、阻断乙酰胆碱酯酶活化、抑制炎症进而干预阿尔茨海默病。
关键词:网络药理学;分子对接;阿尔茨海默病;三黄泻心汤
中图分类号:R285 文献标志码:A 文章编号:1002-4026(2023)05-0019-08
Mechanism of Sanhuang Xiexin decoction in treatment of Alzheimer′s disease based on network pharmacology and molecular docking method
WANG Yifana,ZHANG Zheb,TIAN Caijunc*
(a. School of Traditional Chinese Medicine; b. School of Foreign Languages; c. School of The First Clinical Medical, Shandong University of Traditional Chinese Medicine, Jinan 250013, China)
Abstract∶The aim of this study was to investigate the mechanism of action of Sanhuang Xiexin Decoction in the treatment of Alzheimer′s disease (AD) using a network pharmacology approach. The active ingredients and targets of the Sanhuang Xiexin decoction were examined and screened using the systematic pharmacology database and the analysis platform of traditional Chinese medicine. AD-related targets were retrieved and screened through Gene Cards database, and drug and disease intersection targets were obtained through through Venn diagram.The STRING database was used to obtain the network information of protein-protein interaction (PPI). The Cytoscape was used to construct drugs-active ingredients-target-disease network and PPI,and DAVID database was used to analyze common targets in gene ontology (GO) and Kyoto encyclopedia of genes and genomes (KEGG). Furthermore, the Sybyl-x 2.1.1 software was used for molecular docking validation. The screening yielded 47 active ingredients and 71 related targets. Herein,the main active ingredients were quercetin, β-sitosterol, wogonin, baicalein, rivularin, and moslosooflavone; and the core targets were IL-6,TNF,IL-1β,VEGFA,TP53.The GO function enrichment analysis predominantly involved biological processes including drug response, hypoxia response, positive regulation of cell migration,and positive regulation of nitric oxide biosynthesis.KEGG analysis mainly involved pathways such as cancer pathways, HIF-1 signaling pathways, and TNF signaling pathways.Molecular docking results showed the presence of a relatively strong binding ability between the core target and the core compounds, such as β-sitosterol and rivularin.This study preliminarily explained that the Sanhuang Xiexin Decoction can interfere with AD by modulating HIF-1, TNF, and other signaling pathways, thereby inhibiting Aβ aggregation and tau phosphorylation, blocking acetylcholinesterase activation, and suppressing inflammation.
Key words∶network pharmacology;molecular docking;Alzheimer′s disease;Sanhuang Xiexin decoction
阿尔茨海默病(Alzheimer′s disease, AD),又称原发性老年痴呆,以认知记忆障碍为特点,是一种具有不可逆性和致死性的中枢神经系统退行性病变。AD病理特征包括β-淀粉样蛋白(Aβ)的沉积、微管蛋白(tau)的异常磷酸化、突触损伤和神经功能障碍等[1-2],在疾病过程中,患者逐渐丧失记忆及思考能力,最终失去自主行为能力[3],是全世界老年人(年龄≥ 65岁)认知障碍和痴呆的主要原因[4],且AD的发病率、治疗和护理费用正在逐年快速增长,为国家医疗体系以及患者的家庭带来了沉重的压力[5]。目前美国食品药品监督管理局批准治疗AD药物包括胆碱酯酶抑制剂与NMDA受体拮抗剂两类,而自2003年以来,只有阿杜那单抗(aducanumab)被FDA批准用于治疗AD[6],且单纯采用西药治疗AD,作用靶点单一、不良反应较多,治疗效果并不理想。
中医理论认为,“毒损脑络”与“瘀血阻滞”在AD的发生过程中起着重要作用,因此清热解毒、活血逐瘀可作为治疗AD的原则[7-8]。三黄泻心汤出自东汉名医张仲景的《金匮要略》,由大黄、黄连、黄芩组成,具有清热解毒、活血逐瘀的功效。现代药理学研究认为,大黄中的大黄酚、大黄素具有清除自由基、抗氧化的作用[9],而黄连素、黄芩苷可以减少Aβ的生成并加速Aβ的降解[10-11],临床上在AD等疾病的治疗中效果明显。
本文通过网络药理学的方法预测三黄泻心汤治疗AD的活性化合物、潜在的靶点蛋白与信号通路,并通过分子对接进一步从受体与配体方面验证三黄泻心汤活性成分干预AD关键靶点的有效性,为其临床应用提供科学依据。
1 材料与方法
1.1 三黄泻心汤有效成分与作用靶点的获取
以黄连、黄芩、大黄为关键词,在中药系统药理学数据库与分析平台(Traditional Chinese Medicine systems pharmacology database and analysis platform,TCMSP)(http://tcmspw.com)上检索三黄泻心汤中3味中药所含的化学成分。筛选条件为类药性(Drug-likeness,DL)≥0.18且口服生物利用度(Oralbioavailability,OB)≥30%[12],[JP]初步筛选出三黄泻心汤有效化学成分及靶点,并通过Uniprot数据库(https://www.uniprot.org/)查询出靶点蛋白对应的基因名称。
1.2 AD靶点的收集
使用Gene Cards数据库(https://www.genecards.org/)与Drug Bank数据库(https://go.drugbank.com/),以Alzheimer′s disease为关键词进行搜索,收集AD的作用靶点,对检索出疾病靶点的相关分数(Relevance score)取3倍中位数[13],将相关分数大于等于3倍中位数评分的靶点作为AD疾病靶点。
1.3 疾病与药物共同靶点的筛选
将筛选出的三黄泻心汤有效成分靶点与AD疾病靶点,通过Venny在线绘制平台(http://www.bioinformatics.com.cn)绘制维恩圖,并获取三黄泻心汤有效成分靶点与AD疾病靶点的交集。
1.4 药物-有效成分-靶点-疾病网络的构建
将药物、有效成分、有效成分与疾病交集靶点、疾病名称导入Cytoscape 3.7.2软件中进行网络关系的构建与可视化分析。
1.5 蛋白质-蛋白质相互作用网络图的构建
将三黄泻心汤与AD交集靶点基因导入STRING 11.5(https://www.string-db.org/)数据库中进行蛋白质-[JP]蛋白质相互作用(protein-protein interaction,PPI)网络模型的构建,将物种类别选择“Homo sapiens”, 设置“置信分数≥0.4”[14],并将获得的蛋白交互信息导入Cytoscape 3.7.2软件进行可视化分析。
1.6 通路富集分析
使用DAVID数据库(https://david.ncifcrf.gov/)对三黄泻心汤与AD交集靶点进行基因本体(gene ontology, GO)功能富集分析和京都基因与基因组百科全书 ( Kyoto encyclopedia of genes and genomes, KEGG)通路分析,设置物种为“Home sapiens”,GO分析选择生物过程(biological process,BP)、细胞组分(cellular component,CC)和分子功能(molecullar fuction,MF),使用R studio ggplot 2软件包根据-lg P对BP、CC、MF排名前10与KEGG排名前20的条目进行GO与KEGG分析的可视化处理。
1.7 分子对接
通过PubChem(http://www.pdb.org/)平台获取三黄泻心汤活性成分的SDF格式文件,使用Chem3D Pro 14.0将SDF格式文件转换mol2格式文件,使用RSCB PDB数据库(https://www.rcsb.org/)获取核心靶点蛋白质晶体结构的 PDB 格式文件,使用SYBYL-X 2.1.1进行分子对接。
2 结果
2.1 三黄泻心汤活性成分及作用靶点
利用TCMSP数据库,以DL≥0.18,OB≥30%为条件筛选后,通过Uniprot数据库进行靶点名称规范化,剔除有效成分重复值后,共得到47个有效成分,其中黄连有效成分11个,大黄有效成分7个,黄芩效成分32个,主要有效成分见表1,全表见OSID科学数据与内容附表1。
2.2 AD靶点
使用GeneCards数据库得到AD相关基因靶点共9 599个,Relevance score取3次中位数后的数值为11.283 7,故设定Relevance score≥11.283 7的靶点为AD的潜在靶点,共筛选得到1 200个靶点。
2.3 三黄泻心汤与AD靶点的交集
通过Venny在线制图工具平台,绘制三黄泻心汤有效成分靶点与AD潜在靶点的维恩图,得到71个交集靶点,见OSID科学数据与内容附图1。
2.4 三黄泻心汤药物-有效成分-靶点-疾病网络构建结果
药物-有效成分-靶点-疾病网络图显示,图中包含122个节点,498条边。图中节点越大,则代表其连接度(degree)越高,连接度排名前6名的化合物分别为槲皮素、β-谷甾醇、汉黄芩素、黄芩新素、半枝莲种素、苏荠苎黄酮,见OSID科学数据与内容附图2。
2.5 PPI网络的建立
AD与三黄泻心汤交集靶点的PPI网络图显示,图中共有71个靶点蛋白与1 468条相互作用的边,连接度前5的核心靶点蛋白为IL-6、TNF、ATK1、PTGS2、VEGFA,见OSID科学数据与内容附图3。
2.6 GO与KEGG富集分析
使用DAVID數据库v6.8对三黄泻心汤与AD的交集靶点进行GO与KEGG通路富集分析,并根据P<0.01、FDR<0.05为条件进行筛选,共得到143条GO条目与79条KEGG条目。OSID科学数据与内容附图4显示,BP主要涉及药物反应、缺氧反应、细胞迁移的正向调节、一氧化氮生物合成过程的正调控;CC主要涉及细胞外空间、细胞外区域、小窝、薄膜筏等;MF主要涉及丝氨酸内肽酶活性、酶结合、蛋白质同二聚化活性、相同蛋白质结合等。OSID科学数据与内容附图5显示KEGG富集分析主要涉癌症通路、HIF-1信号通路、TNF信号通路等。
2.7 分子对接
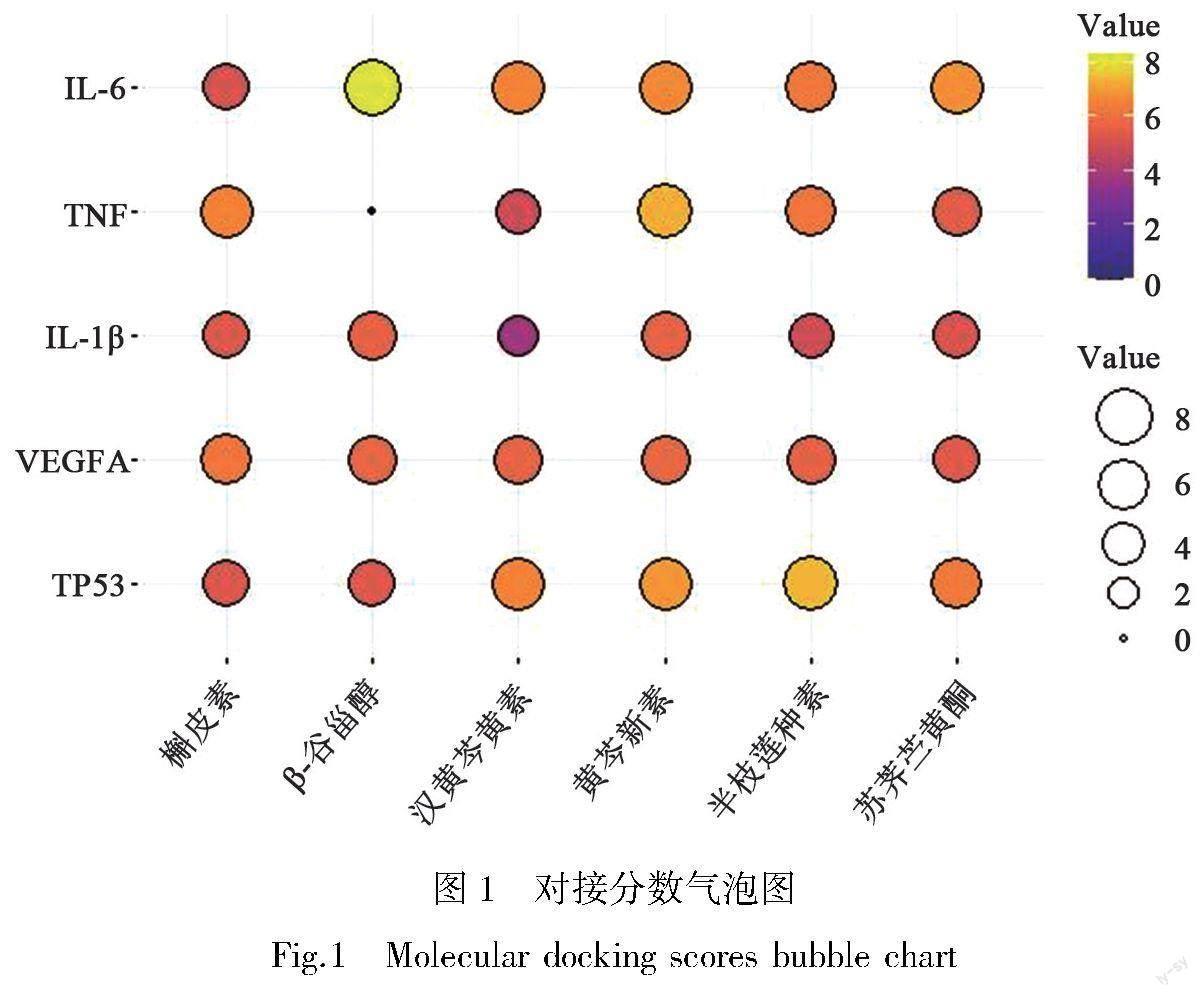
选取AD关键靶点蛋白IL-6、TNF、IL-1β、VEGFA、TP53分别与三黄泻心汤活性成分槲皮素、β-谷甾醇、汉黄芩黄素、黄芩新素、半枝莲种素、苏荠苎黄酮进行分子对接并得到对接分数,见表2,通过R studio ggpubr软件包绘制对接分数气泡图,见图1,同时得到分子对接结果示意图,部分示意图见图2,对接分数≥5代表活性成分与靶点具有较好的结合作用[15]。本次分子对接结果显示活性最强的对接组合为IL-6与β-谷甾醇、TP53与半枝莲种素、TNF与黄芩新素、TP53与黄芩新素、IL-6与苏荠苎黄酮。
3 讨论
中医认为“诸热瞀瘛,皆属于火”“其人喜忘者,必有蓄血”,因此在AD的治疗中不应忽略热毒与瘀血这两种致病因素。三黄泻心汤中黄连、黄芩具有清热解毒之效,大黄具有泻下攻积、逐瘀通经之效,三药合用,清热解毒、活血逐瘀之功甚强。现代药理学研究证明,大黄、黄连、黄芩可以通过抗氧化应激反应,抑制疾病特异性淀粉样蛋白的聚集,降低β-淀粉样蛋白与tau磷酸化水平、提高蛋白磷酸酶2A活性等方式改善AD临床症状[16]。
本研究发现,三黄泻心汤治疗AD的核心成分主要包括槲皮素、β-谷甾醇、汉黄芩黄素等。Aβ瀑布学说、胆碱能缺陷假学说、神经炎症假说等是解释AD产生的重要理论,槲皮素是一种黄酮类化合物,可以通过抑制Aβ聚集与tau磷酸化、抑制乙酰胆碱酯酶水解乙酰胆碱、减弱氧化应激反应、减轻神经炎症等方式达到保护神经元细胞从而防治AD的功效[17]。β-谷甾醇具有很强的抗胆碱酯酶作用,并具有清除自由基的功效,能够预防由自由基引起的神经退行性病变,同时β-谷甾醇可较为容易地穿过血脑屏障,对于AD的治疗具有很高的生物利用度[18]。汉黄芩素可以干预Aβ聚集并显著抑制SH-SY5Y神经母细胞瘤细胞中的胆碱酯酶活性,阻断Aβ42诱导的乙酰胆碱酯酶活化[19],减少BACE1细胞中Aβ的分泌,并且可以通过mTOR抑制作用抑制GSK3β活性,从而减少tau磷酸化达到保护、营养神经的作用[20]。
通过PPI网络发现IL-6、TNF、IL-1β、VEGFA、TP53是三黄泻心汤治疗AD的核心靶点。有越来越多的研究表明,炎症反应在AD病理过程中尤其是疾病的早期阶段有着重要的参与[21],炎性因子IL-6与认知障碍严重程度密切相关,可以加速神经退行性过程,并且与Aβ沉积、脱髓鞘、白质高信号和神经变性过程相关[22-23]。TNF是炎症的主要调节因子之一,具有协调促炎细胞因子级联反应的作用,由TNF介导的炎症可能导致Aβ斑块和tau过度磷酸化[24]。葡萄糖代谢降低是AD的特征之一,己糖激酶是葡萄糖代谢的关键酶之一,IL-1β表达的减少可以使己糖激酶表达增加,进而抑制炎症反应、增加葡萄糖代谢,促进AD的恢复[25]。VEGFA与血管生成、毛细血管血流量有关,抑制VEGF信号可以减少白细胞黏附在脑微血管内皮,改善AD患者脑微血管血流[26]。TP53活性的失调会导致神经元功能障碍进而导致神经变性[27],因此有效地干预TP53的表达可以起到改善脑损伤的作用。
GO富集分析显示三黄泻心汤治疗AD主要集中在药物反应、缺氧的反应、细胞迁移的正向调节、丝氨酸内肽酶活性、酶结合、蛋白质同二聚化活性等方面。KEGG分析说明三黄泻心汤治疗AD与多条通路相关,包括癌症通路、HIF-1信号通路、TNF信号通路等。脑缺血缺氧是AD发病的重要环境因素,HIF-1信号通路与细胞低氧应激密切相关,缺氧诱导因子也会对神经系统发育产生重要影响,AD患者会出现大量小胶质细胞围绕Aβ斑块周围大量增加的特征[28],而小胶质细胞炎症的产生,会伴随着氧化磷酸化到糖酵解的代谢重编程,这一代谢重编程则依赖于HIF通路[29],所以HIF-1信号通路与AD的病理改变可能有着紧密的联系。系统性感染是产生认知障碍的原因之一[30],TNF信号通路参与多系统的慢性炎症与变性疾病,是神经炎症的关键介质之一[31],与中枢神经系统退行性病变有着密切联系,同时在AD病理过程中,TNFR信号还参与APP(淀粉样蛋白前体蛋白)加工,影响Aβ斑块产生[32]。
我们将筛选出的三黄泻心汤的核心成分与AD的核心靶点分别进行分子对接,对接结果显示IL-6与β-谷甾醇、TP53与半枝莲种素,TNF与黄芩新素、TP53黄芩新素、IL-6与苏荠苎黄酮,有着较强的结合能力。因此我们推测三黄泻心汤可能是通过这些化合物作用于多个靶点从而达到治疗AD的效果。
综上所述,本研究利用网络药理学与分子对接的方法得出,三黄泻心汤可以通过多活性成分、多靶点、多通路抑制Aβ聚集与tau磷酸化、阻断乙酰胆碱酯酶活化、抑制炎症反应进而达到治疗AD的临床疗效。
参考文献:
[1]HONG S, BEJA-GLASSER V F, NFONOYIM B M, et al. Complement and microglia mediate early synapse loss in Alzheimer mouse models[J]. Science, 2016, 352(6286): 712-716. DOI: 10.1126/science.aad8373.
[2]LEE J H, YANG D S, GOULBOURNE C N, et al. Faulty autolysosome acidification in Alzheimer′s disease mouse models induces autophagic build-up of Aβ in neurons, yielding senile plaques[J]. Nature Neuroscience, 2022, 25(6): 688-701. DOI: 10.1038/s41593-022-01084-8.
[3]林婷婷, 詹亞熹, 付书梅, 等. 阿尔茨海默病相关药物靶点和临床治疗进展[J]. 中国科学技术大学学报, 2018, 48(10): 825-837. DOI: 10.3969/j.issn.0253-2778.2018.10.009.
[4]ATRI A. The alzheimer′s disease clinical spectrum: Diagnosis and management[J]. The Medical Clinics of North America, 2019, 103(2): 263-293. DOI: 10.1016/j.mcna.2018.10.009.
[5]JIA J P, WEI C B, CHEN S Q, et al. The cost of Alzheimer′s disease in China and re-estimation of costs worldwide[J]. Alzheimer′s & Dementia, 2018, 14(4): 483-491. DOI: 10.1016/j.jalz.2017.12.006.
[6]ATHAR T, BALUSHI K A, KHAN S A. Recent advances on drug development and emerging therapeutic agents for Alzheimer′s disease[J]. Molecular Biology Reports, 2021, 48(7): 5629-5645. DOI: 10.1007/s11033-021-06512-9.
[7]田恺, 张向宇, 牛博真, 等. 基于“毒损脑络”理论中医脑病病因病机和辨证施治的研究进展[J]. 中西医结合心脑血管病杂志, 2021, 19(8): 1308-1310. DOI: 10.12102/j.issn.1672-1349.2021.08.014.
[8]刘晓慧, 王丹丹, 于顾然. 论阿尔兹海默病“毒损脑络”病机的含义[J]. 河南中医, 2017, 37(1): 90-92. DOI: 10.16367/j.issn.1003-5028.2017.01.0030.
[9]盛环良, 常诚. 大黄改善认知功能研究进展[J]. 世界中医药, 2015, 10(6): 958-961. DOI: 10.3969/j.issn.1673-7202.2015.06.039.
[10]黄燕, 骆飞飞, 唐卉, 等. 基于Rock2信号通路探讨黄芩苷对阿尔茨海默病小鼠学习记忆功能的影响[J]. 中西医结合心脑血管病杂志, 2022, 20(20): 3709-3716. DOI: 10.12102/j.issn.1672-1349.2022.20.011.
[11]DURAIRAJAN S S K, LIU L F, LU J H, et al. Berberine ameliorates β-amyloid pathology, gliosis, and cognitive impairment in an Alzheimer′s disease transgenic mouse model[J]. Neurobiology of Aging, 2012, 33(12): 2903-2919. DOI: 10.1016/j.neurobiolaging.2012.02.016.
[12]王同丽, 丁纯洁, 孙银玲, 等. 基于网络药理学结合大鼠肾上腺嗜铬细胞瘤细胞探讨地黄抗阿尔茨海默病的作用机制[J]. 中国现代应用药学, 2023, 40(3): 295-301. DOI: 10.13748/j.cnki.issn1007-7693.2023.03.002.
[13]雷超芳, 陈志刚, 陈家旭, 等. 基于网络药理学探究黑逍遥散治疗阿尔茨海默病的分子作用机制[J]. 世界科学技术-中医药现代化, 2021, 23(12): 4406-4418.
[14]蔡嘉洛, 李曉屏, 朱贻霖, 等. 基于网络药理学和分子对接技术探讨黄精芡实汤治疗糖尿病前期的作用机制[J]. 中国中药杂志, 2022, 47(4): 1039-1050. DOI: 10.19540/j.cnki.cjcmm.20210924.401.
[15]黄彭, 曲佳琳, 段文倩, 等. 基于网络药理学及实验验证探究清热利胆汤治疗胆汁瘀积性肝损伤的作用机制[J]. 中草药, 2021, 52(15): 4577-4586. DOI: 10.7501/j.issn.0253-2670.2021.15.016.
[16]ZENG P, SHI Y, WANG X M, et al. Emodin rescued hyperhomocysteinemia-induced dementia and alzheimer′s disease-like features in rats[J]. International Journal of Neuropsychopharmacology, 2019, 22(1): 57-70. DOI: 10.1093/ijnp/pyy090.
[17]KHAN H, ULLAH H, ASCHNER M, et al. Neuroprotective effects of quercetin in alzheimer′s disease[J]. Biomolecules, 2019, 10(1): 59. DOI: 10.3390/biom10010059.
[18]AYAZ M, JUNAID M, ULLAH F, et al. Anti-alzheimer′s studies on β-sitosterol isolated from Polygonumhydropiper L[J]. Frontiers in Pharmacology, 2017, 8: 697. DOI: 10.3389/fphar.2017.00697.
[19]HAMPEL H, M MESULAM M, CUELLO A C, et al. Revisiting the cholinergic hypothesis in alzheimer′s disease: Emerging evidence from translational and clinical research[J]. The Journal of Prevention of Alzheimer′s Disease, 2019, 6(1): 2-15. DOI: 10.14283/jpad.2018.43.
[20]ZHU Y Y, WANG J. Wogonin increases β-amyloid clearance and inhibits tau phosphorylation via inhibition of mammalian target of rapamycin: Potential drug to treat Alzheimer′s disease[J]. Neurological Sciences, 2015, 36(7): 1181-1188. DOI: 10.1007/s10072-015-2070-z.
[21]HOLMES C. Review: Systemic inflammation and Alzheimer′s disease[J]. Neuropathology and Applied Neurobiology, 2013, 39(1): 51-68. DOI: 10.1111/j.1365-2990.2012.01307.x.
[22]LAI K S P, LIU C S, RAU A, et al. Peripheral inflammatory markers in Alzheimer′s disease: A systematic review and meta-analysis of 175 studies[J]. Journal of Neurology, Neurosurgery & Psychiatry, 2017, 88(10): 876-882. DOI: 10.1136/jnnp-2017-316201.
[23]BAO Y, CAO X T. The immune potential and immunopathology of cytokine-producing B cell subsets: A comprehensive review[J]. Journal of Autoimmunity, 2014, 55: 10-23. DOI: 10.1016/j.jaut.2014.04.001.
[24]BAJ T, SETH R. Role of curcumin in regulation of TNF-α mediated brain inflammatory responses[J]. Recent Patents on Inflammation & Allergy Drug Discovery, 2018, 12(1): 69-77. DOI: 10.2174/1872213X12666180703163824.
[25]HAN S X, HE Z J, JACOB C, et al. Effect of increased IL-1β on expression of HK in Alzheimer′s disease[J]. International Journal of Molecular Sciences, 2021, 22(3): 1306. DOI: 10.3390/ijms22031306.
[26]ALI M, FALKENHAIN K, NJIRU B N, et al. VEGF signalling causes stalls in brain capillaries and reduces cerebral blood flow in Alzheimer′s mice[J]. Brain, 2022, 145(4): 1449-1463. DOI: 10.1093/brain/awab387.
[27]ABATE G, FRISONI G B, BOURDON J C, et al. The pleiotropic role of p53 in functional/dysfunctional neurons: Focus on pathogenesis and diagnosis of Alzheimer′s disease[J]. Alzheimer′s Research & Therapy, 2020, 12(1): 160. DOI: 10.1186/s13195-020-00732-0.
[28]呂炜, 韩彦青, 郭小宇, 等. 犬尿氨酸通路在阿尔兹海默病中的研究进展[J]. 海南医学院学报, 2020, 26(9): 712-716. DOI: 10.13210/j.cnki.jhmu.20200212.007.
[29]BAIK S H, KANG S, LEE W, et al. A breakdown in metabolic reprogramming causes microglia dysfunction in alzheimer′s disease[J]. Cell Metabolism, 2019, 30(3): 493-507.e6. DOI: 10.1016/j.cmet.2019.06.005.
[30]ASBY D, BOCHE D, ALLAN S, et al. Systemic infection exacerbates cerebrovascular dysfunction in Alzheimer′s disease[J]. Brain, 2021, 144(6): 1869-1883. DOI: 10.1093/brain/awab094.
[31]JAYARAMAN A, HTIKE T T, JAMES R, et al. TNF-mediatedneuroinflammation is linked to neuronal necroptosis in Alzheimer′s[JP] disease hippocampus[J].Acta Neuropathologica Communications, 2021, 9(1): 1-21. DOI: 10.1186/s40478-021-01264-w.
[32]CHENG X, SHEN Y, LI R N. Targeting TNF: A therapeutic strategy for Alzheimer′s disease[J]. Drug Discovery Today, 2014, 19(11): 1822-1827. DOI: 10.1016/j.drudis.2014.06.029.

