基于铜死亡相关lncRNAs构建一种新的肺鳞癌预后特征
张嘉琪 周而乐 王莎莎 许映涵 姜宜鑫 于宁
滨州医学院附属医院病理科,滨州 256603
肺鳞癌是肺癌的主要亚型之一,以40%的比例仅次于肺腺癌,且与肺腺癌相比临床预后更差[1]。随着多基因检测成本的逐渐降低,风险评分预测模型作为一种非侵入性技术逐渐应用于临床,有助于疾病预后评估[2-3]。肺鳞癌同样需要有效的预后模型,以评估患者预后。
铜是人体不可缺少的元素,在线粒体呼吸等多种生命过程中发挥着重要作用[4]。铜稳态的失衡影响着肿瘤的生长[5]。有研究发现,在乳腺癌中,靶向内质网的铜(Ⅱ)复合物可促进巨噬细胞吞噬肿瘤细胞[6]。在胰腺癌中,铜摄取的减少可以抑制癌细胞的生长[7]。铜死亡是一种由铜线粒体靶向触发的细胞死亡方式,且高线粒体依赖性的细胞代谢形式会导致铜死亡敏感性的增加[8]。有研究证实,口服铜螯合剂具有一定的抗肿瘤作用[9]。降低或增加铜的水平可能被作为一种潜在的肿瘤疗法[4]。因此,研究铜死亡在癌症中的作用具有很大临床应用潜力。
长链非编码RNAs(long non-coding RNAs,lncRNAs)是一类转录本长度超过200 nt 的RNA 分子,虽然不编码蛋白质,但lncRNAs 在调节基因表达的多个环节中发挥着重要作用[10]。研究发现,lncRNAs 在包括膀胱癌、宫颈癌、胰腺癌等多种肿瘤中存在差异性表达[11-13]。在膀胱癌中,lncRNA RMRP 可通过调节miR-206 来促进肿瘤细胞的增殖、迁移和侵袭[11]。在胃癌中,lncRNA CASC11 呈现高表达,敲低CASC11 可抑制癌细胞增殖并促进其凋亡[14]。然而,lncRNAs在肺鳞癌中的作用仍需进一步研究。
目前,肿瘤中铜死亡的机制尚未被充分研究,铜死亡相关lncRNAs 在肺鳞癌中的作用尚无定论。本研究利用生物信息学技术获取铜死亡相关lncRNAs,并探索它们预测肺鳞癌患者预后的能力及在生物学方面的作用。
资料与方法
1.铜死亡相关lncRNA的数据处理与鉴定
从癌症基因组图谱(TCGA)数据库(https://portal.gdc.cancer.gov/)下载肺鳞癌的RNA-Seq 数据和相应的临床数据,共包含49个正常样本和502个肺鳞癌样本。根据TCGA的基因注释对RNA-Seq 数据进行预处理以区分出其中的lncRNAs。从铜死亡的相关研究中获得铜死亡相关基因的列表[15-19]。将筛选条件设置为|R|>0.4 和P<0.001,使用R 软件的limma 包对lncRNAs 和铜死亡相关基因表达谱进行了共表达分析,识别出潜在的铜死亡相关lncRNAs。
2.铜死亡相关lncRNAs标志物预后模型的构建
将肺鳞癌患者的铜死亡相关lncRNAs 数据以1∶1 随机分为训练组和测试组。对训练组进行单因素Cox 分析,基于1 000 倍交叉验证对显著表达的lncRNAs 进行Lasso Cox回归,最终基于多因素Cox 回归分析确定影响预后的最佳lncRNAs。使用最佳模型参数构建特征,然后计算风险评分,P<0.05 被认为差异有统计学意义。风险评分公式:Risk score=Exp lncRNA1×β lncRNA1+Exp lncRNA2×β lncRNA2+Exp lncRNA3×β lncRNA3+……+Exp lncRNAn×β lncRNAn。
3.风险特征的分析
根据实验组风险评分的中位数将患者分为高、低风险组,以确定风险特征的预后。本研究使用R 软件的survival包计算各组肺鳞癌患者的总生存期(overall survival,OS)和无进展生存期(progression free survival,PFS),并进行单因素和多因素Cox 分析,以评估风险预测标志的独立预后价值。使用pheatmap软件包绘制患者生存状态图和基于风险评分的lncRNAs 表达热图。使用timeROC 包计算所有样本组风险评分的1、3和5年的受试者工作特征曲线(ROC)、曲线下面积(AUC),并与其他临床数据的AUC进行对比。
4.诺莫图与C指数曲线的构建
使用survival 和rms 包构建了年龄、性别、临床分期、T分期、N 分期和风险评分的诺莫图。绘制校准曲线,以显示诺莫图预测结果与实际结果间的差异。构建C 指数曲线用于验证风险特征在预测肺鳞癌患者生存率方面的准确性。
5.功能富集分析
使用clusterProfiler 包对铜死亡相关lncRNAs 进行基因本体论(gene ontology,GO)富集分析,P<0.05 和错误发现率(false discovery rate,FDR)<0.05 为差异有统计学意义。同时,以分子签名数据库(MSigDB)中的h(h.all.v7.2.symbols.gmt)和c2 (c2.cp.kegg.v7.4.symbols.gmt)作为参考基因集,使用GSEA4.2.3 分析高低风险组样本间显著富集的标志基因集、京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路,每次分析中基因集排列运算1 000次,P<0.05和FDR<0.25为差异有统计学意义。
6.免疫相关分析
采用limma gsva包分析高、低风险组肺鳞癌患者免疫相关功能的差异,P<0.05 为差异有统计学意义。肿瘤免疫功能障碍和排斥(tumor immune dysfunction and rejection,TIDE)是一项使用TIDE评分预测患者接受免疫治疗药物疗效的新算法[20]。研究发现,TIDE 评分已被证明代表免疫药物(抗PD-1、抗CTLA-4)在黑色素瘤患者中的疗效,且TIDE 评分越高,治疗结果越好[20]。本研究从TIDE 官方网站(http://tide.dfci.harvard.edu/)下载了非小细胞肺癌(non-small cell lung cancer,NSCLC)的TIDE 的数据,对高低风险评分组进行TIDE 评分的计算并分析组间差异,使用CIBERSORT 包对高低风险评分组样本进行22 种免疫细胞浸润比例的计算并分析组间差异。
7.统计学方法
R4.2.1 软件用于进行所有的统计分析。组间差异采用Student’st检验和Wilcoxon 检验。AUC>0.6 被认为具有良好的诊断意义。Kaplan-Meier 生存分析以Log-Rank 法检验。未进行特殊说明的统计结果判定均以P<0.05为差异有统计学意义。
结果
1.铜死亡相关lncRNAs的鉴定及预后模型的构建
以|R|>0.4 和P<0.001 为筛选标准,从16 773 个lncRNAs中,筛选出与19 个铜死亡相关基因存在共表达关系的291 个铜死亡相关的lncRNAs。在训练组中,Lasso Cox 回归分析及单因素Cox 回归分析进一步筛选出10 个lncRNAs,并最终通过多因素Cox 分析确定了5 个lncRNAs 作为独立的预后风险因素。然后,根据5个lncRNAs的表达量计算每个样本的风险分数(图1)。风险评分计算公式:Risk score=(0.254 764 388 070 179×AC087521.1)+(-0.110 239 015 304 312×AC253 536.6)+(0.111 591 602 258 198×LINC02 345)+(0.053 832 164 073 007 3×AC019 080.1)+(-0.003 288 819 819 697 88×GAS5)。

图1 铜死亡相关长链非编码RNAs(lncRNAs)的鉴定。A为Lasso回归交叉验证筛选铜死亡相关lncRNAs;B为Lasso回归动态过程图;C为森林图显示训练组中影响预后的lncRNAs
2.风险预后模型的生存分析
为更好地评估风险评分的预后价值,以训练组风险评分的中位数为截断值,将患者分为高、低风险组。本研究发现,训练、测试和所有样本组中高风险组的OS 和FPS 均明显短于低风险组(图2)。风险曲线反映了肺鳞癌患者的风险评分与生存状态之间的关系,本研究发现高风险患者的病死率高于低风险患者。热图显示了lncRNAs 在高、低风险组中的表达水平,其中LINC02345 和AC087521.1 是高危的lncRNAs,而GAS5、AC019080.1 和AC253536.6 是低危的lncRNAs(图3)。

图2 不同分组中高、低风险肺鳞癌患者的Kaplan-Meier生存分析。A:训练组总生存期,B:测试组总生存期,C:所有样本组总生存期,D:所有样本组无进展生存期
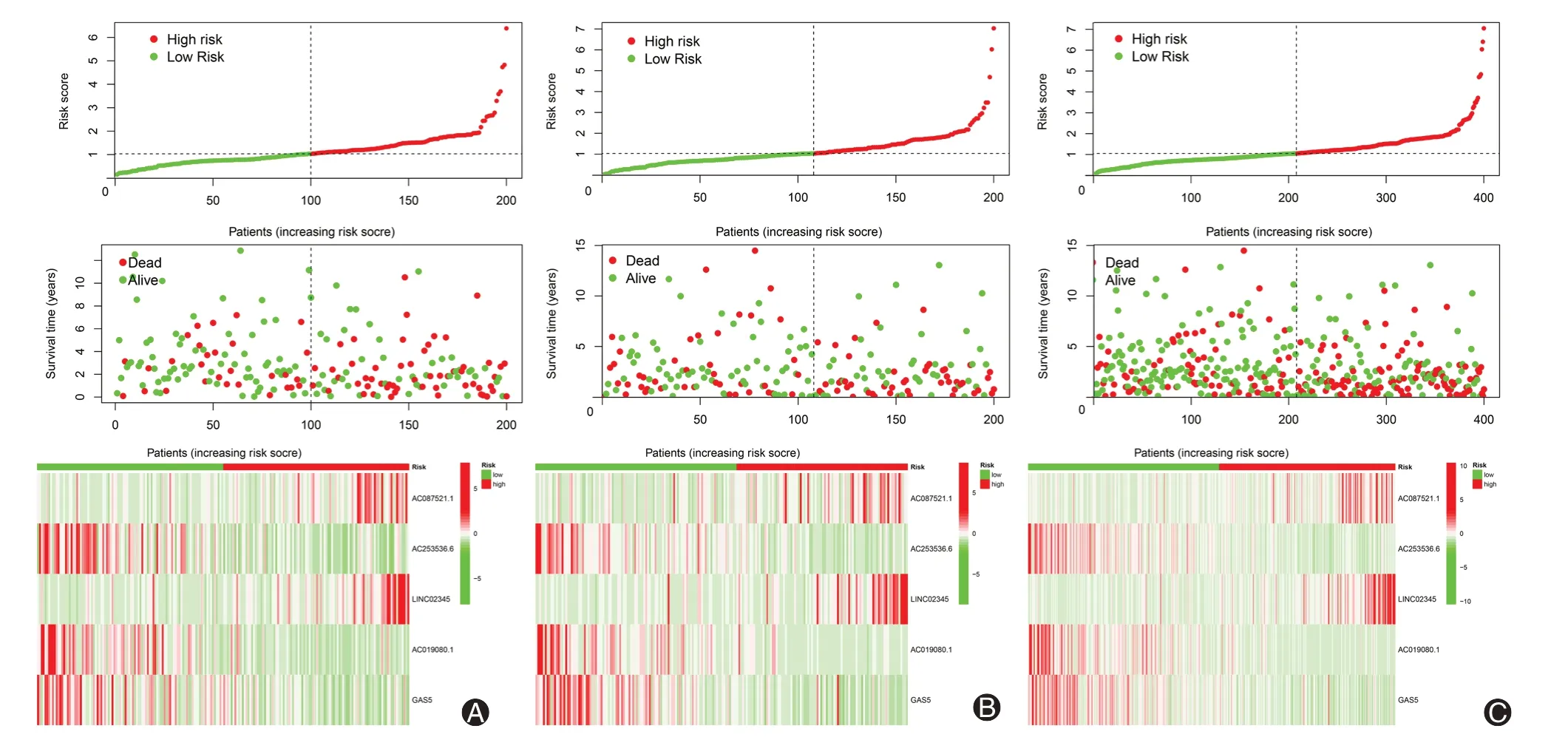
图3 不同分组中肺鳞癌患者风险评分曲线、生存状态分布及铜死亡相关长链非编码RNAs表达热图。A:训练组;B:试验组;C:所有样本组
3.影响预后因素的独立分析
进行单因素和多因素Cox 回归分析,以确定风险特征是否有可能成为独立于其他临床特征的预后因素。多因素Cox 回归分析显示,年龄[风险比(HR)=1.024,1.005~1.044;P<0.05]和风险评分(HR=1.475,1.267~1.717;P<0.05)是影响肺鳞癌患者预后的独立因素(图4A、B)。此外,我们使用ROC来评估风险评分的预测准确性。所有样品组1、3 和5 年OS 的AUC 分别为0.603、0.655 和0.620(图4C),优于年龄(AUC为0.564)和临床分期(AUC为0.563)(图4D)。
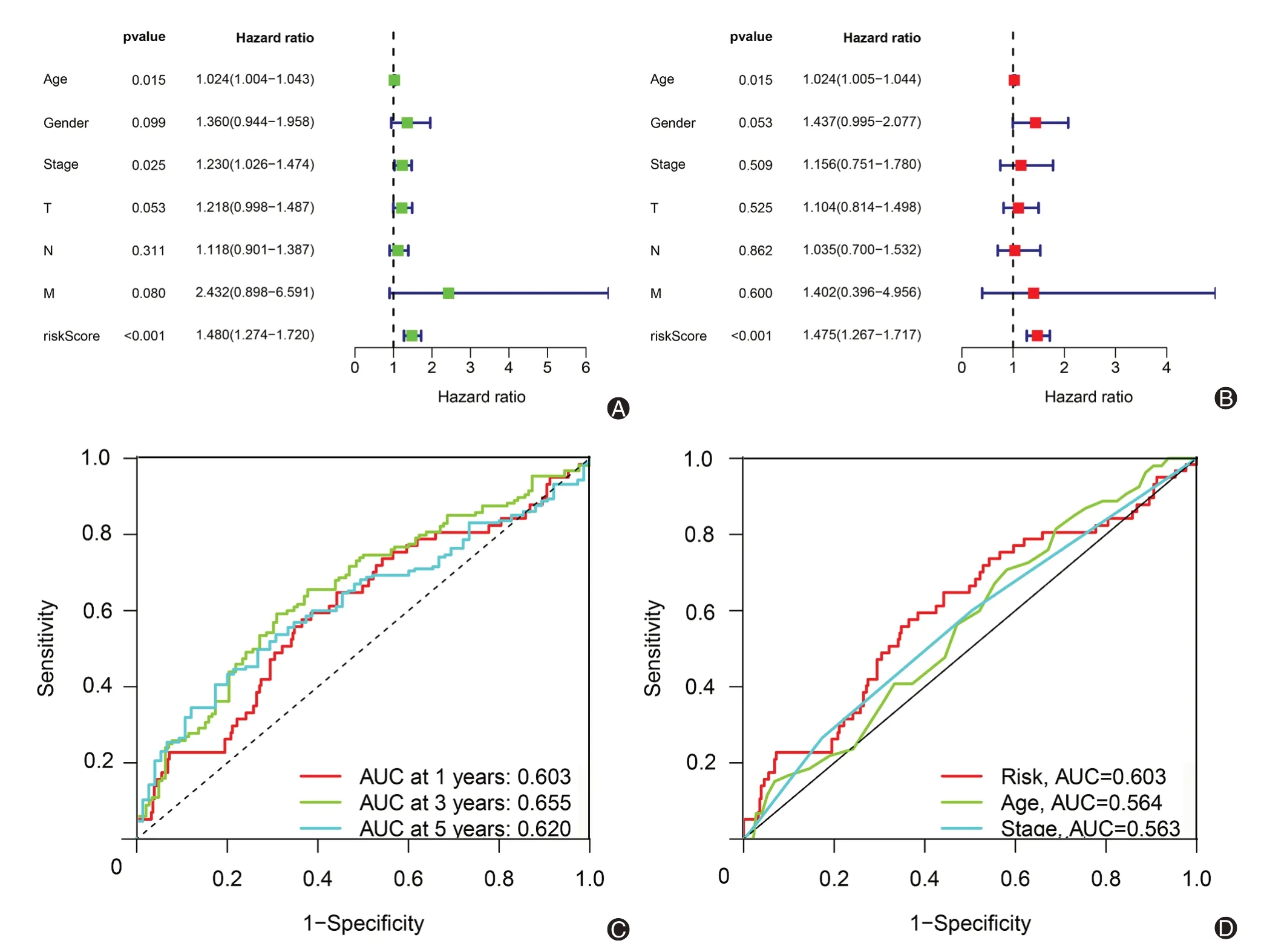
图4 预后模型风险评分的预后价值。A:单因素Cox分析;B:多因素Cox分析;C:所有样本组风险评分的1、3和5年ROC;D:风险评分和其他临床特征的ROC
4.预测诺莫图的构造
本研究使用年龄、性别、临床分期、T 分期、N 分期和风险分数等因素构建了诺莫图(样本中包含了几例M 分期未知的样本,因此将M 分期排除)。结果显示,诺莫图可有效预测LUSC 患者1、3 和5 年的OS(图5A、B)。C 指数曲线显示,风险评分的C指数值优于其他临床特征(图5C)。
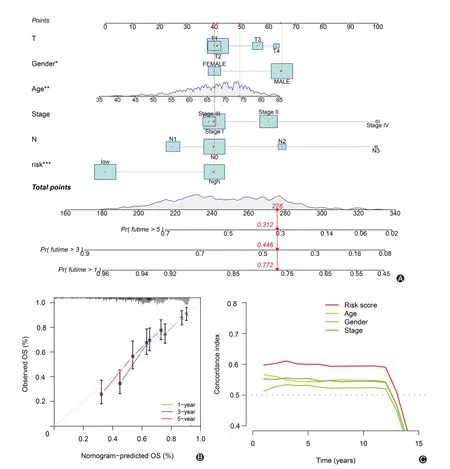
图5 预测肺鳞癌患者预后的诺莫图、C指数曲线。A:预测肺鳞癌患者总生存期的诺莫图;B:1年、3年和5年的诺莫图校准曲线;C:C指数曲线
5.功能富集分析
GO 分析结果显示,铜死亡相关lncRNAs 主要富集的生物过程包括体液免疫反应、对细菌的防御反应和免疫应答分子介体的产生等过程,主要富集的细胞组分在免疫球蛋白复合体和质膜外侧等部位中,主要富集的分子功能包括了抗原结合、受体配体活性和信号受体激活剂活性等功能(图6A)。此外,GSEA 中标志基因集的富集结果显示,主要富集的标志基因集包括炎性反应、上皮间充质转化和补体等(图6B)。KEGG 分析结果显示,高风险组样本主要富集在细胞因子相互作用及补体和凝血级联等通路(图6C)。值得注意的是,柠檬酸-三羧酸(TCA)循环是低风险组主要富集的通路(图6D)。
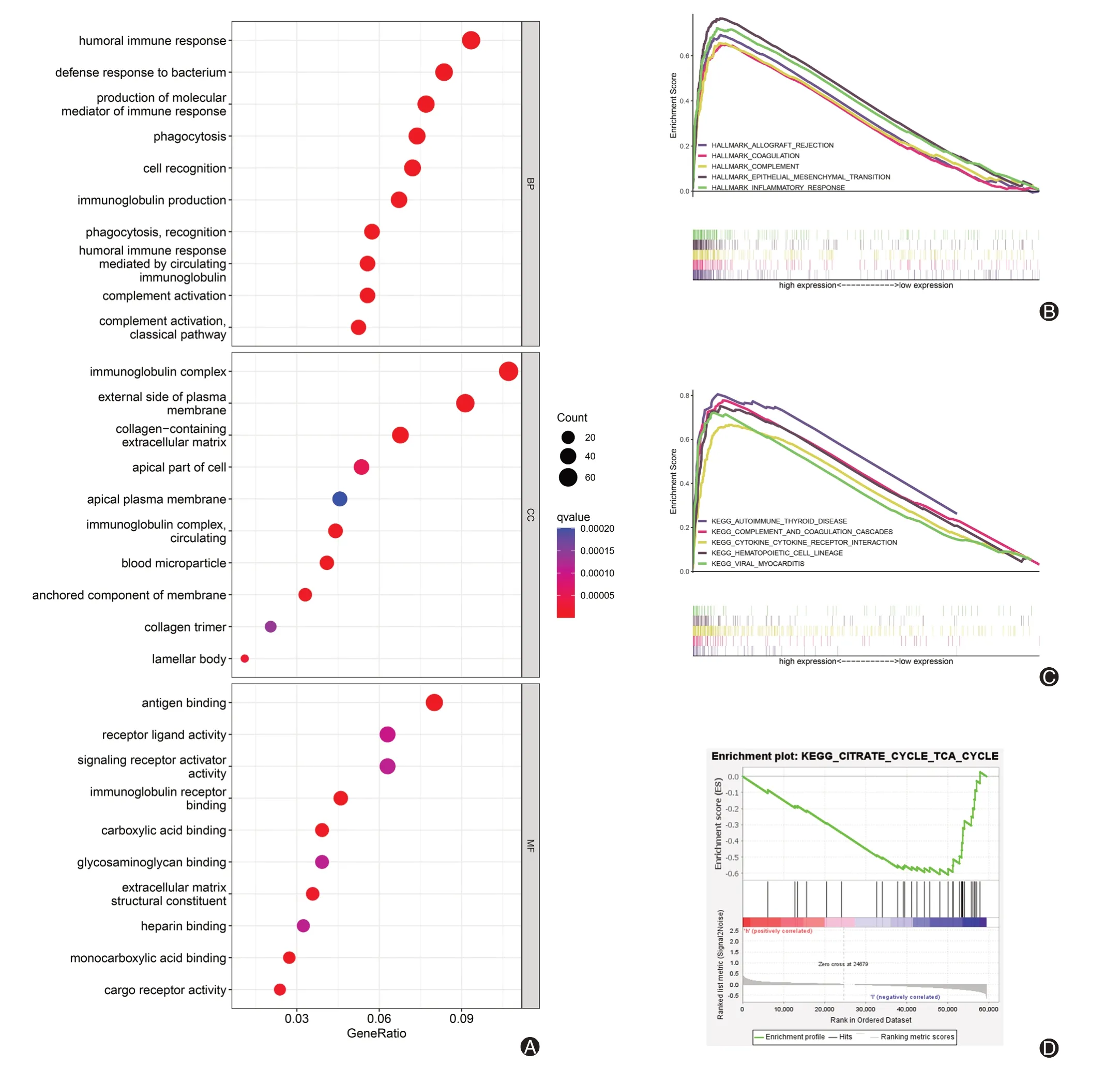
图6 功能富集分析。A:铜死亡相关lncRNAs 的GO 富集分析;B:高风险组标志基因集富集分析;C:高风险组KEGG 富集分析;D:低风险组富集于柠檬酸-TCA循环通路
6.免疫相关功能分析
免疫相关功能的分析结果表明,高风险组样本中Ⅰ型和Ⅱ型干扰素(IFN)反应、MHC-I 类途径、细胞溶解活性等多种免疫相关功能上调(图7A)。此外,免疫治疗分析显示,高风险组的TIDE 评分显著高于低风险组(图7B)。CIBERSORT 分析显示,仅浆细胞、CD8+T 细胞和中性粒细胞等6 种免疫细胞的浸润比例在高、低风险组间存在差异(图7C)。
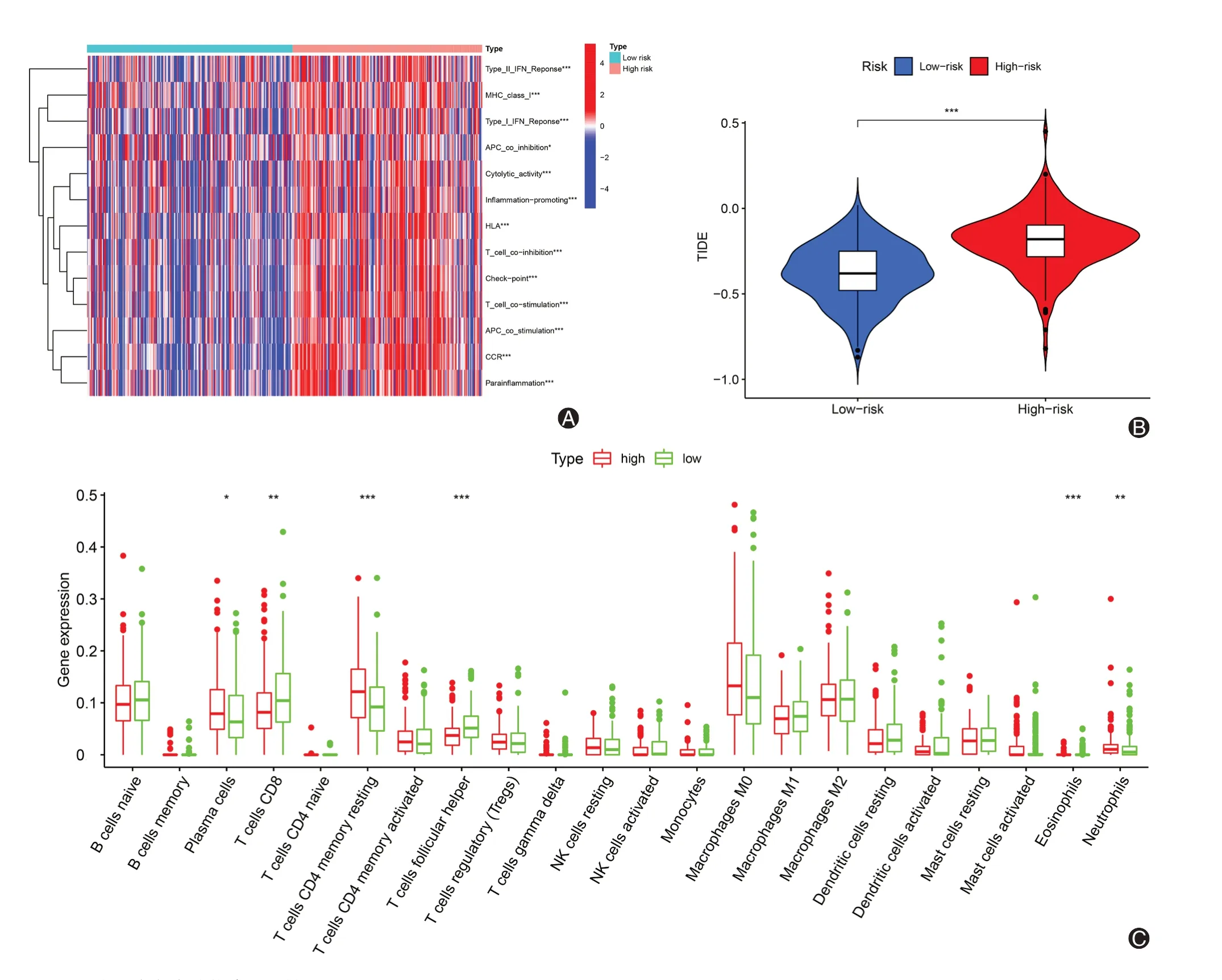
图7 高、低风险组间免疫相关分析。A:高、低风险组间免疫相关功能差异;B:高、低风险组间TIDE 评分差异;C:高、低风险组间免疫细胞浸润比例差异
讨论
肺癌是全球发病率和病死率较高的癌症之一[21]。目前,随着低剂量计算机断层扫描等筛查方式的开展,在一定程度上提高了肺癌的早期检出率,降低了肺癌病死率,但仍然存在一定的假阳性率。因此,构建可靠的肺鳞癌风险预测模型,对于准确判断肺鳞癌患者的预后具有重要意义。
LncRNAs 是一类长度>200 个核苷酸的RNA 转录物[22]。虽然这类RNAs不参与编码蛋白质,但他们在基因功能和调控的几乎每一个层面上都发挥着重要作用[23]。研究发现,lncRNAs 在肺鳞癌中发挥重要的调控作用。例如,lncRNA-ATB 在肺鳞癌中过表达并促进肺鳞癌的进展[24]。还有研究表明,lncRNA STARD13-AS 的过表达通过调节miR-1248/C3A 来限制肺鳞癌细胞的生长和侵袭性[25]。铜死亡是最近发现的一种独特的细胞死亡形式[15-19]。这种铜依赖的细胞死亡是通过铜与线粒体呼吸中三羧酸循环的酰化脂类成分直接结合而发生的,可以使酰化蛋白发生聚集,随后铁硫蛋白减少,导致蛋白毒性并最终导致细胞死亡[26]。线粒体代谢与铜介导的这种细胞死亡方式存在着一定的相关性,因此,针对具有这种代谢特征的肿瘤进行铜离子载体相关治疗,给肿瘤治疗提供了新思路[15]。伊利司莫是一种有效的铜离子载体,临床相关研究显示其在恶性GNAQ/11-突变葡萄膜黑色素瘤的治疗中发挥一定价值,但对这类药物的作用机理仍不甚了解[27]。并且铜死亡及相关lncRNAs在肺鳞癌中的共同调节作用还需要进一步研究。
本研究通过分析铜死亡相关基因和lncRNAs 的共表达关系,获得并筛选出铜死亡相关的lncRNAs。通过单因素和多因素Cox 回归分析最终得到包括AC087521.1、AC253536.6、LINC02345、AC019080.1和GAS5在内的5个预后相关lncRNAs 标志物。ROC、生存分析、Cox 分析和C-index 的结果表明,由5 个铜死亡相关lncRNAs 构成的风险预后模型可以准确有效地区分高、低风险患者并预测肺鳞癌患者的预后,这些lncRNAs 是独立于其他常见临床特征的预后因素。有研究发现,LINC02345 是透明细胞肾细胞癌的不良预后风险因素,并参与透明细胞肾细胞癌的风险预后模型的构建[28]。这5个lncRNAs中,仅LINC02345与GAS5 在之前的癌症相关研究中被提及。Filippova 等[29]发现,在乳腺癌中GAS5 可通过细胞死亡受体、线粒体信号通路等多种途径导致肿瘤细胞发生凋亡。Li 等[30]发现,GAS5通过诱导炎症小体形成,作为肿瘤抑制因子影响卵巢癌患者的预后。Ni 等[31]发现,GAS5 通过触发YAP 磷酸化和降解来抑制结直肠癌的进展。还有研究发现,GAS5在非小细胞肺癌中通过影响EMT 过程抑制癌症的侵袭和迁移[32]。其他3种lncRNAs在癌症中的作用均为首次被研究。
GO 富集分析显示,高风险组患者富集的生物过程主要集中在免疫相关过程中,细胞组分与分子功能的富集分析同样显示出类似的倾向。GSEA 分析中主要的富集基因集中有炎性反应基因集和补体基因集等,这些同样与免疫功能相关。此外,KEGG 通路的富集分析结果显示,铜死亡相关的lncRNAs 可能通过影响多种通路参与肺鳞癌的进展。TCA 循环活跃细胞拥有更高的脂酰化TCA 酶水平,进而增强了细胞对铜离子载体的敏感性[15]。鉴于柠檬酸-TCA 循环通路富集于低风险组,本研究分析铜死亡过程可能在高风险组中被抑制,并进而影响了肺鳞癌患者的预后。
在免疫相关功能分析中,本研究发现高风险组患者存在包括Ⅰ型和Ⅱ型IFN 反应、MHC-I 类途径、细胞溶解活性在内的多种免疫相关功能的上调。Ⅰ型和Ⅱ型IFN 参与了大量调节癌症免疫反应的机制,对肿瘤的免疫编辑至关重要[33]。先天免疫细胞在肿瘤免疫治疗中起着重要作用,例如NK 细胞可以通过较强的细胞溶解活性控制肿瘤的生长和转移扩散[34]。MHC-I 类途径可以将内源性多肽呈递给T淋巴细胞,进而启动适应性免疫[35]。多种功能分析显示,铜死亡相关lncRNAs 的表达可能在一定程度上上调肺鳞癌患者的多种免疫相关功能。不过,免疫系统对肿瘤的进展存在双重作用[36]。TIDE 评分的结果显示,高风险组患者可能具有更高的免疫逃逸潜能。较高的免疫逃逸潜能可能是高风险组患者免疫细胞浸润比例没有显著增加并且预后较差的原因之一。同时,较高的TIDE 评分还提示高风险组患者在接受免疫治疗时的疗效可能更差。在未来,我们将进一步研究铜死亡相关lncRNAs 在肿瘤免疫相关功能及免疫治疗等方面的作用。
鉴于本研究结果主要是基于公共数据库的分析,缺乏临床指标及实验信息,因此存在着一定的局限性。未来,我们将持续关注铜死亡相关研究的进展,并争取改进目前研究的一些限制。
本研究构建了有效的肺鳞癌铜死亡相关lncRNAs 风险预后模型,并且基于风险评分研究了不同肺鳞癌患者群体与免疫相关功能及免疫逃逸潜能的关系。本研究为预测肺鳞癌患者的生存率以及研究铜死亡相关lncRNAs 在肺鳞癌中的作用提供了新的见解。
作者贡献声明张嘉琪:酝酿和设计试验,实施研究,采集数据,分析/解释数据,起草文章,统计分析;周而乐:实施研究,采集数据;王莎莎、许映涵、姜宜鑫:实施研究;于宁:酝酿和设计试验,对文章的知识性内容作批评性审阅,获取研究经费,行政、技术或材料支持,指导

