miR-21-5p靶向JAK/STAT信号通路抑制Th1细胞极化
李 露,李 雪,孟广雨,刘元林,王 洋,吴楚姗,许婷婷,白海涛,袁福临,郑荣秀,张 毅
(1.天津医科大学总医院儿科,天津 300052;2.军事科学院军事医学研究院辐射医学研究所,北京 100850)
精确而严格的免疫调控是机体抵御病毒、细菌、真菌和寄生虫等病原体感染的重要保障。免疫细胞及其产生的多种细胞因子是免疫调控的主要执行者,在维持机体免疫系统稳态过程中发挥关键作用。T 淋巴细胞是免疫系统的重要组成部分,据其表面标志物主要分为CD4+和CD8+T 淋巴细胞,其中CD4+T 淋巴细胞又称为辅助性T 细胞(helper T cells,Th),可产生丰富的细胞因子。初始(naïve)CD4+T 细胞又称Th0 细胞,是适应性免疫反应的关键细胞。据所处的微环境,包括细胞因子信号、共刺激信号、炎症环境及T细胞受体与抗原相互作用的强度,Th0 细胞可进一步分化为多种效应亚群,包括Th1 细胞、Th2 细胞、Th17 细胞、滤泡Th细胞和诱导调节性T细胞等[1-2]。
Janus 激酶(Janus kinase,JAK)/信号转导与转录激活因子(signal transducer and activator of transcription,STAT)通路是调控Th0 细胞分化的关键信号通路,多种Th细胞亚群和免疫反应类型均受其调控,其中Th1 细胞是行使免疫监视、保障机体免疫环境稳态的主要参与者,Th1 细胞极化亦受JAK/STAT 信号通路影响。现有研究表明,树突状细胞等抗原递呈细胞摄取抗原并分泌产生的白细胞介素12(interleukin-12,IL-12)可激活STAT4 介导的JAK/STAT 信号通路,活化的STAT4 促进Th1细胞极化关键转录因子T 盒21 转录因子(T-box 21 transcription factor,T-bet)表达,进而诱导Th1 细胞极化的关键细胞因子干扰素γ(interferon-γ,IFN-γ)产生。与此同时,由自然杀伤细胞或极化的Th1 细胞分泌的IFN-γ,通过其受体介导JAK/STAT 信号通路活化,活化STAT1并诱导T-bet表达,进一步正反馈促进Th1细胞极化[3-4]。据此,在Th1细胞极化调控过程中,IL-12等Th1细胞极化相关细胞因子可激活JAK/STAT 信号通路,诱发一系列级联反应促进IFN-γ 大量产生,最终决定Th1 细胞极化的命运并促进炎症反应进展。
机体的免疫系统稳态需要促炎因子与抑炎因子协同调节,异常活化的Th1 细胞可靶向自身抗原肽,诱发机体免疫系统功能紊乱,导致诸如类风湿性关节炎、胰岛素依赖型糖尿病、系统性红斑狼疮、多发性硬化症和桥本甲状腺炎等[5-6]。因此,维持免疫系统稳态及适度的Th1 细胞极化对防治自身免疫性疾病具有重要临床意义。
物种间高度保守的微RNA(microRNA,miRNA)可通过特异性结合靶标mRNA 的3′-非翻译区(untranslated regions,UTR),诱导mRNA 降解并抑制mRNA 进一步翻译为蛋白质,在翻译水平抑制靶基因表达[7]。miRNA 是长度为19~25 个核苷酸的单链非编码RNA,其序列长度使其靶向调控具有多样性,可通过多靶标mRNA 调控形成复杂的调控网络,影响细胞生长、增殖、分化、凋亡和应激等重要生理进程[8-9]。本研究室基于前期对间充质干细胞外泌体miRNA测序分析发现,其外泌体内富含高丰度的miR-21-5p。为探究miR-21-5p 是否参与间充质干细胞免疫调控,本研究通过体外诱导初始CD4+T 细胞向Th1 细胞极化,研究miR-21-5p 对Th1细胞极化的抑制作用及其分子机制。
1 材料与方法
1.1 动物、细胞、主要试剂和仪器
6 周龄SPF 级雄性C57BL/6N 小鼠(北京维通利华实验动物技术有限公司),动物合格证号:SCXK(京)2021-0006,所涉及动物实验经军事科学院军事医学研究院实验动物伦理委员会批准,编号IACUC-DWZX-2021-704。人宫颈癌细胞(HeLa细胞),军事科学院军事医学研究院辐射医学研究所细胞库。DMEM 培养基、RPMI 1640 培养基、α-MEM 培养基、胰酶、PBS 和非必需氨基酸,美国Gibco公司;胎牛血清,德国PAN Seratech 公司;小鼠脾淋巴细胞分离试剂盒,天津灏洋生物科技有限公司;小鼠初始CD4+T 细胞分选试剂盒,德国Miltenyi Biotec 公司;抗小鼠CD3ε,CD28 和IL-4 单克隆抗体、重组小鼠IL-2 和IL-12 及PE-抗小鼠CD4和APC-抗小鼠IFN-γ流式用抗体,美国Tonbo Biosciences 公司;Triton X-100、Tween-20、Trizol 试剂和β 巯基乙醇,美国Sigma 公司;甲醛水溶液,国药集团有限公司;小鼠抗小鼠磷酸化STAT4(phosphorylated STAT4,p-STAT4)单克隆抗体,美国Santa Cruz Biotechnology公司;兔抗小鼠STAT4,STAT1 和p-STAT1 单克隆抗体,美国Cell Signaling Technology 公司;小鼠抗小鼠GAPDH 单克隆抗体、HRP-山羊抗小鼠IgG 抗体(二抗)、HRP-山羊抗兔IgG 抗体(二抗)、5×SDS-PAGE 上样缓冲液、Ultra SYBR 混合物和BCA 蛋白定量试剂盒,康为世纪有限公司;ECL 发光液,百赛生物有限公司;Oligo dT、dNTP、Random、DTT、RNA酶抑制剂、5×RNA 酶M-MLV 缓冲液和RNA 酶M-MLV 逆转录酶,日本TaKaRa 公司;JetPRIME 和JetPRIME 缓冲液,法国Polyplus 公司;双荧光素酶报告检测试剂盒,美国Promega 公司;DEPC 水、miR-21-5p 模拟物(mimic)和模拟物对照核酸序列(表1)及实时定量PCR(real-time quantitative PCR,RT-qPCR)引物(表2),上海生工生物有限公司。CKX53SF-R 型倒置显微镜,日本Olympus 公司;7500 实时荧光定量PCR仪和低温高速离心机,美国Thermo Fisher公司;Tecan Spark多功能酶标仪,瑞士帝肯公司。

Tab.1 Sequences of microRNA(miRNA)

Tab.2 Primer sequences for real-time quantitative PCR(RT-qPCR)
1.2 小鼠脾单个核细胞提取
安乐法处死6 周龄C57BL/6N 小鼠,无菌条件下取脾制备单细胞悬液,450×g离心10 min,弃上清,用小鼠淋巴细胞稀释液重悬后加入淋巴细胞分离液,450×g离心30 min,收集中间层细胞获得脾单个核细胞。
1.3 小鼠初始CD4+T细胞免疫磁珠分选
按小鼠初始CD4+T 细胞分选试剂盒操作。在分离的小鼠脾单个核细胞中加入生物素标记的Miltenyi 鸡尾酒抗体,于4 ℃孵育5 min,加入抗生物素单克隆抗体耦联磁珠和抗CD44单克隆抗体耦联磁珠继续孵育10 min,转移至离心管中用磁珠分离缓冲液洗涤1 次。将细胞通过磁场,经磁性分离柱吸附后洗脱获得初始CD4+T细胞。
1.4 诱导初始CD4+ T 细胞向Th1 细胞极化及miR-21-5p模拟物转染
24 孔板预先以抗小鼠CD3ε 单抗(2 mg·L-1)4 ℃包被过夜,将新鲜分离的初始CD4+T 细胞(每孔5×105细胞)接种入24 孔板,加入Th1 极化诱导剂(抗小鼠CD28 单抗0.5 mg·L-1、抗小鼠IL-4 单抗1 mg·L-1、重组小鼠IL-2 5 μg·L-1、重组小鼠IL-12 10 μg·L-1、1%非必需氨基酸和β巯基乙醇55 μmol·L-1),用含10%胎牛血清的RPMI 1640 培养基于37 ℃,5% CO2条件下培养。
miR-21-5p模拟物或模拟物对照2.5 nmol分别溶解于DEPC水125 μL,配制终浓度为20 μmol·L-1溶液。分别取3.33 μL 溶解于100 μL JetPRIME 缓冲液中,加入JetPRIME 2.6 μL于室温静置15 min,待组装成脂质体复合物后转染至加入Th1 极化诱导剂的初始CD4+T 细胞。诱导72 h 后分别收取Th1诱导组、诱导+模拟物对照组和诱导+miR-21-5p模拟物组细胞,进行后续实验。
1.5 流式细胞术检测Th1细胞极化百分比
取1.4 收取的细胞,加入PE-抗小鼠CD4 流式抗体,4 ℃避光孵育30 min;PBS 洗涤后加入4%中性甲醛固定10 min,用500 μL含0.1% Triton X-100的PBS 破膜7 min;用500 μL含0.1% Tween-20的PBS洗涤后,加入APC-抗小鼠IFN-γ流式抗体4 ℃避光孵育30 min。洗涤后用PBS重悬,于流式细胞仪检测CD4+IFN-γ+细胞百分比,即Th1细胞极化百分比。
1.6 RT-qPCR检测IFN-γ,STAT1,STAT4,IL-12Rβ1和T-bet mRNA表达水平
取1.4收取的细胞,Trizol法提取总RNA,取1 μg逆转录为cDNA,RT-qPCR 检测IFN-γ,STAT1,STAT4,IL-12Rβ1和T-betmRNA水平。反应体系:cDNA 1 μL,PCR上下游引物(10 μmol·L-1)各0.5 μL,Ultra SYBR 混合物10 μL 和DEPC水8 μL;反应条件:95 ℃10 min;95 ℃15 s,60 ℃1 min,40 个循环;95 ℃15 s,60 ℃1 min,95 ℃15 s。GAPDH作为内参基因,待测基因mRNA 表达水平用2-△△Ct表示。
1.7 Western 印迹法检测STAT4,p-STAT4,STAT1和p-STAT1蛋白表达水平
取1.4 收取的细胞,加80 μL细胞裂解液于摇床冰浴震荡裂解细胞30 min,12 000×g离心25 min收集上清。经BCA 蛋白定量后,加入含有β 巯基乙醇的5×SDS-PAGE 上样缓冲液煮沸。取20 μg 蛋白样品电泳,经10% SDS-PAGE 凝胶电泳,转移至PVDF 膜;5%脱脂奶粉室温封闭1 h,分别与抗STAT4,p-STAT4,STAT1,p-STAT1 和GAPDH 抗体(稀释比1∶500)4 ℃孵育过夜;TBST洗膜3次,加入HRP-山羊抗小鼠IgG或HRP-山羊抗兔IgG抗体(稀释比1∶30 000),室温孵育1 h;TBST 洗膜3 次,ECL 化学发光显影,测定蛋白条带积分吸光度值。待测蛋白表达水平用待测蛋白条带与GAPDH 条带积分吸光度比值表示。
1.8 双荧光素酶报告载体构建及miR-21-5p 模拟物对STAT1,IFN-γ和IL-12Rβ1表达调控作用验证
经生物信息学分析预测IL-12Rβ1,IFN-γ和STAT1的3′-UTR 可能存在miR-21-5p的作用靶标序列,利用psiCHECK2 分别构建各靶标序列的双荧光素酶报告载体,即将正常3′-UTR 序列(wild type,WT)和靶序列结合位点突变(mutant,MT)的3′-UTR 序列分别插入到psiCHECK2 载体携带的人源化海肾荧光素酶(human codon optimized-Renilla luciferase,hRluc)的3′-UTR 区域,构建hRluc的报告基因表达载体psi-WT 和psi-MT。psiCHECK2含有hluc+作为内参报告基因。
转染前1 d 将HeLa 细胞(每孔2×104细胞)接种于96 孔板,待细胞密度汇合至60%~80%时,将psi-WT 和psi-MT 载体分别与miR-21-5p 模拟物或模拟物对照共转染至HeLa 细胞中。取20 ng 载体和0.2 μL miR-21-5p 模拟物或模拟物对照溶解于15 μL JetPRIME 缓冲液中,加入JetPRIME 0.5 μL混匀后于室温静置15 min,待形成脂质体复合物后加入HeLa 细胞培养体系。用含10%胎牛血清的DMEM 培养基在37 ℃,5% CO2条件下培养36 h,收取并裂解细胞进行双荧光素酶报告基因检测。取细胞裂解上清20 μL,加入Luciferase Assay底物20 μL,经Tecan 酶标仪检测内参hluc+产生的荧光信号强度;再加入Stop&Glo 底物20 μL,用Tecan酶标仪检测靶标序列的hRluc产生的荧光信号强度。hRluc与hluc+荧光信号强度比值表示荧光素酶活性,反映miR-21-5p 模拟物或模拟物对照对靶序列的调控作用。
1.9 统计学分析
实验结果数据以±s表示,经SPSS Statistics 26 软件进行数据分析,组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 miR-21-5p抑制Th1细胞极化
对小鼠脾单个核细胞进行免疫磁珠阴性分选(图1A),获得的细胞经流式细胞术检测为高表达CD62L 的CD4+T 细胞(图1B),符合初始CD4+T细胞特征。向初始CD4+T 细胞中加入Th1 极化诱导剂,同时转染miR-21-5p 模拟物或模拟物对照,72 h 后流式细胞术检测CD4+IFN-γ+双阳细胞百分比。结果(图1C)表明,Th1诱导组细胞极化百分比为(76.3±0.6)%;诱导+模拟物对照组为(76.9±2.1)%,与Th1 诱导组比较无明显变化;诱导+miR-21-5p 模拟物组为(68.1±2.2)%,与Th1 诱导组和诱导+模拟物对照组比较均明显降低(P<0.01)。以上结果表明,在诱导初始CD4+T 细胞向Th1 细胞极化体系内转染miR-21-5p模拟物可显著抑制Th1细胞极化。
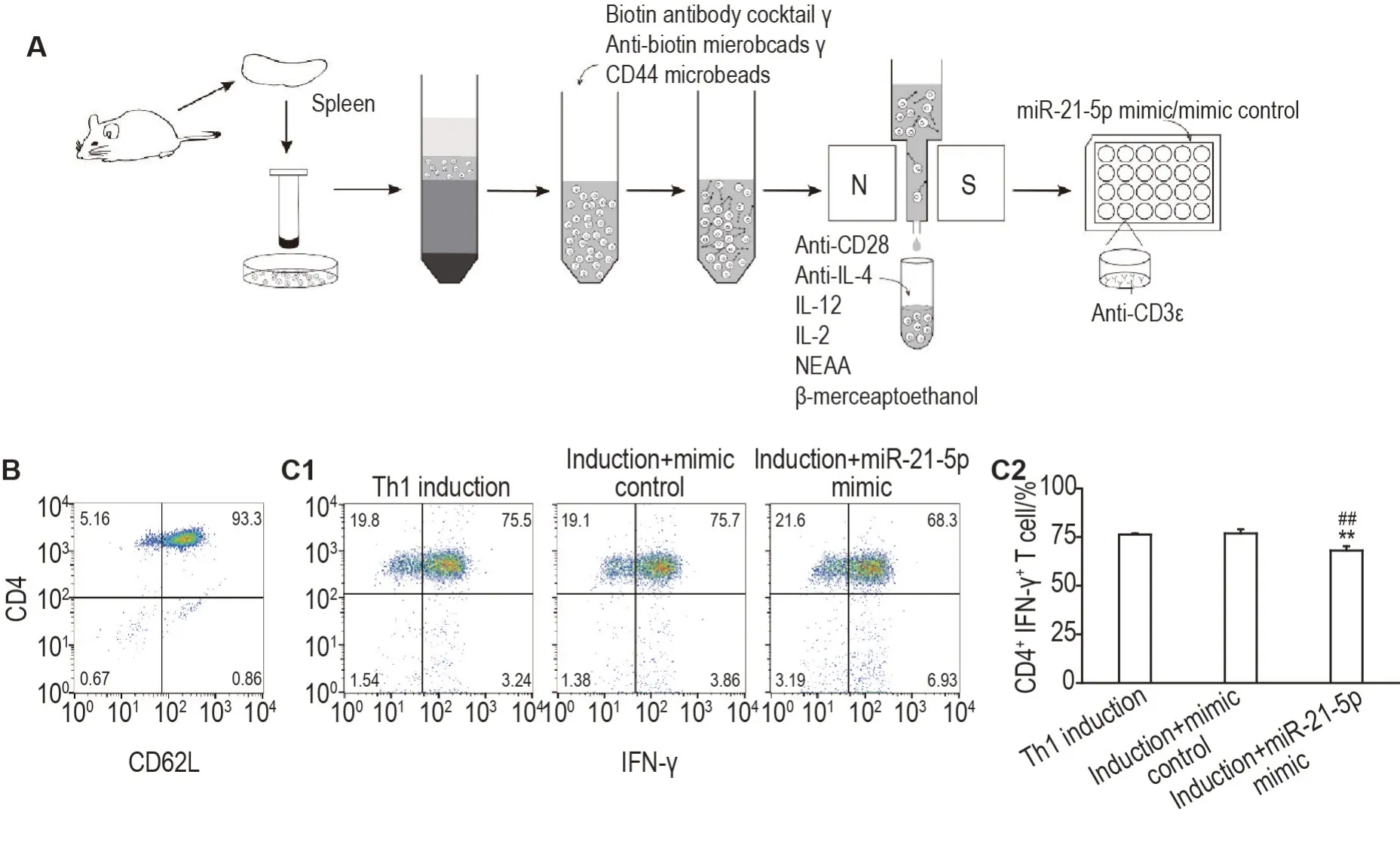
Fig.1 miR-21-5p mimic blocked Th1 cell polarization. A:strategy of murine naïve CD4+ T cells isolation;B:characterization of the purified naïve CD4+ T cells examined by flow cytometry;C:the percentage of CD4+IFN-γ+ cells in Th1 cells induced from the naïve CD4+ T cells and transfected miR-21-5p mimic or mimic control for 72 h measured by flow cytometry;C2:statistic results of C1.±s,n=3.**P<0.01,compared with Th1 induction group;##P<0.01,compared with induction+mimic control group.
2.2 miR-21-5p抑制JAK/STAT信号通路活化
图2A 结果显示,转染miR-21-5p 模拟物后,Th1 细胞极化所需的关键转录因子T-bet和关键细胞因子IFN-γmRNA 表达水平较转染模拟物对照显著下降(P<0.01);同时,参与调控Th1 细胞极化的IL-12/STAT4/IFN-γ 途径和IFN-γ/STAT1 途径的关键转录因子STAT1(P<0.01)和STAT4(P<0.05)及受体IL-12Rβ1(P<0.05)mRNA 表达水平亦显著降低。诱导+模拟物对照组上述细胞因子mRNA水平与Th1诱导组比较均无明显变化。
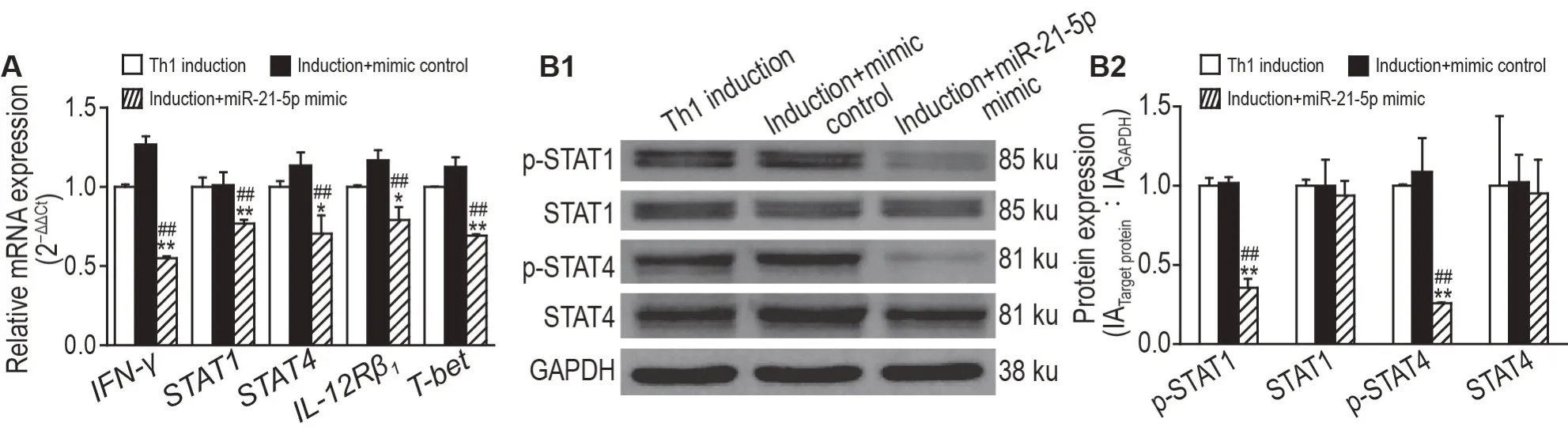
Fig.2 miR-21-5p inhibited activation of JAK/STAT signaling pathway in Th1 cells. See Fig.1C for the cell treatment. A:the mRNA expression levels of IFN-γ,STAT1,STAT4,IL-12Rβ1 and T-bet measured by RT-qPCR;B:the protein levels of STAT4,p-STAT4,STAT1 and p-STAT1 detected by Western blotting,B2 was the semi-quantitative result of B1. IA:integrated absorbance.±s,n=3.*P<0.05,**P<0.01,compared with Th1 induction group;##P<0.01,compared with induction+mimic control group.
图2B 结果显示,转染miR-21-5p 模拟物后,p-STAT1 和p-STAT4 蛋白表达水平显著低于诱导+模拟物对照组(P<0.01),STAT1和STAT4蛋白表达水平无明显变化,表明miR-21-5p 模拟物可抑制STAT1和STAT4蛋白磷酸化活化。
2.3 miR-21-5p调控Th1细胞极化通路的作用靶标
经生物信息学分析与预测,miR-21-5p 可能与Th1细胞极化所必需的JAK/STAT 信号通路的重要分子IFN-γ,IL-12Rβ1和STAT1的3′-UTR 存在特异性结合位点。利用psiCHECK2 双荧光素酶报告载体,分别构建含IFN-γ,IL-12Rβ1和STAT1的3′-UTR WT序列(图3A)及对应靶标的MT序列(图3B)的克隆载体psi-WT 和psi-MT,并与miR-21-5p模拟物或模拟物对照同时转染HeLa 细胞。双荧光素酶活性检测结果(图3C)显示,转染miR-21-5p模拟物可显著降低带有IFN-γ(P<0.01),IL-12Rβ1(P<0.01)和STAT1(P<0.05)WT 序列的报告基因荧光素酶活性,而含靶基因MT 序列的各报告基因荧光素酶活性不受影响;此外,转染模拟物对照不影响含WT 和MT 序列的报告基因荧光素酶活性。由此表明,miR-21-5p模拟物可特异性靶向结合IFN-γ,IL-12Rβ1和STAT1的3′-UTR 序列,调控STAT1,IL-12Rβ1和IFN-γ表达水平。
3 讨论
Th 细胞在机体应对感染的适应性免疫反应中发挥关键作用,它不仅能辅助B 细胞产生抗体、增强和维持CD8+T 细胞的杀伤作用、调节多种免疫细胞以对抗致病微生物,还能调控免疫反应的强度和持续时间。多种Th 细胞亚群参与机体的多重免疫调控反应。Th1 细胞主要介导细胞免疫反应,机体被感染时其细胞特征性细胞因子IFN-γ可激活或刺激其他免疫细胞(如CD8+T 细胞、M1 巨噬细胞、1 型固有淋巴细胞、1 型不变自然杀伤T 细胞(invariant natural killer T1 cells)和免疫球蛋白G3 B 细胞等)共同清除细胞内微生物。Th2细胞介导对抗体外寄生虫感染,同时也会导致过敏反应。Th17细胞主要抵抗真菌和细胞外细菌入侵。滤泡辅助性T细胞协助B细胞增强体液免疫。诱导调节性T细胞可调节免疫稳态和维持自身免疫耐受[10-11]。
JAK/STAT 通路是免疫系统活化的关键信号通路,多种细胞因子与受体结合可激活JAK 反式磷酸化,随后募集并催化STAT 磷酸化,磷酸化的STAT形成二聚体入核启动靶基因转录,从而诱发不同细胞因子表达,决定Th0细胞的极化方向[12-13]。IL-12和IFN-γ可分别激活JAK2/酪氨酸激酶2/STAT4和JAK1(JAK2)/STAT1 通路,进而诱导Th1 细胞极化的关键转录因子T-bet 表达,是决定Th1 细胞命运的关键细胞因子[14]。
尽管Th 细胞的分化主要依赖于关键转录因子和细胞因子的调控,但越来越多的研究表明,miRNA作为小分子化合物也可以调控Th 细胞分化,影响Th 细胞亚群平衡[15]。据报道,间充质干细胞外泌体来源的miR-148a-3p 通过抑制IL-12/IL-12Rβ1/IL-12Rβ2/IFN-γ 通路下调Th1 细胞极化,阻止1 型糖尿病进展[16-17]。miR-210 通过与STAT6 靶向结合抑制Th2 分化,从而促进银屑病患者中Th17 和Th1 分化[18]。miR-140-5p 可靶向负调控STAT1 表达从而抑制Th1 细胞分化,影响多发性硬化症的进展[19]。最新研究显示,miR-21-5p不仅可调节成骨、破骨细胞的生成和平衡[7,20],还具有调节多种细胞抗凋亡、增殖和迁移能力[21-22],也是潜在的癌症预测标志物[23-24]。但关于miR-21-5p 调节Th 细胞分化的分子机制知之甚少。本研究通过体外诱导初始CD4+T 细胞向Th1 细胞极化,发现在诱导初始CD4+T 细胞向Th1 细胞极化的体系内转染miR-21-5p 模拟物,可显著降低Th1 细胞极化百分比,表明miR-21-5p 可抑制Th1 细胞极化。进一步研究发现,miR-21-5p 可下调Th1 细胞极化关键转录因子STAT1,T-bet和STAT4、细胞因子IFN-γ及受体IL-12Rβ1mRNA表达水平,同时下调p-STAT1和p-STAT4 蛋白水平,表明miR-21-5p 可显著抑制STAT4 和STAT1 磷酸化活化,进而干扰IL-12/STAT4/IFN-γ通路和IFN-γ/STAT1通路活化,从而抑制Th1细胞极化。
为进一步探究miR-21-5p抑制Th1细胞极化的分子靶标,本研究对Th1 细胞极化必需的JAK/STAT 通路各组分进行生物信息学分析,发现miR-21-5p 与JAK/STAT 信号通路的关键分子STAT1,IFN-γ和IL-12Rβ1的3′-UTR 具有特异性结合位点。随后经双荧光素酶报告体系证实,miR-21-5p 可通过靶向结合而调控STAT1,IFN-γ和IL-12Rβ1表达,干扰Th1 细胞极化所必需的JAK/STAT信号通路激活,进而抑制Th1细胞极化。
综上,miR-21-5p 可通过靶向下调JAK/STAT信号通路分子IFN-γ,IL-12Rβ1和STAT1的表达水平及干扰Th1细胞极化的特征性细胞因子IFN-γ和关键转录因子T-bet表达,从而显著抑制Th1 细胞极化。Th1 细胞极化调控是复杂的网络化调控过程,多条信号通路和多种细胞因子共同参与。miR-21-5p 作为小分子化合物,在免疫稳态维持过程中可能是重要的调控因子,可有效抑制Th1 细胞过度极化所致的免疫稳态失衡,对治疗Th1 细胞异常活化导致的多种自身免疫性疾病,如急性移植物抗宿主病、1 型糖尿病和系统性红斑狼疮等可能发挥重要作用,但其疗效尚需体内实验进一步验证。

