神经递质γ-氨基丁酸对小鼠B淋巴细胞分化和抗体生成的影响
宋广平,吴 敏,梁丽云,李慧艳,张学敏,李 平,张宇程
(1.国家生物医学分析中心,北京 100850;2.中国人民解放军总医院第一医学中心肾脏病医学部,北京 100853)
高亲和力中和抗体可有效抵抗机体感染病原微生物,也是绝大多数疫苗发挥作用的基础[1-3]。生发中心是机体遇到抗原刺激发生免疫反应时,在外周淋巴器官(如脾)或淋巴结中短暂存在的特定结构,是B淋巴细胞克隆增殖和亲和力成熟的场所,在此最终筛选出能产生高亲和力抗体的浆细胞[4-6]。目前,对生发中心调控的研究主要集中在B细胞与滤泡辅助性T 细胞(follicular helper T cells,Tfh)和滤泡树突状细胞互作方面,着重阐述Tfh 和滤泡树突状细胞如何通过分泌细胞因子及细胞表面的配体受体如何结合而调控B细胞成熟、生发中心形成、抗体类型转换和体细胞超突变等功能[7-9]。但越来越多的研究表明,神经系统与免疫系统联系紧密,且存在交互信息传递[10-11]。近年来研究发现,人Tfh 能分泌多巴胺作用于B 细胞,促进生发中心反应[12];且腺苷酸可通过作用于Tfh上的腺苷酸受体,抑制Tfh 分化和生发中心B 细胞形成[13]。还有研究发现,大脑-脾的神经-免疫调控轴可通过去甲肾上腺素和乙酰胆碱等递质,促进浆细胞的生成和疫苗接种引起的抗体免疫应答[14]。因此,神经递质对B细胞分化的影响成为神经免疫领域的研究重点和前沿。
本研究以B细胞上表达的神经递质受体为切入点,用B细胞体外分化体系和经典的乙酰化4-羟基-3 硝基苯基偶联钥孔血蓝蛋白(4-hydroxy-3-nitrophenylacetyl conjugated to keyhole limpet hemocyanin,NP-KLH)抗原免疫小鼠模拟疫苗接种模型,检测神经递质γ-氨基丁酸(gamma-aminobutyric acid,GABA)对小鼠B细胞分化和抗体生成的影响,为相关疾病的治疗和疫苗研发提供新思路。
1 材料与方法
1.1 动物、试剂和仪器
雌性C57BL/6 小鼠,18~22 g,8~12 周,动物许可证号SCXK(京)2016-0011,北京维通利华实验动物技术有限公司;胎牛血清(fetal bovine serum,FBS),美 国Gibco 公 司;DMEM 培 养 基、RPMI 1640 培养基、青-链霉素双抗、丙酮酸钠、HEPES、胰蛋白酶、非必需氨基酸和EDTA,中科迈晨(北京)生物科技有限公司;Prime Script RT Master Mix,日本TaKaRa 公司;红细胞裂解液和铝佐剂,美国Thermo Fisher Scientific 公司;绵羊红细胞(sheep red blood cells,SRBC),郑州百基生物科技有限公司;NP-KLH、乙酰化4-羟基-3 硝基苯基偶联牛血清蛋 白(4-hydroxy-3-nitrophenylacetyl conjugated to bovine serum albumin,NP3-BSA),乙酰化4-羟基-3 硝基苯基偶联藻红蛋白(4-hydroxy-3-nitrophenylacetyl conjugated to phycoerythrin,NP-PE),美国Biosearch Technologies公司;GABA,美国MCE公司;小鼠白细胞介素4(interleukin-4,IL-4),美国PeproTech 公司;HRP-山羊抗小鼠IgG 抗体,美国Jackson Immuno Research 公司;生物素-大鼠抗小鼠CD19 抗体、EF450-大鼠抗小鼠IgM 抗体和FVS 死活细胞染料,美国eBioscience 公司;纯化的大鼠抗小鼠CD16/32、FITC-大鼠抗小鼠B220、Per-CP-大鼠抗小鼠B220、BV510-大鼠抗小鼠B220、APC-大鼠抗小鼠GL7、太平洋蓝(Pacific blue)-大鼠抗小鼠GL7、APC-大鼠抗小鼠CD138、PerCP-大鼠抗小鼠Gr-1、FITC-大鼠抗小鼠IgG1及PE-小鼠抗小鼠Fas 抗体,美国BioLegend 公司;FITC-大鼠抗小鼠CD19 抗体、PE-Cy7-仓鼠抗小鼠Fas 抗体和BD Cytofix/Cytoperm™细胞固定/通透液试剂盒,美国BD Biosciences 公司。磁力分选架、MS 分选柱、抗生物素的磁珠,美国Mitenyi Biotec 公司;Thermo FORMA311 型CO2培养箱和Q3 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)仪,美国Thermo Fisher Scientific 公司;5424R 型低温高速离心机和5424 型常温高速离心机,德国Eppendorf公司;i3酶联免疫检测仪,美国Molecular Devices 公司;流式细胞仪BD FACS Aria Ⅱ,美国BD Biosciences公司。
1.2 B细胞转录组数据分析
为分析小鼠脾幼稚B细胞和生发中心B细胞上神经递质受体表达,分析了Komban等[15]于2019年Nat Commun发表的研究论文附加原始转录组数据,该数据已上传至https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE129103。通过生物信息学方法,分析B细胞上神经递质受体表达。
1.3 流式细胞术分选SRBC 免疫小鼠幼稚B 细胞、生发中心B细胞和浆细胞
ip 给予1×109SRBC 免疫小鼠,7 d 后取脾,研磨并裂解红细胞。取1×108脾细胞,用500 μL 无菌流式缓冲液〔PBS(pH 7.4)+1%FBS+5 mmol·L-1EDTA〕重悬细胞。加入5 μg 抗CD16/32 抗 体 冰上孵育10 min,封闭IgG 抗体受体。加入100 μL抗体混合液(FITC-大鼠抗小鼠B220 抗体4 μg、PE-Cy7-仓鼠抗小鼠Fas 抗体2 μg、太平洋蓝-大鼠抗小鼠GL7 抗体2 μg 和APC-大鼠抗小鼠CD138 抗体2 μg),FVS 死活细胞染料按说明书加入。另设空白染色管及每种荧光抗体的单标管,将样本与抗体混合均匀后4 ℃孵育30 min。最后加入流式缓冲液1 mL清洗细胞,500×g离心3 min,弃上清。用无菌PBS 5 mL 重悬细胞,加至流式上样管内,用BD 流式细胞仪分选幼稚B 细胞(B220+FaslowGL7low)、生发中心B 细胞(B220+FashiGL7hi)和浆细胞(CD138+)。
1.4 RT-qPCR检测幼稚B细胞、生发中心B细胞和浆细胞上GABA受体和转运体mRNA表达
使用Trizol法分别提取幼稚B细胞、生发中心B细胞和浆细胞总RNA,用Prime Script RT Master Mix 逆转录试剂盒合成cDNA。取cDNA 500 ng和5×Prime Script Mix 2 μL,DEPC 水补充至10 μL,用Power Up SYBR Green Master Mix(AB)试剂盒进行荧光定量PCR 检测。PCR 引物均据Primer Bank 网站设计,引物序列见表1,由生工生物科技有限公司合成。以GAPDH作为内参基因,利用2-ΔΔCt法计算待测基因mRNA相对表达水平。

Tab.1 Primer sequences for real-time quantitative PCR(RT-qPCR)
1.5 B细胞体外分化体系和GABA处理
NB-21 细胞培养基由DMEM 基础培养基添加10%FBS、1%青-链霉素双抗和1%非必需氨基酸配制而成。当NB-21细胞扩增到约90%密度时,用胰蛋白酶消化,离心收集的细胞用台盼蓝染色进行活细胞计数,接种12孔板,每孔1×105细胞,5%CO2孵箱中培养过夜,作为B 细胞体外分化的饲养层细胞。
取8 周龄未免疫小鼠脾,研磨,裂解红细胞,离心收集脾细胞并计数。用200 μL 磁珠缓冲液(PBS+1%BSA+EDTA 2 mmol·L-1)重悬2×107脾细胞,加入抗CD16/32 抗体2 μg 冰上孵育,封闭IgG 抗体受体10 min。加入生物素-大鼠抗小鼠CD19 抗体1 μg 和抗生物素微珠5 μL,利用磁珠法分离幼稚B细胞。
B 细胞体外分化体系:取B 细胞培养基(RPMI 1640 培养基添加10% FBS、1%青-链霉素双抗、1%非必需氨基酸、HEPES 10 mmol·L-1、丙酮酸钠1 mmol·L-1、β巯基乙醇55 μmol·L-1),加入小鼠IL-4 2 μg·L-1,重悬幼稚B 细胞。移除NB-21 饲养层细胞培养基,每孔加入2×105幼稚B细胞。
B 细胞体外分化实验分为4 组:细胞对照及GABA 0.2,1.0 和2.0 mmol·L-1组[16],每组3 平行孔。从B 细胞体外培养分化第1 天起,每天半量换液,第5 天收集B 细胞,流式细胞仪分析IgG1+GL7+生发中心B细胞和CD138+浆细胞百分比。
1.6 NP-KLH免疫小鼠的制备和分组处理
小鼠随机分为3 组:正常对照(7 只)、免疫+PBS(16 只)和免疫+GABA 组(16 只)。将溶解的1 g·L-1NP-KLH 抗原与等体积铝佐剂混合均匀,除正常对照组外,每只小鼠(8 周龄)ip 给予NP-KLH 100 μg,免疫后ip给予PBS或GABA(20 mg·kg-1)[17],每天1次,连续12 d。第13天处死正常对照组4只、免 疫+PBS 组7 只和免疫+GABA 组7 只小鼠,制备脾细胞进行流式分析。第27 天处死正常对照组3 只、免疫+PBS 组9 只和免疫+GABA 组9 只小鼠,制备骨髓细胞进行流式分析。
1.7 流式细胞术分析NP-KLH 免疫小鼠脾生发中心B细胞、总浆细胞和lgG1+浆细胞亚群
取1.6 分组处理的部分小鼠,NP-KLH 免疫后第13 天处死,取脾制备单细胞悬液,裂解红细胞后调整细胞密度为5×1010L-1。取脾细胞100 μL,加入抗CD16/32抗体1 μg冰上孵育10 min,封闭IgG 抗体受体,按以下方案进行流式抗体孵育后于流式细胞仪检测。①脾生发中心B 细胞染色:PerCP-大鼠抗小鼠B220抗体1 μg,APC-大鼠抗小鼠GL7抗体0.5 μg,PE-Cy7-小鼠抗小鼠Fas 抗体0.5 μg,FVS 死活细胞染料按说明书加入。②脾总浆细胞和IgG1
+浆细胞染色:PerCP-大鼠抗小鼠B220 抗体1 μg,APC-大鼠抗小鼠CD138 抗体0.5 μg,FVS 死活染料按说明书加入;染色30 min后用BD Cytofix/Cytoperm ™细胞固定/通透液试剂盒破膜,加入FITC-大鼠抗小鼠IgG1抗体0.5 μg染色。
1.8 流式细胞术分析NP-KLH免疫小鼠骨髓NP+lgM-浆细胞亚群分析
取1.6 分组处理的部分小鼠,NP-KLH 免疫后第27天处死,剪取小鼠一侧股骨,用1 mL注射器吸FACS 缓冲液刺入关节处,将骨髓细胞冲至1.5 mL EP 管,裂解红细胞后调整细胞密度为1×1010L-1。PerCP-大鼠抗小鼠Gr-1 抗体0.5 μg,FITC-大鼠抗小鼠B220抗体1 μg,APC-大鼠抗小鼠CD138抗体0.5 μg,FVS 死活细胞染料按说明书加入。染色30 min 后用BD Cytofix/Cytoperm™细胞固定/通透液试剂盒破膜,加入NP-PE 染料0.5 μg 和EF450-大鼠抗小鼠IgM 抗体0.5 μg。另设空白染色管和每种荧光抗体单标管。最后加入1 mL 流式缓冲液清洗细胞,500×g离心3 min,弃上清,用PBS 300 μL重悬细胞用于流式细胞仪分析。
1.9 ELlSA 检测NP-KLH 免疫小鼠血清中抗原特异性lgG抗体
分别取1.6 处理的正常对照、免疫+PBS 和免疫+GABA 组脾浆细胞百分比接近平均值的3 只小鼠,NP-KLH 免疫后第13 天摘除眼球取血,制备血清,ELISA检测血清中抗原特异性IgG抗体[14],测定波长为450 nm。
1.10 统计学分析
实验结果数据用±s表示。利用Flowjo10 分析流式细胞检测的源文件,分析分化过程中不同阶段B 细胞所占B 细胞总数百分比,并用流式等高线图和散点图展示。使用GraphPad Prism 8.0 软件进行统计学分析,多组间比较采用单因素方差分析,两组间比较采用成组t检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 B细胞上GABA受体和转运体mRNA表达水平
通过分析已知B 细胞数据库,发现小鼠脾中幼稚B 细胞和生发中心B 细胞均高表达GABA B1 型受体(GABA B receptor,subunit 1,Gabbr1)(图1A)。用流式细胞仪分选出SRBC 免疫小鼠脾幼稚B 细胞(B220+FaslowGL7low)、生发中心B细胞(B220+FashiGL7hi)和浆细胞(CD138+)(图1B),RT-qPCR检测结果显示,幼稚B细胞、生发中心B细胞和浆细胞主要表达GABA受体Gabbr1,其他受体和转运体几乎无表达(图1C)。
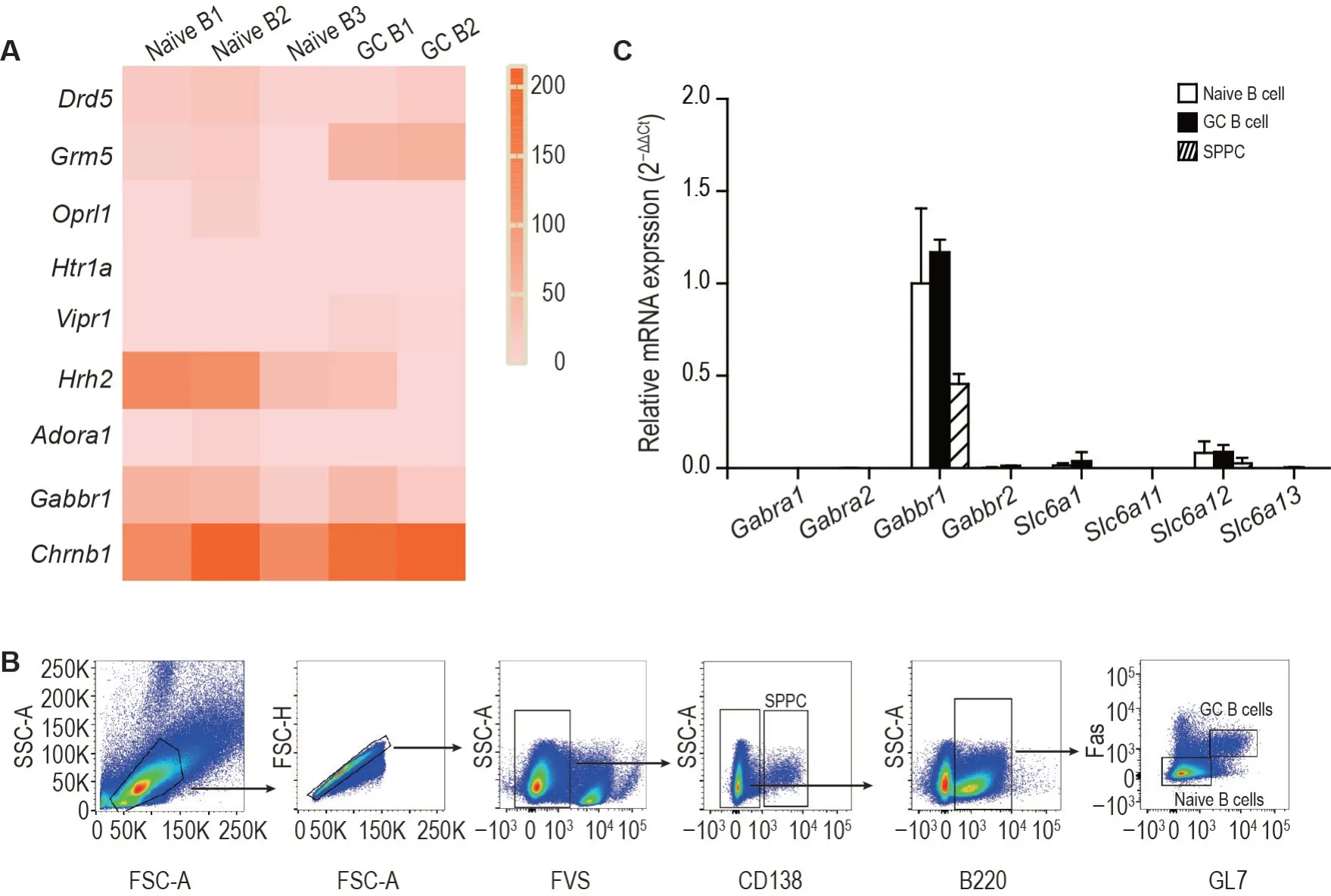
Fig.1 Expression levels of γ-aminobutyric acid(GABA)receptors and transporters in B cells of mice. A:heat-map showed expressions of neurotransmitter receptors and transcripts from RNA-seq data of the splenic naïve B cells and germinal center(GC)B cells.B:flow cytometry sorting strategy for naïve B cells(B220+FaslowGL7low),germinal center(GC)B cells(B220+FashiGL7hi)and splenic plasma cells(SPPCs)(CD138+)from the spleens of mice on the 7th day after sheep red blood cell immunization.C:mRNA expressions of GABA receptors and transporters in sorted naïve B cells,GC B cells and SPPC detected by RT-qPCR.±s,n=3.Drd5:dopamine receptor D5;Grm5:glutamate receptor,metabotropic 5;Oprl1:opioid receptor-like 1;Htr1a:5-hydroxytryptamine receptor 1A;Vipr1:vasoactive intestinal peptide receptor 1;Hrh2:histamine receptor H2;Adora1:adenosine A1 receptor;Chrnb1:cholinergic receptor nicotinic beta 1 subunit.
2.2 B细胞体外分化体系的建立
经磁珠分选后,B细胞纯度达到91.8%(图2A)。将其加入到NB-21 饲养层细胞上进行体外培养,并加IL-4 诱导B 细胞分化。流式细胞术测定结果表明,培养前5 d 浆细胞百分比逐渐升高至38.6%,第6天开始减少(27.3%)(图2B)。
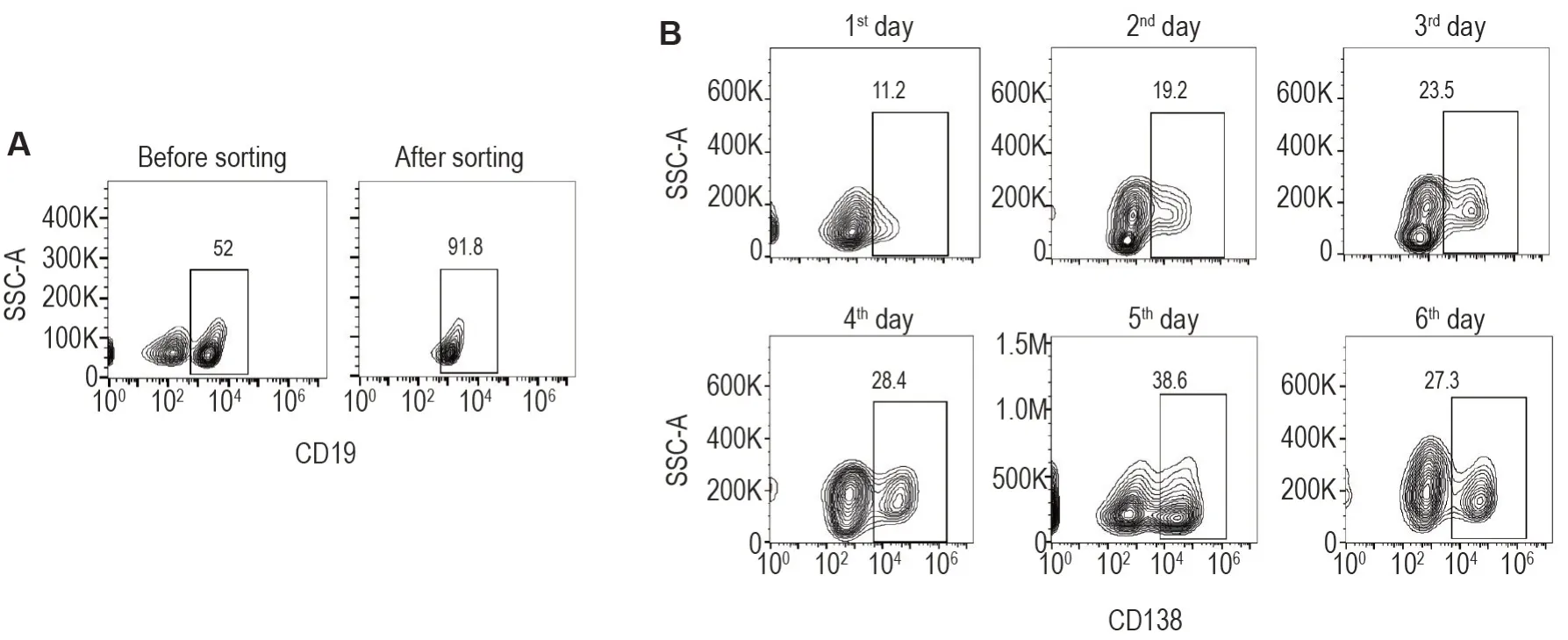
Fig.2 Changes of percentage of CD138+ plasma cells from isolated naïve B cells of mice detected by flow cytometry. A: naïve B cells (CD19+) purified from spleens of normal mice by anti-biotin microbeads;B: quantification of CD138+ plasma cells in in vitro plasma cell differentiation system.
2.3 GABA促进浆细胞的体外分化
如图3 所示,B 细胞体外分化过程中加入不同浓度GABA 后,与细胞对照组相比,GABA 不影响IgG1+GL7+生发中心B 细胞形成,但GABA 1.0 和2.0 mmol·L-1明显升高CD138+浆细胞百分比(P<0.01),提示GABA可促进浆细胞体外分化。
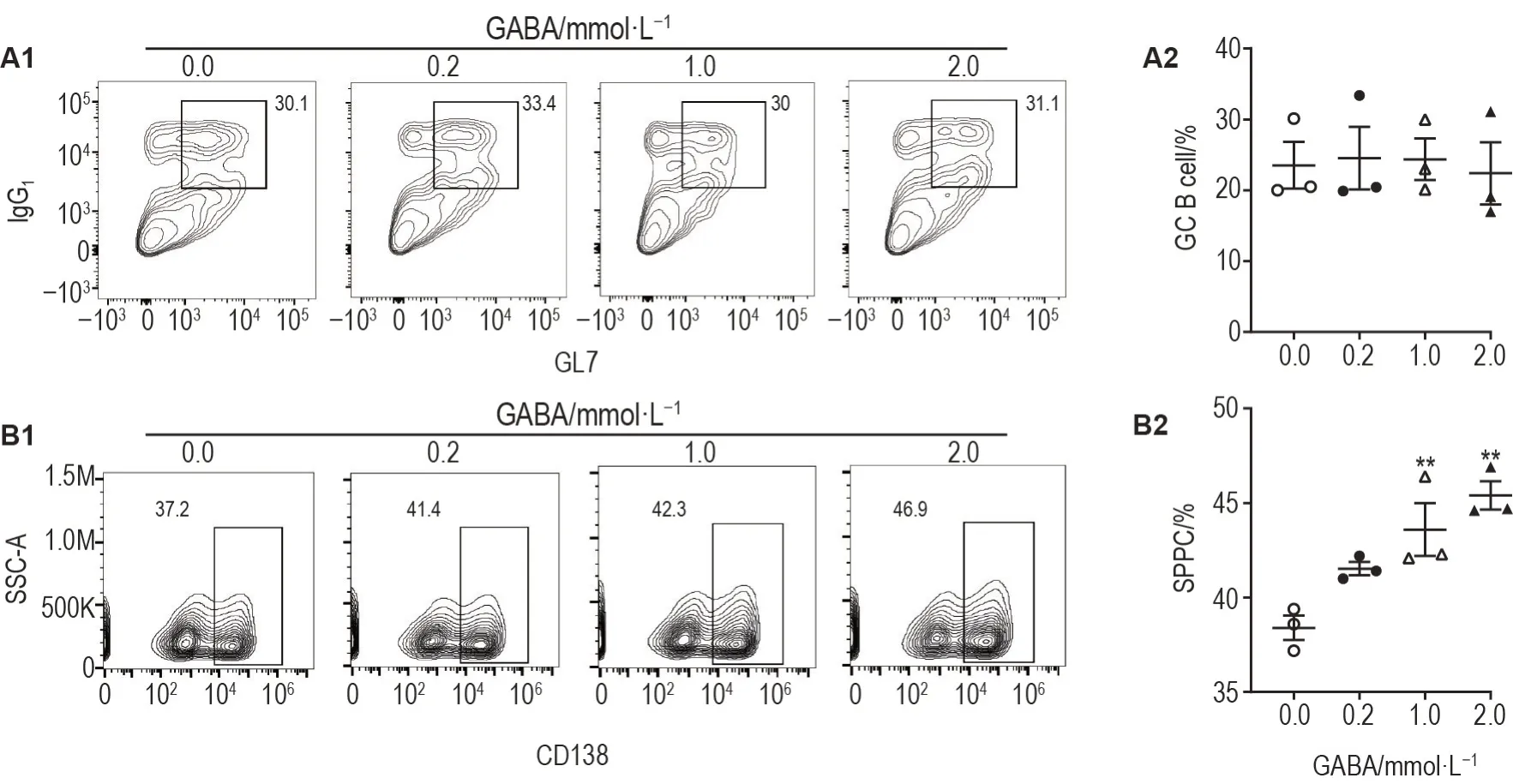
Fig.3 GABA promoted differentiation of CD138+ plasma cells in vitro detected by flow cytometry. A and B: percentages of IgG1+GL7+ GC B cells and CD138+ SPPCs,respectively,after culture in in vitro plasma cell differentiation system alone or with GABA for 5 d.±s,n=3.**P<0.01,compared with cell control(GABA 0.0 mmol·L-1)group.
2.4 GABA促进NP-KLH免疫小鼠浆细胞分化
NP-KLH 免疫小鼠第13 天,流式细胞术检测脾生发中心B 细胞和浆细胞百分比,圈门策略如图4A所示。图4B 和4C 结果显示,与正常对照组相比,免疫+PBS 组小鼠生发中心B 细胞百分比明显增高(P<0.01),浆细胞(P<0.05)和IgG1+浆细胞(P<0.01)百分比亦明显升高,提示抗原NP-KLH免疫小鼠成功。与免疫+PBS 组相比,免疫+GABA 组小鼠生发中心B 细胞无明显变化,浆细胞(P<0.01)和Ig G1+浆细胞(P<0.05)百分比显著升高。
2.5 GABA促进NP-KLH免疫小鼠骨髓抗原特异性浆细胞分化
NP-KLH 免疫小鼠第27 天后,流式细胞术检测骨髓中NP+IgM-浆细胞百分比,圈门策略如图5A 所示。与正常对照组相比,免疫+PBS 组小鼠骨髓中NP+IgM-浆细胞百分比明显增多(P<0.01),且免疫+GABA组显著高于免疫+PBS 组(P<0.05)(图5B)。
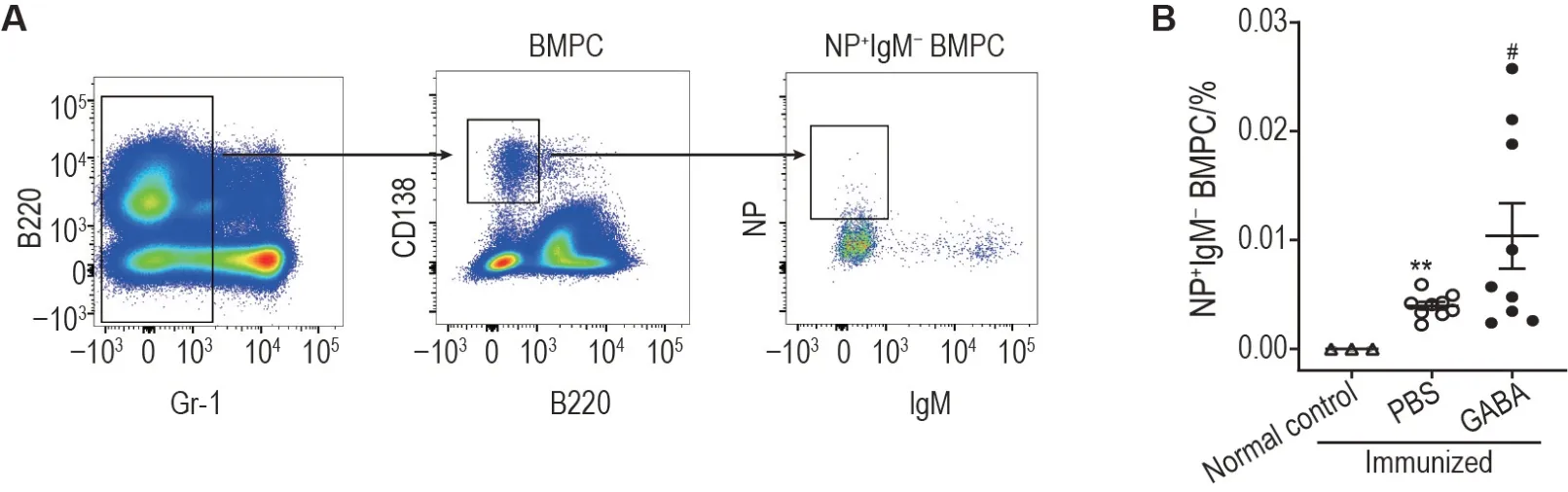
Fig.5 GABA increased abundance of antigen-specific bone-marrow plasma cells (BMPCs) of mice after immunization with NP-KLH detected by flow cytometry. See Fig.4 for the mouse treatment. A and B: gating strategy and frequencies of NP-binding B220-CD138+IgM- (BMPCs) on the 27th day after NP-KLH immunization, respectively. x ±s, n=3 (normal control group), 9 (immunized+PBS and immunized+GABA groups).**P<0.01,compared with normal control group; #P<0.05,compared with immunized+PBS group.
2.6 GABA 促进NP-KLH 免疫小鼠高亲和力抗体生成
如图6 所示,与正常对照组相比,免疫+PBS 组小鼠血清NP 特异性抗体明显升高(P<0.01),且免疫+GABA组显著高于免疫+PBS组(P<0.01)。
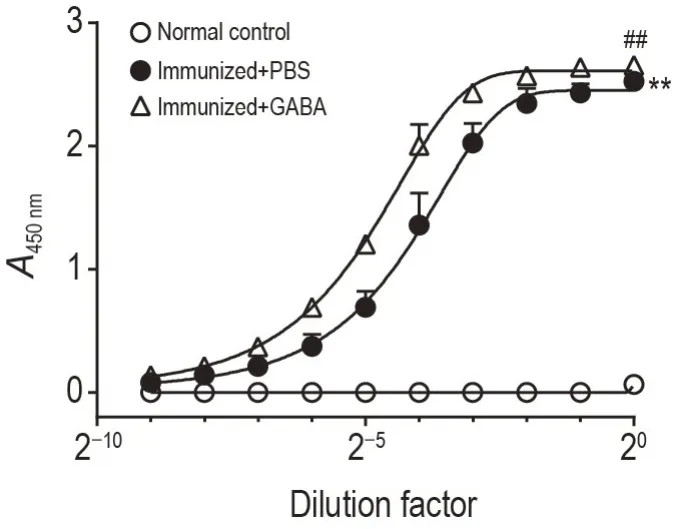
Fig.6 GABA enhanced antigen-specific antibody response of mice after immunization with NP-KLH.See Fig.4 for the mouse treatment. NP-specific IgG titers of mice were detected by ELISA on the 13rd day after NP-KLH immunization.±s,n=3. **P<0.01,compared with normal control group;##P<0.01,compared with immunized+PBS group.
3 讨论
抗体是机体用于抵抗细菌、病毒等外来病原体侵袭的重要免疫分子,由B 细胞分化成的浆细胞分泌。但由于B 细胞在体外培养时极易凋亡,其分化体系一直是研究的热点和难点。2011 年,日本Takuya Nojima 教授实验室改造了BALB/c 小鼠3T3 细胞系,使其稳定表达小鼠CD40L 和B 细胞激活因子,称为40LB 细胞[18],将其作为B 细胞的饲养层细胞,才使B细胞长期体外培养和分化得以实现,但该体系浆细胞分化比例较低。在此基础上,2016年美国Garnett Kelsoe 实验室进一步改造40LB 细胞,使其稳定表达小鼠IL-21 得到NB-21 细胞,建立了目前公认的B细胞体外分化成浆细胞的体系[19]。
GABA 是一种重要的抑制性神经递质,具有降血压、促进乙酰胆碱合成和促进生长激素分泌等多种生理功能[20-21],主要通过GABA 受体及GABA 转运体等发挥作用[22]。据报道,其作用于巨噬细胞和T 细胞行使免疫调节功能,如GABA 通过GABA 转运体2 改变细胞代谢方式从而调控M1 型巨噬细胞极化[23],GABA 转运体SLC6A13 缺乏能促进肠道感染时Th17 细胞的分化等[24]。然而,关于GABA能否调控B细胞分化和抗体生成尚无报道。
本研究成功建立B 细胞体外分化体系,分化过程中加入GABA 明显提高CD138+浆细胞百分比,表明神经递质GABA在体外能促进B细胞向浆细胞分化。Gabbr1 受体为G 蛋白偶联受体[25],在B 细胞上高表达,但该受体促进B 细胞分化的分子机制尚不清楚。本研究用流式细胞仪分选出SRBC 免疫小鼠脾幼稚B 细胞、生发中心B 细胞和浆细胞,发现它们均表达Gabbr1受体,其他受体和转运体几乎无表达。
GABA在小鼠血清中的生理浓度为2 mg·kg-1[26]。Ren 等[17]报道,ip 给予小鼠GABA 40 μg·kg-1~40 mg·kg-1可促进空肠组织IL-17 表达且呈浓度依赖性。NP-KLH 是一种T 细胞依赖性抗原,可在小鼠体内诱导出生发中心反应。本研究发现,NP-KLH 免疫后ip 给予小鼠GABA 20 mg·kg-1可促进浆细胞分化。GABA 在体内可促进Th17 细胞分化[24],那么GABA 是否可直接促进B 细胞分化尚未见报道。为此本研究用流式细胞术分析NP-KLH免疫后小鼠脾Tfh 百分比,确定GABA 是否通过增加Tfh 数量而促进浆细胞生成。研究结果表明,ip给予GABA 20 mg·kg-1可促进NP-KLH 免疫小鼠脾B细胞向浆细胞分化。GABA是调节神经元间通讯的抑制性神经递质,主要由GABA能神经元释放。但最近有研究报道,GABA也能由脾和淋巴结等B细胞产生[16]。由此提示,机体受到抗原刺激时也可能由B细胞自分泌GABA而促进其向浆细胞分化并产生抗体。
综上,神经递质GABA 在B 细胞分化过程中具有调控功能,提示GABA 可能是一种有研究价值的促进体液免疫反应的靶点,有望为提高疫苗的有效性及机体抗病毒能力提供新策略。

