蛋白磷酸酶1调节亚基14B对神经母细胞瘤细胞有丝分裂进程的调控作用
简肖肖,张万鹏,常 艳,张学敏,李慧艳,胡怀斌
(1.国家生物医学分析中心,北京 100850;2.国家儿童医学中心,首都医科大学附属北京儿童医院,儿科重大疾病研究教育部重点实验室,儿童耳鼻咽喉头颈外科疾病北京市重点实验室,北京市儿科研究所耳鼻咽喉头颈外科研究室,北京 100045)
神经母细胞瘤(neuroblastoma,NB)是儿童最常见的颅外实体瘤,恶性程度高,预后差,占儿童恶性肿瘤的8%~10%,死亡数约为所有儿童因癌症死亡人数的15%[1-2]。NB 最常见的发生部位是肾上腺,也可发生在颈、胸和腹部及盆腔神经组织[3-4]。国际神经母细胞瘤分期系统(International Neuroblastoma Staging System)将NB 分为1,2A/2B,3,4 和4S 期[5],其中1 期恶性程度较低,4 期恶性程度最高,4S期特指1岁以内的患儿。目前临床上常用的治疗方法包括放疗、化疗、手术切除和免疫治疗等,然而治疗效果并不理想,患者总生存率仍<40%[6]。因此,深入研究NB 发生发展机制并寻找其治疗新靶点具有重要意义。
细胞周期分为G1,S,G2和M 4 个分期,其中M期(有丝分裂期)又可分为前期、前中期、中期、后期和末期。细胞周期整个过程受到一系列分子的精确调控,其调控异常可能引起细胞无限增殖,最终导致肿瘤等疾病发生[7-8]。据报道,多种细胞周期激酶如周期蛋白依赖性激酶、aurora 激酶和polo 样激酶等,在恶性肿瘤中表达异常或发生突变[9-10]。目前靶向这些激酶的小分子抑制剂已在不同肿瘤的非临床试验或临床治疗中取得了良好效果[11-12],但与其他很多小分子靶向药物相似,目前这些激酶的小分子抑制剂仅对部分肿瘤患者有效。因此,继续深入研究肿瘤细胞周期调控机制,不仅可揭示肿瘤发生发展规律,还将为肿瘤诊断治疗提供新的潜在靶标。
蛋白磷酸酶1 调节亚基14B(protein phosphatase 1 regulatory subunit 14B,PPP1R14B)是蛋白磷酸酶1的抑制蛋白。最近研究报道,PPP1R14B在多种成人肿瘤组织中高表达,其高表达患者生存率较低[13]。且已有报道,PPP1R14B 在细胞有丝分裂期发生磷酸化[14],但具体功能尚不清楚。本研究观察其在NB 细胞有丝分裂期发挥的作用,并初步探讨其在NB中的表达水平及其与预后的相关性。
1 材料与方法
1.1 细胞、主要试剂和仪器
人NB 细胞SK-N-BE(2)-M17和SK-N-BE(2)-M17 GFP-H2B 细胞,中国医学科学院基础医学研究所细胞资源中心;人胚肾细胞HEK293T,美国ATCC 细胞库;均培养于DMEM 完全培养基(含有10%胎牛血清,1%青-链霉素),于37 ℃,5%CO2细胞培养箱中培养,待贴壁生长至70%~80%融合度时传代。大肠杆菌DH5α 感受态细胞(S101-02),北京康润诚业生物科技有限公司。
脂质体转染试剂Lipofectamine RNAiMAX,美国Invitrogen公司;Opti-MEM 培养基,美国Gibco公司;DMEM 培养基、青-链霉素双抗和胰酶,中科迈晨(北京)科技有限公司;胎牛血清(fetal bovine serum,FBS),依科赛生物科技有限公司;Prime-Script RT Master Mix,日本TaKaRa 公司;PowerUp SYBR Green Master Mix,美国Thermo Fisher 公司;质粒抽提试剂盒,美国Promega 公司;兔抗人PPP1R14B 多克隆抗体(一抗),美国Proteintech公司;小鼠抗α 微管蛋白单克隆抗体(一抗),美国Sigma 公司;辣根过氧化物酶标记山羊抗兔IgG 抗体和辣根过氧化物酶标记山羊抗小鼠IgG 抗体(二抗),美国Jackson ImmunoResearch 公司。Mini-PROTEAN 型Western Blot 电泳仪,美国BIO-RAD公司;FORMA311 型细胞培养箱,美国Thermo Fisher 公司;5424R 型低温超速离心机和542R 型常温超速离心机,德国Eppendorf 公司;UltraVIEW Vox型转盘式共聚焦显微镜,英国PerkinElmer公司;QuantStudio 5 实时荧光定量PCR(real-time quantitative PCR,RT-qPCR)仪,美国ABI公司。
1.2 小干扰RNA(small interfering RNA,siRNA)序列设计及脂质体介导的siRNA转染
据PPP1R14B基因的cDNA序列(NM_138689.3)及siRNA 设计原则,设计针对PPP1R14B基因编码区的2 条siRNA 序列,命名为PPP1R14BsiRNA#1和#2,同时设计对照siRNA,序列见表1。序列经BLAST 同源性比对后由广州锐博生物技术有限公司合成。
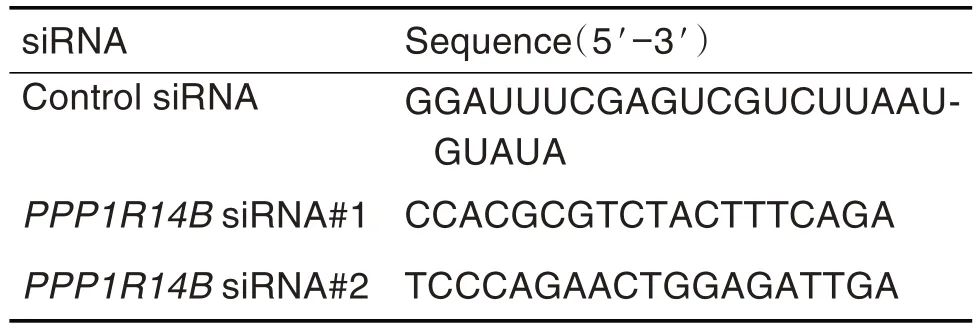
Tab.1 Sequences of small interfering RNA (siRNA)
取状态良好的对数生长期SK-N-BE(2)-M17细胞接种于6 孔板。次日,细胞生长至融合度约40%时,按Lipofectamine RNAiMAX 转染试剂说明书操作,分别转染对照siRNA,PPP1R14BsiRNA#1和#2。转染前1 h将培养液换成原体积的1/2,所用siRNA终浓度为80 nmol·L-1,RNAiMAX稀释250倍使用;按比例配制Opti-MEM和RNAiMAX,静置5 min;再按比例配置Opti-MEM 和siRNA,混合均匀后静置15 min;然后逐滴加入到6 孔板中,6 h后换为新的DMEM完全培养基,继续培养48 h。
1.3 RT-qPCR 检测SK-N-BE(2)-M17 细胞敲低PPP1R14B后PPP1R14B mRNA表达水平
SK-N-BE(2)-M17 细胞转染siRNA 后继续培养48 h,用Trizol 法提取总RNA,再利用Prime-Script RT Master Mix 试剂盒将RNA 逆转录为cDNA,体系为RNA 500 ng,5×PrimeScript RT Mix 2 μL,DEPC 水补充至10 μL。然后按PowerUp SYBR Green Master Mix试剂盒说明书对PPP1R14BmRNA 进 行RT-qPCR 检 测。PPP1R14B引 物 在PrimerBank 网站(https://pga.mgh.harvard.edu/primerbank/)设计,序列为:GACGATGAGGGCCCAGTG(正向),TCCTCTTCCTGGCAGTCGTA(反向),由北京六合华大基因科技有限公司合成,PCR 产物为134 bp。GAPDH引物序列为CGAGATCCCTCCAAAATCAA(正向),TTCACACCCATGACGAACAT(反向)。PCR 体系为cDNA 0.5 μL,SYBR Green Master Mix 5 μL,正向和反向引物各0.5 μL,双蒸水3.5 μL,总体积为10 μL。实验条件为95 ℃预变性10 min;95 ℃变性15 s,60 ℃退火1 min,共40 个循环。以GAPDH为内参对照,用2-ΔΔCt表示PPP1R14BmRNA相对表达水平。
1.4 Western 印迹法检测SK-N-BE(2)-M17 细胞PPP1R14B敲低后PPP1R14B蛋白表达水平
SK-N-BE(2)-M17 细胞转染siRNA 后继续培养48 h,弃培养基,用PBS 洗2 遍,加入M2 裂解液(蛋白酶抑制剂和磷酸酶抑制剂临用前加入),4 ℃混悬裂解30 min;15 000×g,4 ℃离心15 min;收集裂解液上清,加入等体积2×SDS蛋白电泳上样缓冲液,沸水煮样。将样品用13% SDS-PAGE 进行电泳,转膜2 h,将蛋白转至PVDF 膜上。用含5%脱脂奶粉1×TBST 将PVDF 膜室温封闭1 h,弃封闭液,依次加入兔抗人PPP1R14B 多克隆抗体(1∶1000)和小鼠抗α 微管蛋白单克隆抗体(1∶5000),4 ℃孵育过夜。次日,用1×TBST 洗膜3 次,每次5 min;加入相应二抗(1∶5000),室温孵育1 h;再用1×TBST 洗膜3 次,每次5 min;取等量ECL 化学发光检测试剂盒中的A 和B 液混合均匀,涂抹在PVDF 膜上,用医用X 射线胶片在暗室中进行显影,条带深度表示待测蛋白表达水平。
1.5 Time-lapse 活细胞成像技术动态监测SK-NBE(2)-M17 GFP-H2B细胞有丝分裂进程
将SK-N-BE(2)-M17 GFP-H2B 细胞接种于8 孔腔室中,按1.2 siRNA 转染方法分别转染对照siRNA,PPP1R14BsiRNA #1 和#2;转染6 h 后换为新鲜的DMEM完全培养基,继续培养24 h;加入细胞周期同步化药物胸苷(终浓度为2.5 mmol·L-1),同步化24 h 后弃含胸苷的培养基,用预热的生理盐水洗细胞5 次。将细胞释放到正常的DMEM 培养基中,6 h 后用转盘式共聚焦显微镜扫描各组细胞有丝分裂进程并采集图像,共扫描16 h。扫描完成后用Volocity 软件对各组细胞从有丝分裂期开始到染色体分离所经历的时间及前中期和中期时间进行统计分析。
1.6 慢病毒体系构建PPP1R14B稳定敲低细胞系
根据PPP1R14B基因cDNA序列(NM_138689.3)和短发夹RNA(short-hairpin RNA,shRNA)设计原则,由北京擎科生物科技有限公司合成对照shRNA和2 条不同的靶向PPP1R14B基因的shRNA 序列,命名为shPPP1R14B#1 和#2。用酶切克隆方法构建含对照shRNA,shPPP1R14B#1 和#2 的慢病毒质粒,shRNA序列与siRNA相同(表1)。
慢病毒包装:取状态良好的HEK293T 细胞接种于10 cm 培养皿中(每皿2.5×106细胞),当细胞密度约60%时进行质粒转染。分别将6 μg 目的质粒(分别含对照shRNA,shPPP1R14B#1或#2的目的质粒),4.5 μg psPAX2和1.5 μg pCMV-VSVG 包装质粒,加到1 mL HBS 中混匀,然后加入67 μL CaCl2,混合均匀,静置15 min;将混合液逐滴加入到HEK293T 细胞培养皿中,转染6 h 后换成新的DMEM 完全培养基,继续培养。转染48 h 后第1次收集病毒上清,换液后于72 h 再次收集病毒上清。将2 次收集的病毒上清混合,2000×g离心10 min,取上清用0.45 μm 微孔滤器过滤;滤液中加入病毒浓缩液4 ℃过夜,4000×g低温离心30 min 后弃上清,将病毒沉淀用1 mL 冰PBS 重悬、分装,获得分别含对照shRNA,shPPP1R14B#1和#2的慢病毒,置-80 ℃冰箱保存备用。
慢病毒感染SK-N-BE(2)-M17 细胞:将SK-NBE(2)-M17 细胞接种于10 cm 培养皿中,当细胞密度约50%时,每皿加入300 μL PBS 病毒重悬液,置培养箱中培养。培养48 h 后加入嘌呤霉素(终浓度2 mg·L-1)进行筛选,筛选5~7 d 后获得稳定敲低PPP1R14B 的SK-N-BE(2)-M17 细胞。Western印迹法检测PPP1R14B蛋白表达水平。
1.7 克隆形成实验检测稳定敲低PPP1R14B 的SK-N-BE(2)-M17细胞克隆形成数
将稳定敲低PPP1R14B 的SK-N-BE(2)-M17细胞及对照敲低细胞,以每孔800 细胞接种于6 孔板中,每3 d 换培养基1 次,连续培养14 d;最后弃培养基,PBS 洗1 次;4%多聚甲醛固定10 min,PBS 洗1次;结晶紫染色15 min,用水洗去多余的染色液,室温晾干,拍照,计算每组细胞克隆形成数。
1.8 GEO 数据库分析神经母细胞瘤中PPP1R14B表达水平及其与预后的关系
从GEO(Gene Expression Omnibus)数据库(http://www.ncbi.nlm.nih.gov/geo/)(2021 年1 月)下载NB数据集GSE49711,分析在不同分期(1期、2期、3期、4期和4S期)NB中PPP1R14B表达水平及其与患者预后的相关性。
1.9 统计学分析
实验结果数据用±s表示,用GraphPad Prism 8.0 统计学软件对数据进行分析。两组间比较采用t检验(符合正态分布)或秩和检验(不符合正态分布)方法分析。P<0.05为差异具有统计学意义。
2 结果
2.1 转染siRNA对SK-N-BE(2)-M17细胞PPP1R14B敲低效果
RT-qPCR(图1A)和Western 印迹法(图1B)结果显示,与转染对照siRNA 的SK-N-BE(2)-M17细胞相比,转染PPP1R14BsiRNA#1 和#2 的SK-N-BE(2)-M17 细 胞PPP1R14B mRNA(P<0.01)和蛋白表达水平均明显降低,表明该2条siRNA序列均可有效敲低SK-N-BE(2)-M17 细胞中PPP1R14B表达。
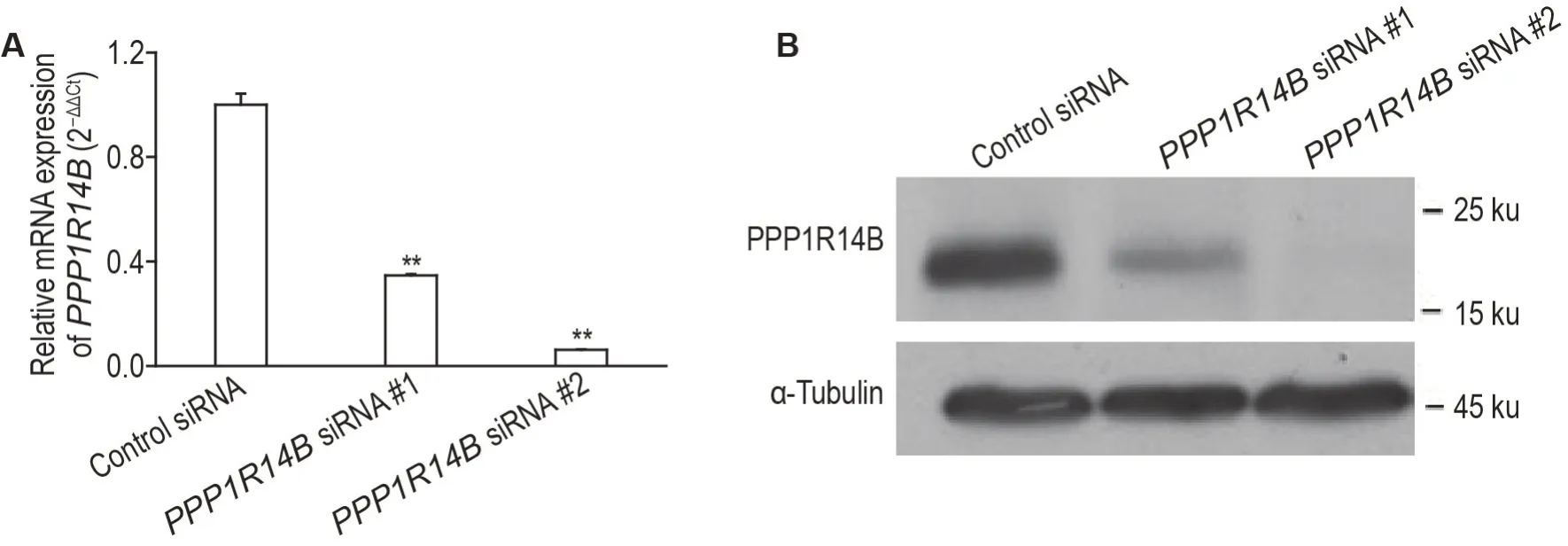
Fig.1 Knockdown effect of PPP1R14B in SK-N-BE(2)-M17 cells transfected with PPP1R14B siRNA #1 and #2,respectively. A:PPP1R14B mRNA expression detected by RT-qPCR;B:PPP1R14B protein expression detected by Western blotting.±s,n=3.**P<0.01,compared with control siRNA group.
2.2 转染siRNA敲低PPP1R14B导致SK-N-BE(2)-M17 GFP-H2B细胞有丝分裂期阻滞
在SK-N-BE(2)-M17 GFP-H2B 细胞中转染PPP1R14BsiRNA #1 或#2 敲低PPP1R14B,转染30 h 后加入胸苷,24 h 将细胞阻滞在G1/S 期,随后将细胞释放6 h 到G2期,最后采用Time-lapse 活细胞成像技术动态检测各组细胞有丝分裂进程(图2A)。结果如图2B 所示,转染对照siRNA 组SK-NBE(2)-M17 GFP-H2B细胞从核膜破裂到后期姐妹染色单体分离共持续45 min,而转染siPPP1R14B#1组延长到60 min,siPPP1R14B#2组延长到65 min。统计分析结果(图2C)显示,与转染对照siRNA 组相比,转染PPP1R14BsiRNA#1 和#2 组细胞平均分离持续时间明显延长(P<0.05,P<0.01)。以上结果表明,敲低PPP1R14B 导致SK-N-BE(2)-M17 GFP-H2B细胞有丝分裂期阻滞。
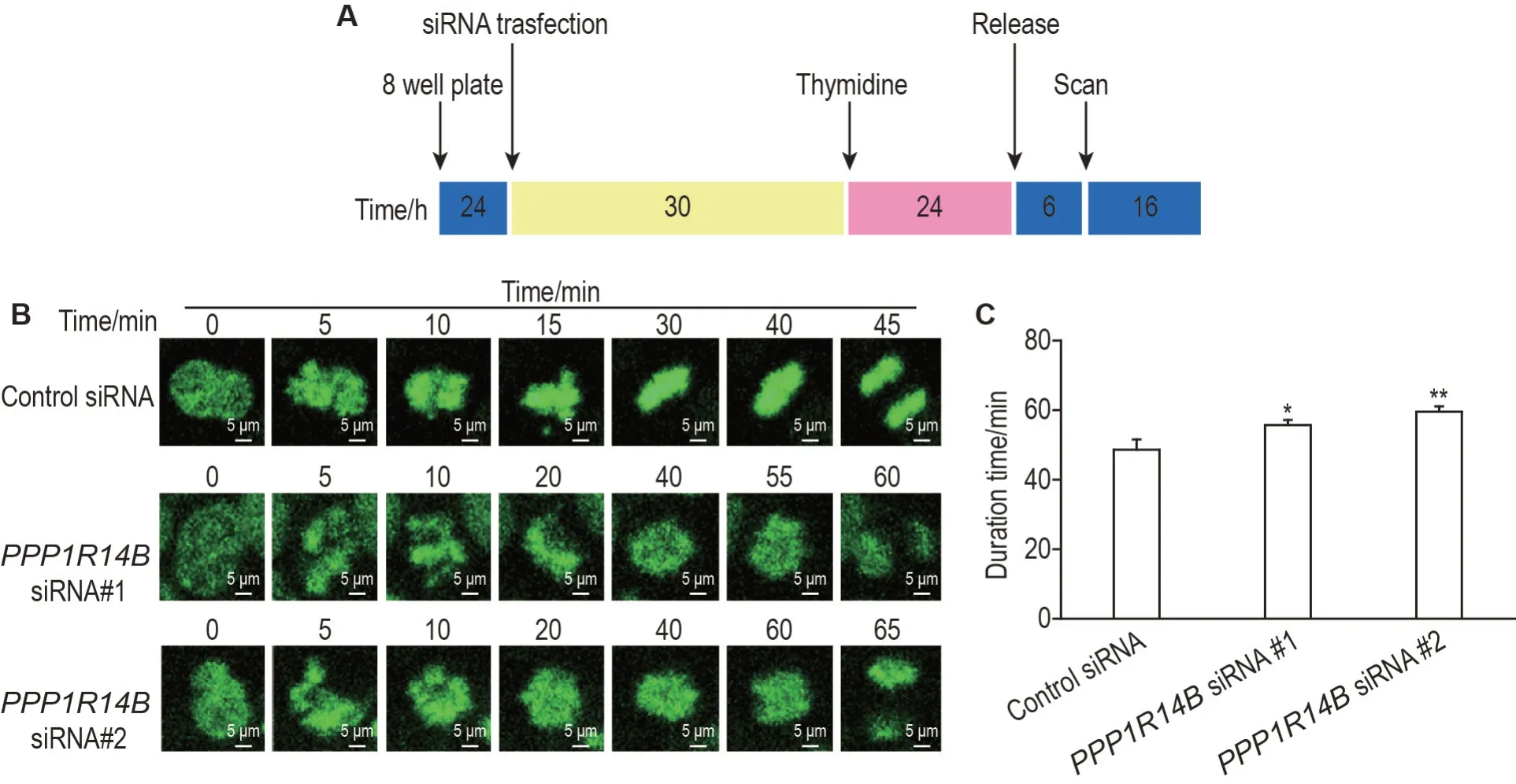
Fig.2 Effect of PPP1R14B knockdown by siRNA transfection on mitosis in SK-N-BE(2)-M17 GFP-H2B cells by time-lapse living cell imaging technique. A:the synchronization process of time-lapse;B:time-lapse images of SK-N-BE(2)-M17 GFP-H2B cells transfected with control siRNA,PPP1R14B siRNA #1 or PPP1R14B siRNA#2,and the numbers meant the time after nuclear envelope breakdown;C:the separation duration time.±s,n=3.*P<0.05,**P<0.01,compared with control siRNA group.
2.3 转染siRNA敲低PPP1R14B导致SK-N-BE(2)-M17 GFP-H2B细胞有丝分裂前中期时间延长
对SK-N-BE(2)-M17 GFP-H2B 细胞有丝分裂前中期和中期时间进行统计分析结果(图3)显示,与转染对照siRNA组相比,转染PPP1R14BsiRNA#1和#2 组细胞前中期时间明显延长(P<0.01),而中期时间缩短(P<0.05),表明敲低PPP1R14B 使SK-N-BE(2)-M17 GFP-H2B 细胞有丝分裂前中期时间延长,从而导致细胞有丝分裂期阻滞。
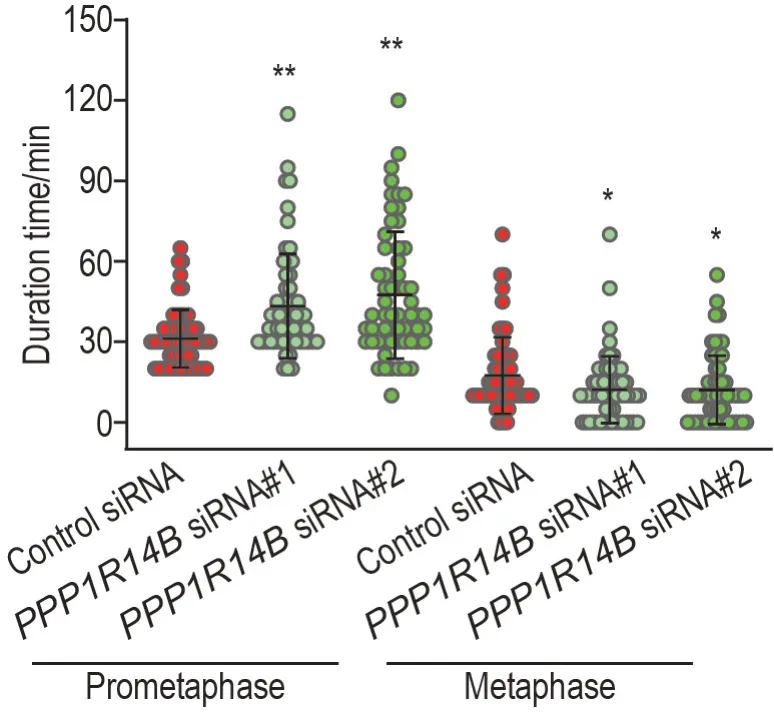
Fig.3 Effect of PPP1R14B knockdown by siRNA transfection on mitotic time in SK-N-BE(2)-M17 GFP-H2B cells detected by time-lapse living cell imaging technique.See Fig.2A for the cell treatment.±s,n=60 cells.*P<0.05,**P<0.01,compared with control siRNA group.
2.4 shRNA稳定敲低PPP1R14B抑制SK-N-BE(2)-M17细胞克隆形成
Western 印迹法结果(图4A)显示,与转染对照shRNA 组相比,转染shPPP1R14B#1 或#2 组SK-N-BE(2)-M17 细胞PPP1R14B 蛋白表达水平明显降低,表明靶向PPP1R14B 的该2 条shRNA均可有效敲低PPP1R14B 表达。克隆形成实验结果(图4B1 和B2)显示,转染shPPP1R14B#1 或#2组SK-N-BE(2)-M17细胞克隆形成数亦明显少于转染对照shRNA 组(P<0.01),表明敲低PPP1R14B可抑制SK-N-BE(2)-M17细胞生长。
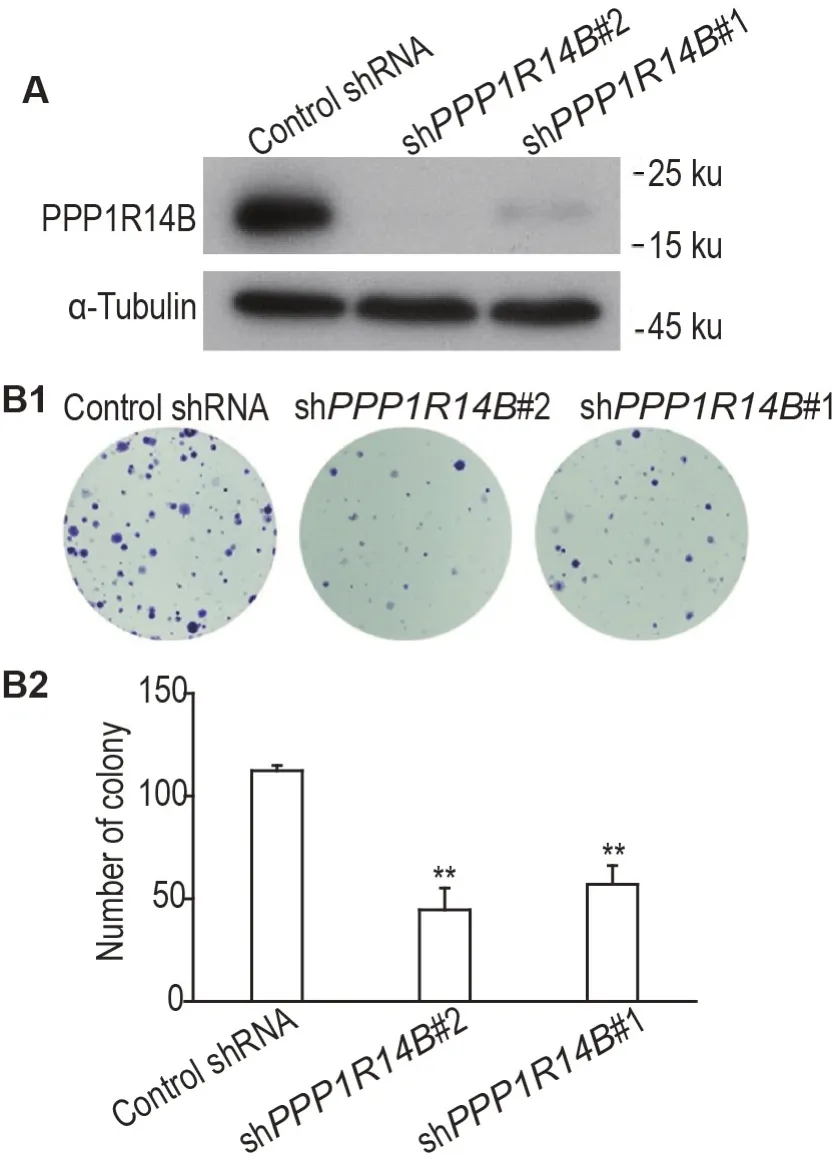
Fig.4 Effect of PPP1R14B knockdown by short-hairpin RNA(shRNA)transfection on cell growth in SK-NBE(2)-M17 cells. Lentiviruses containing control shRNA,shPPP1R14B#1 or #2 were transfected into SK-N-BE(2)-M17 cells,respectively. A:the knockdown efficiency of PPP1R14B detected by Western blotting;B1:number of cell colonies detected by colony formation test;B2 was the quantitative result of B1.±s,n=3.**P<0.01,compared with control shRNA group.
2.5 PPP1R14B 表达水平与NB 恶性程度呈正相关,与预后呈负相关
通过分析NB 数据集GSE49711 发现,在1,2,3 和4 期NB 中PPP1R14B表达逐渐升高(图5A),表明NB 恶性程度越高,PPP1R14B表达水平越高。生存期分析表明,PPP1R14B表达低的患者生存率明显高于其表达高的患者(图5B),表明PPP1R14B表达水平越高,NB 患者预后越差。由此表明,PPP1R14B表达水平与NB 恶性程度呈正相关,与患者预后呈负相关。
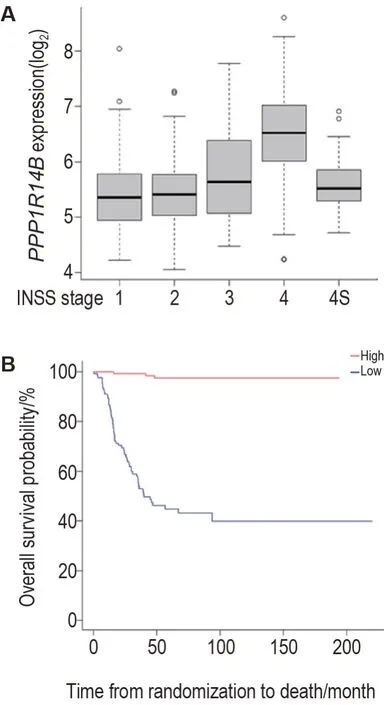
Fig.5 Expression of PPP1R14B in neuroblastoma(NB)and its relationship with prognosis by NB database GSE49711 analysis. A:differential expressions of PPP1R14B in different International Neuroblastoma Staging System(INSS)stages of NB. The stage 4S especially refers to patients under 1 year old.±s,n=121(stage 1),78(stage 2),63(stage 3),183(stage 4),53(stage 4S). B:the relationship between PPP1R14B expression and survival probability of NB patients.n=125.
3 讨论
本研究利用siRNA 技术在NB 细胞SK-N-BE(2)-M17 中敲低PPP1R14B,加入胸苷将细胞阻滞在G1/S 期,接着将细胞释放到G2期,最后采用Time-lapse 活细胞成像技术动态监测敲低PPP1R14B 对细胞有丝分裂进程的影响。结果表明,敲低PPP1R14B可导致SK-N-BE(2)-M17细胞有丝分裂期时间延长。为探究PPP1R14B 调控的有丝分裂期具体阶段,本研究进一步研究发现,敲低PPP1R14B 导致SK-N-BE(2)-M17 细胞有丝分裂前中期时间明显延长,中期时间略有缩短。同时还发现,PPP1R14B 敲低组细胞的染色体不能整齐排列到中期赤道板上,从而导致姐妹染色单体错误分离。由此推测,很可能是敲低PPP1R14B 导致染色体在一定时间内不能整齐排列到赤道板上(中期开始),而细胞又不能很长时间阻滞在前中期,因此姐妹染色单体被迫快速分离即中期时间缩短,最终导致染色体错误分离。
有丝分裂期各时相必须按一定规则进行,各时相时间或长或短均有可能引起有丝分裂期进程紊乱。已知有丝分裂期紊乱往往导致细胞增殖异常。本研究分别将靶向PPP1R14B 的shPPP1R14B#1或#2转染SK-N-BE(2)-M17 细胞稳定敲低PPP1R14B。克隆形成实验结果表明,稳定敲低PPP1R14B 明显抑制SK-N-BE(2)-M17 细胞克隆形成,提示PPP1R14B 在NB 细胞增殖过程发挥重要作用。
据报道,PPP1R14B 在细胞有丝分裂期发生磷酸化[14]。本研究通过NB数据集GSE49711分析发现,PPP1R14B表达水平与NB 恶性程度呈正相关,与患者预后呈负相关。因此推测,PPP1R14B 可能通过调控细胞周期参与NB发生发展。
综上所述,敲低PPP1R14B导致SK-N-BE(2)-M17 细胞有丝分裂期阻滞和生长减慢,PPP1R14B在NB 发生发展中发挥重要作用。PPP1R14B 是NB 细胞有丝分裂的新调控子,有可能是NB 治疗的潜在新靶标。PPP1R14B 是否通过发生磷酸化来调控NB 有丝分裂期、哪种激酶使其发生磷酸化及PPP1R14B 调控NB 细胞有丝分裂期进程的具体分子机制尚待进一步探索。

