丙戊酸和2-己基-4-戊炔酸对乳腺癌易感基因2失活的成纤维细胞放射增敏作用及其机制
韩永涛,蔡祖超,凤志慧
(山东大学齐鲁医学院 1.齐鲁医院药剂科,2.公共卫生学院职业卫生与职业医学系,山东 济南 250000;3.浙江大学医学院附属口腔医院,浙江 杭州 310000)
放射治疗作为目前常用的肿瘤临床治疗手段,常出现放射抗性和全身性不良反应,极大地降低放射治疗功效。放射增敏剂既能增加放射治疗的敏感性,还可有效避免放射治疗过程中产生的全身性不良反应。因此,寻找安全有效的放射增敏剂已成为目前肿瘤放射治疗领域的一项重大课题。
丙戊酸(valproate,VPA)是临床上常用的抗癫痫病药物,2-己基-4-戊炔酸(2-hexyl-4-pentynoic acid,HPTA)为其衍生物之一。VPA 和HPTA 均为组蛋白去乙酰化酶抑制剂,HPTA 的IC50比VPA(348~448 μmol·L-1)低,仅为11~15 μmol·L-1[1-2],提示HPTA 可能是更加高效的VPA 替代物。本课题组在动物和细胞水平研究表明,VPA 和HPTA 对肿瘤组织或细胞具有放射增敏作用[2-10],两者作为DNA 损伤修复抑制剂,可靶向泛素连接酶RFWD3促进重组酶Rad51泛素化,降低Rad51蛋白表达,抑制DNA双链断裂(DNA double strand breaks,DSB)损伤修复的同源重组(homologous recombination,HR)。HR是一种准确无误的DNA损伤修复形式,乳腺癌易感基因1(breast cancer susceptibility gene1,BRCA1)和重组酶Rad51 是HR 修复的关键酶,其功能状态直接影响DNA损伤修复及基因组的稳定性。BRCA2 也可通过与Rad51 特异性结合募集Rad51 到DNA DSB 区 域,调控Rad51 参与HR 修复[11-12]。BRCA1 和BRCA2 可共存于一个蛋白复合物,提示BRCA1 可能调控BRCA2 和Rad51参与HR 的修复[13-14]。虽然BRCA2 在HR 调控中具有重要的作用,但在BRCA2失活的EUFA423 成纤维细胞中也检测到IR所诱导的Rad51焦点形成,表明Rad51 亦参与HR 修复[15]。由此推测,VPA 和HPTA 作为DNA 损伤修复抑制剂,也可能影响BRCA2失活的EUFA423 细胞对放射的敏感性。为此,本研究应用BRCA2双等位基因失活的EUFA423细胞,探讨VPA和HPTA对其放射敏感性的影响,为其应用于临床肿瘤放射治疗提供理论和实验依据。
1 材料与方法
1.1 细胞、主要试剂和仪器
EUFA423 细胞(Dana-Fabar Cancer Institute Alan D D′Andrea 博士馈赠)。彗星实验试剂盒(美国Invitrogen 公司);DAPI 染液(美国Genecopoeia 公司);VPA、HPTA、结晶紫和小鼠抗兔磷酸化组蛋白(phosphorylated histone,γH2AX)抗体(一抗)(美国Sigma公司);小鼠抗兔BRCA1抗体和兔抗小鼠Rad51 抗体(一抗)(美国Santa Cruz 公司);兔抗小鼠53BP1抗体(一抗)(美国GeneTex公司);GAPDH 抗体(一抗)(中国中杉金桥公司);BCA蛋白浓度测定试剂盒和辣根过氧化物酶标记山羊抗小鼠IgG(H+L)抗体(二抗)(美国Thermo Fisher公司);Alex-arFlour488荧光标记鸡抗兔IgG抗体和ALex-arFlour594 荧光标记山羊抗小鼠IgG 抗体(二抗)(美国Molecular Probe 公司)。X-RAD225 OptiMAX 型X 射线辐照仪(美国PXi 公司);IX71型倒置荧光显微镜(日本Olympus公司)。
1.2 细胞克隆形成实验检测细胞增殖能力
取生长状态良好的EUFA423 细胞,按每皿细胞总数2×103接种于p60培养皿中。实验分为电离辐射(ionizing radiation,IR)0(细胞对照),2,4 和6 Gy组,VPA+IR 0,2,4 和6 Gy 组(VPA 预处理24 h 后进行IR)和HPTA+IR 0,2,4 和6 Gy 组(HPTA 预处理24 h 后进行IR),每组3 平行样。VPA 和HPTA浓度分别为500和15 μmol·L-1,选择依据为本课题组前期研究结果[1-4,8-9]。X射线剂量率为2.25 Gy·min-1,2,4和6 Gy照射时间分别为0.89,1.78和2.67 min。IR 处理结束后30 min 各组进行细胞克隆形成实验[8],14 d后观察到明显的细胞克隆形成,计数各组细胞克隆形成数目,并计算细胞克隆形成率。细胞克隆形成率(%)=克隆形成数/接种细胞数×100%。
1.3 中性和碱性彗星实验检测DNA双链断裂损伤
取生长状态良好的EUFA423 细胞,按每皿细胞总数3×104接种于p35 培养皿中,实验分为细胞对照、VPA、HPTA、IR 对照、VPA+IR 和HPTA+IR组,每组3 平行样。IR 剂量为8 Gy,照射时间为3.56 min。VPA 和HPTA 浓度及处理同1.2。照射后0,30 和60 min,各组进行中性和碱性彗星实验[8]。Cometscore 软件分析细胞核拖尾长度和DNA DSB 百分率。DNA DSB 百分率(%)=实验组彗星拖尾长度/细胞对照组彗星拖尾长度×100%。
1.4 免疫荧光实验检测EUFA423 细胞中γH2AX,53BP1,BRCA1和Rad51蛋白焦点形成
取生长状态良好EUFA423 细胞,按每孔细胞总数2×104接种于8 孔载玻片小室内,分组和处理同1.3。IR 处理结束后恢复6 和24 h,免疫荧光法检测EUFA423 细胞中γH2AX,53BP1,BRCA1 和Rad51 蛋 白 焦 点 形 成[2,8],小 鼠 抗 兔γH2AX 和BRCA1 抗体稀释倍数分别为1∶500 和1∶100,兔抗小鼠Rad51 和53BP1 抗体稀释倍数为1∶100 和1∶1000。免疫荧光显微镜下观察并计数500 个细胞中γH2AX,53BP1,BRCA1 和Rad51 蛋白焦点阳性细胞数。每细胞内焦点数>20的细胞为目的蛋白阳性细胞。
1.5 Western印迹法检测EUFA423 细胞中γH2AX,53BP1,BRCA1和Rad51蛋白表达水平
取生长状态良好的EUFA423 细胞,按1.3 分组处理。IR 处理结束后6 h,RIPA 裂解各组细胞,离心取上清液;BCA 法检测蛋白质浓度。每组上样量为60 μg,进行SDS-PAGE 电泳;转印至PVDF膜,BSA 封闭后加入对应的一抗(稀释倍数为γH2AX:1∶500,53BP1:1∶1000,BRCA1:1∶200,Rad51:1∶500,GAPDH:1∶2000),4 ℃孵育过夜;TBST 洗3 次后加入相应二抗(1∶2000),室温孵育1 h;TBST再次洗3次后进行ECL显影。用Image J软件分析蛋白条带积分吸光度,以目标蛋白与内参蛋白积分吸光度比值表示目标蛋白相对表达水平。
1.6 统计学分析
实验结果数据以±s表示,采用SPSS23.0 软件进行多样本比较,多组间比较采用单因素方差分析(one-way ANOVA)或多因素方差分析(two-way ANOVA),组间两两比较采用LSD 法。P<0.05 为差异具有统计学意义。
2 结果
2.1 VPA和HPTA增加EUFA423细胞放射敏感性
细胞克隆形成实验结果(图1)显示,与细胞对照组比较,VPA 和HPTA 对未照射EUFA423 细胞生长均无明显影响;给予EUFA423 细胞IR 4 和6 Gy 处理后,与同剂量IR 对照组比较,VPA+IR 和HPTA+IR 组细胞克隆形成率均显著降低(P<0.05,P<0.01),但VPA+IR 和HPTA+IR 两组之间无明显差异。由此表明,VPA 500 μmol·L-1及其衍生物HPTA 15 μmol·L-1对EUFA423 细胞具有相似的放射增敏作用,也表明较低浓度的HPTA 即能显示显著的放射增敏作用。
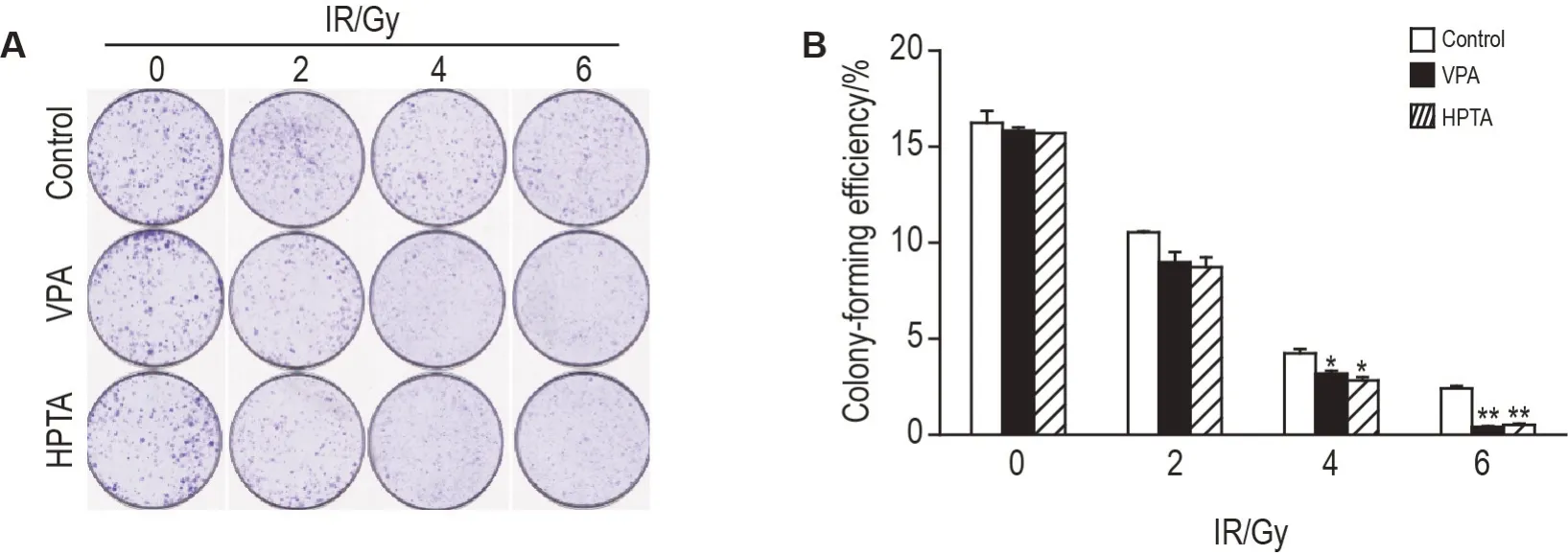
Fig.1 Effect of valproate(VPA)and 2-hexyl-4-pentynoic acid(HPTA)on radiosensitivity in EUFA423 cells by clone formation assay. The cells were divided into ionizing radiation(IR)0(cell control),2,4 and 6 Gy groups,VPA+IR 0,2,4 and 6 Gy groups(cultured with VPA 500 μmol·L-1 for 24 h before IR),and HPTA+IR 0,2,4 and 6 Gy groups(cultured with HPTA 15 μmol·L-1 for 24 h before IR). B was the quantitative analysis result of A. Colony-forming efficiency(%)=number of clone formation/number of inoculated cells×100%.±s,n=3.*P<0.05,**P<0.01,compared with corresponding dose of IR control group.
2.2 VPA和HPTA增加EUFA423细胞中lR诱导的DNA损伤蓄积
碱性彗星实验结果(图2A1)提示,与相应未照射组相比,IR 各组(IR 后0,30 和60 min)胞核拖尾长度显著增加,但随时间延长增加的胞核拖尾长度逐渐缩短,表明IR 可诱导EUFA423 细胞产生明显的DNA DSB 损伤。图2A2 结果显示,与同时间IR对照组相比,照射后0,30 和60 min,VPA+IR 组DNA DSB 百分率均显著增加到IR 对照组的1.41,1.52和1.83倍(P<0.01),HPTA+IR 组增加到1.41,1.54 和1.87 倍(P<0.01)。中性彗星实验也观察到相似的结果(图2B)。
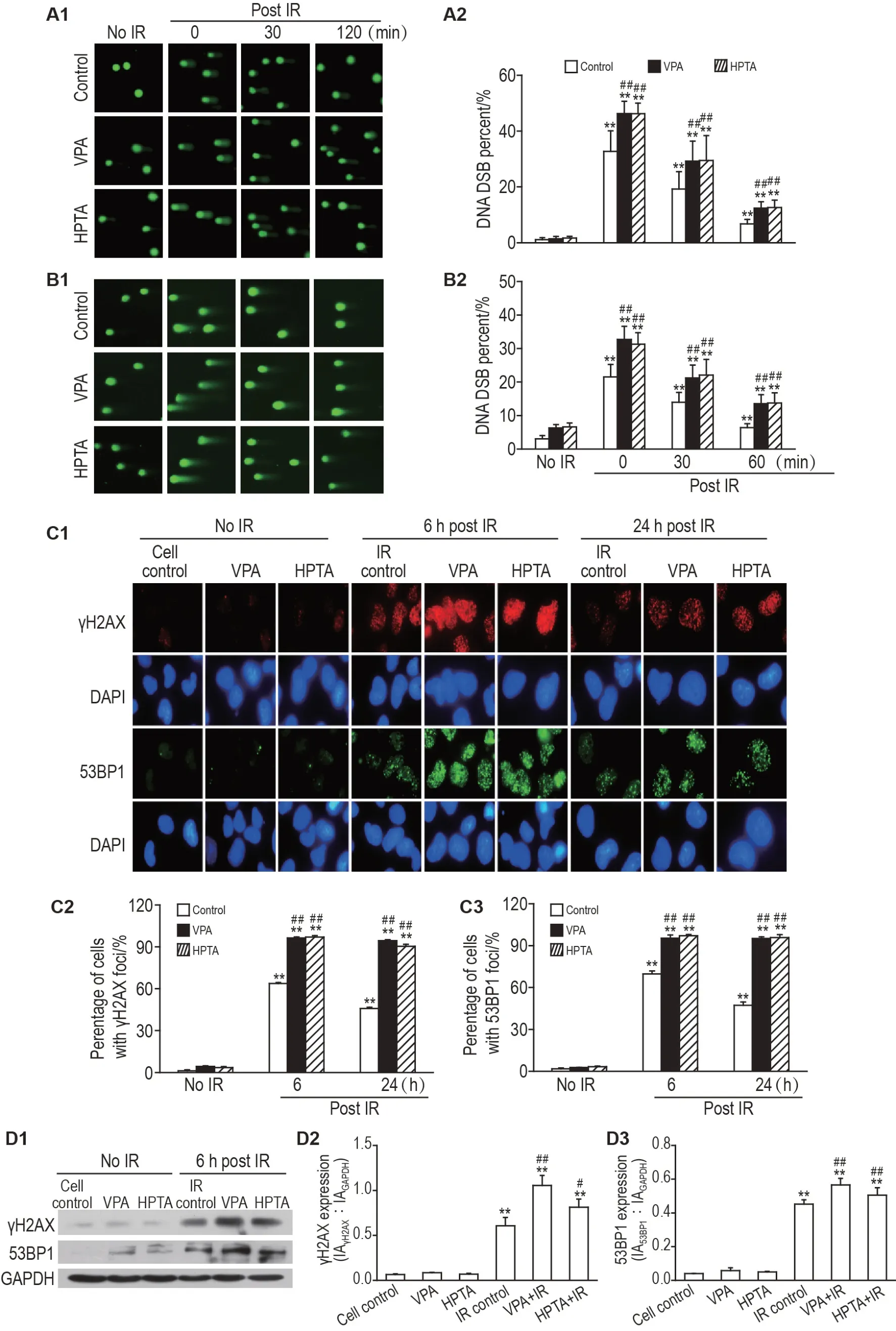
Fig.2 Effect of VPA and HPTA on DNA double strand breaks(DSB)in response to radiation in EUFA423 cells by alkaline comet assay(A),neutral comet assay(B),immunofluorescence assay(C)and Western blotting(D).See Fig.1 for the cell treatment.IR control,VPA+IR and HPTA+IR groups were treated with IR 8 Gy.Percentage of DNA DSB(%)=Comet tailing length in the experimental group/comet tailing length in the cell control group×100%. γH2AX:phosphorylated histone;IA:integrated absorbance. A2 and B2 were the quantitative analysis results of A1(×200)and B1(×200),respectively;C2 and C3 were the quantitative analysis results of C1(×1000);D2 and D3 were the semi-quantitative analysis results of D1.±s,n=3. **P<0.01,compared with corresponding no IR group;#P<0.05,##P<0.01,compared with corresponding IR control group.
细胞免疫荧光实验结果(图2C)显示,与相应未照射组相比,IR 各组IR 后6 和24 h EUFA423 细胞γH2AX 和53BP1 焦点阳性细胞百分率均显著升高(P<0.01)。IR 处理后6 h,VPA+IR 组γH2AX 和53BP1 焦点阳性细胞百分率较IR 对照组增加了32.5% 和25.5%(P<0.01),HPTA+IR 组增加了33.2%和27.2%(P<0.01)。IR 处理后24 h,VPA+IR 和HPTA+IR 组γH2AX 和53BP1 焦点阳性细胞百分率仍显著高于IR对照组(P<0.01)。
Western 印迹实验结果(图2D)显示,IR 结束后6 h,与相应未照射组相比,IR 各组EUFA423 细胞γH2AX 和53BP1 蛋白表达水平均显著增加(P<0.01)。VPA+IR 和HPTA+IR 组EUFA423 细胞γH2AX 蛋白表达水平较IR 对照组分别增加了74.3%(P<0.01)和34.2%(P<0.05),53BP1 蛋白表达水平增加了108.8%和52.7%(P<0.01)。
以上结 果表明,VPA 500 μmol·L-1和HPTA 15 μmol·L-1可增加EUFA423 细胞中IR诱导的DNA损伤蓄积。
2.3 VPA 和HPTA 抑 制EUFA423 细胞Rad51和BRCA1蛋白表达
细胞免疫荧光实验结果(图3A)表明,与相应未照射组相比,IR 各组EUFA423 细胞Rad51 焦点阳性细胞百分率明显增加(P<0.01)。与IR 对照组相比,IR处理后6 h,VPA+IR 和HPTA+IR 组EUFA423 细胞Rad51 焦点阳性细胞百分率分别显著降低了33.1%和35.8%(P<0.01);IR处理后24 h,VPA+IR 和HPTA+IR 组Rad51 焦点阳性细胞百分率亦明显降低(P<0.01)。另一个HR 相关蛋白BRCA1 焦点阳性细胞百分率变化趋势与Rad51相似。
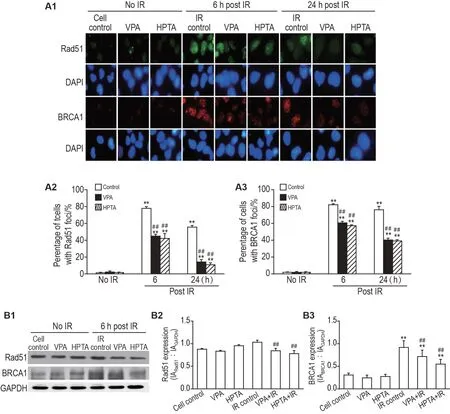
Fig.3 Effect of VPA and HPTA on DNA repair proteins in response to lR-induced DNA DSB in EUFA423 cells by immunofluorescence assay(A)and Western blotting(B). See Fig.2 for the cell treatment. BRCA1:breast cancer susceptibility gene 1. A2 and A3 were the quantitative analysis results of A1(×1000);B2 and B3 were the semi-quantitative analysis results of B1.±s,n=3.**P<0.01,compared with corresponding no IR group;##P<0.01,compared with corresponding IR control group.
Western 印迹实验结果(图3B)显示,IR 结束后6 h,与相应未照射组相比,BRCA1蛋白表达水平明显升高(P<0.01),Rad51 蛋白水平无明显变化;与IR 对照组相比,VPA+IR 和HPTA+IR 组EUFA423细胞Rad51 和BRCA1 蛋白表达水平被显著抑制(P<0.01)。
上述结果提示,VPA 和HPTA 对EUFA423 细胞的放射增敏作用与其抑制DNA 修复蛋白Rad51和BRCA1表达有关。
3 讨论
本课题组前期应用多种肿瘤细胞(如乳腺癌MCF7 和骨肉瘤U2OS 细胞)以及乳腺癌大鼠模型研究表明,VPA及其衍生物HPTA作为DNA损伤修复抑制剂,在细胞和动物水平上可通过抑制HR 机制中关键蛋白BRCA1 和Rad51 活性,对肿瘤组织或细胞发挥放射增敏作用[2-4,8,10]。本研究进一步发现,VPA 和HPTA 还可显著增强BRCA2双等位基因失活EUFA423 成纤维细胞对放射的敏感性,其机制亦与靶向抑制BRCA1 介导的HR 修复通路有关。由此提示,VPA 和HPTA 可下调HR 通路增强BRCA2 功能失活EUFA423 细胞对放射的敏感性。
EUFA423 细胞由Alan D D′Andrea 研究小组首次报道和建立[16],来源于范氏贫血(Fanconi anemia,FA)患者的成纤维细胞。该细胞中BRCA2基因(也称为FANCD1,Fanconi anemia complementation group D1,FA 互补组基因D1)发生双等位基因突变(7691 insAT 和9900 insA)引起移码突变,从而编码C 端截短的BRCA2 蛋白。因此,EUFA423 细胞所携带的BRCA2双等位基因失活,该基因失活可能导致类似于在BRCA1或BRCA2突变家族中观察到的癌症风险。EUFA423 细胞是目前被普遍认可的BRCA2缺失细胞,常用于BRCA2相关功能研究[15-17]。
BRCA2 是HR 修复过程中的关键蛋白,可直接调控Rad51 活性,在DNA DSB 修复中发挥重要作用[11]。研究报道,BRCA2缺失的EUFA423 细胞对放射敏感性增强[17]。本研究结果表明,VPA 和HPTA 可进一步增强其放射敏感性。由此推测,在BRCA2失活的EUFA423 细胞中还存在着不依赖于BRCA2 调控的HR 修复通路,BRCA1 和Rad51可能参与其调控。①本课题组既往研究表明,在哺乳动物细胞中有2条独立的调控Rad51-HR 修复通路,它们分别由BRCA2 和Rad52 所介导[15];换言之,在BRCA2缺失细胞中还存在着Rad52/Rad51调控的HR修复通路,它不依赖于BRCA2[15],提示靶向抑制Rad52 介导HR 修复通路可进一步增强BRCA2缺失细胞对放射的敏感性,导致细胞合成致死性。②本研究结果表明,在应答DNA 损伤反应中,BRCA1 和Rad51 表达增加;VPA 和HPTA 可显著抑制IR 导致增加的BRCA1 和Rad51 表达,提示在BRCA2失活的EUFA423 细胞中BRCA1 和Rad51 还可发挥DNA 损伤修复作用。由上述结果推测,VPA 和HPTA 作为DNA 损伤修复抑制剂,有可能通过BRCA1 抑制Rad52/Rad51 通路,对EUFA423 细胞发挥放射增敏作用,但两者的细胞放射增敏作用是否与其抑制Rad52 功能有关还需深入探讨。此外,本研究结果还需应用另一种BRCA2失活Capan-1 细胞对VPA 和HPTA 放射增敏作用进行验证。
本研究选择的VPA 浓度500 μmol·L-1为临床上治疗癫痫病的血药浓度;同时基于VPA 和HPTA抑制组蛋白去乙酰化酶活性,推算HPTA 用于临床治疗的血药浓度可能为15 μmol·L-1[1-2]。本研究选用VPA 和HPTA 的临床使用剂量,研究结果更具有实际临床意义。同时,在HPTA 浓度远低于VPA 浓度时,即显示出与高浓度VPA 相似的放射增敏作用,提示HPTA 可能是更加高效的VPA 替代物。本研究结果可为VPA 及其衍生物应用于肿瘤患者放射增敏治疗提供一定的理论和实验依据。

