基于TLR4/MyD88/TRAF6信号通路探究电针对类风湿关节炎大鼠滑膜组织的影响
苏俊贤,张誉,王志朝,罗倩,许志强,李凌瑶,郑双双
(甘肃省庆阳市第二人民医院,庆阳 745000)
类风湿关节炎作为常见的慢性关节炎疾病,主要危害关节滑膜引起滑膜炎[1],造成软骨组织的磨损,严重时甚至会导致关节畸形,丧失全部功能[2]。目前该疾病主要通过抗炎药物以及抗风湿药物进行治疗,治疗目的主要在于缓解和减轻关节炎症,保护关节,抑制病情的发展,而新的治疗方法还有待探索[3-4]。类风湿关节炎受多条信号通路的影响,Toll样受体4(Tolllike receptor 4,TLR4)协同髓样分化因子88(myeloid differentiation primary response protein 88,MyD88)以及下游的肿瘤坏死因子受体相关因子6(tumor necrosis factorreceptor associated factor 6,TRAF6)是参与其发生发展的重要影响因子[5]。TLR4属于模式识别受体,常作用于免疫细胞表面,参与识别病原相关分子,在诱导免疫应答和炎症反应中发挥重要作用[6]。MyD88作为Toll样受体信号转导通路的下游蛋白,在传递上游信息后直接诱发疾病[7],同时也可与TRAF6结合,激活致病因子,诱发炎症疾病、过敏性疾病、自身免疫性疾病等[5]。
随着临床医学的进一步发展,近年来电针干预逐渐被医学界认可,并得到广泛的关注和支持[8]。电针能明显改善类风湿关节炎患者的关节疼痛,还能抑制大鼠胶原诱导型关节炎的炎症反应和骨质破坏[9-10]。由于电针干预可以有效改善炎症反应,抑制炎症递质的产生,因此已被应用于治疗类风湿关节炎等多种炎症疾病[11],但其治疗类风湿关节炎时对滑膜组织具有怎样的作用及其作用机制还有待探索[12]。本研究基于TLR4/MyD88/TRAF6信号通路观察电针干预对类风湿关节炎大鼠滑膜组织的影响,探究TLR4/MyD88/TRAF6信号通路作为电针干预新靶点的可能性。
1 材料与方法
1.1 实验动物与分组
实验动物为SPF级健康成年Wistar大鼠[购于北京祥瑞生物制品有限公司,许可证号SYXK(京)2018-0029],体质量(200±10)g,共计48只。大鼠在恒定的温度(25±2)℃,湿度50%~70%和12 h光/12 h暗循环的环境下饲养,随意进食标准饲料和饮水。所有动物实验均在甘肃省庆阳市第二人民医院动物实验中心进行。48只大鼠随机分为健康组、模型组、电针组和电针通路激活组,每组12只。
1.2 主要试剂与仪器
Ⅱ型胶原酶(Gibco公司,货号C21901),血清肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测试剂盒(上海邦景实业有限公司,货号BJ-S965453),白细胞介素-1β(interleukin-1β,IL-1β)ELISA检测试剂盒(上海酶联生物科技有限公司,货号ml112819),增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)ELISA检测试剂盒(上海沪峥生物科技有限公司,货号HS2297),TLR4/MyD88/TRAF6通路激活剂脂多糖(lipopolysaccharide,LPS)(北京百奥莱博生物科技有限公司,货号YT332),TLR4抗体(货号ab13556)、MyD88抗体(货号ab219413)、TRAF6抗体(货号ab40675)和GADPH抗体(货号ab9485)均购于abcam公司。
荧光定量聚合酶链式反应(polymerase chain reaction,PCR)仪(ABI公司,7500),凝胶成像系统(上海生工生物有限公司,HE-120),温热电灸综合治疗仪(苏州好博医疗器械股份有限公司,HB-WZ1)。
1.3 干预方法
模型组、电针组和电针通路激活组大鼠根据参考文献[13-14]提供的方法在背部皮下多点注射1 mL Ⅱ型胶原酶乳制剂(1 g/L,完全弗氏佐剂均匀乳化),此为初次免疫;1周后在大鼠尾根部注射0.2 mL Ⅱ型胶原酶乳制剂以加强免疫,进而构建胶原诱导关节炎模型。健康组注射等量的生理盐水。初次免疫后第14天进行关节炎指数评分[关节部位出现部分炎症反应为0分,小趾关节一并出现炎症反应为1分,小趾延伸至足部均出现炎症为2分,踝关节附近连同下部出现炎症反应为3分,踝关节及以下各部位均呈炎症状态为4分],模型组、电针组和电针通路激活组关节炎指数≥3分时即为构建模型成功[14]。加强免疫后,模型组不做处理,电针组和电针通路激活组用0.25 mm×12 mm针灸专用针刺入大鼠双侧四关穴(“合谷”和“太冲”),针头平刺进入2.5 mm,接通温热电灸综合治疗仪导入电流(“合谷”接正极,“太冲”接负极,同侧穴位连一组电极),强度2 mA,疏密波,频率为5 Hz/15 Hz,治疗20 min。每日1次,持续10 d。电针通路激活组每次电针结束后,腹腔内注射1 mL LPS溶液(1 mg/mL,生理盐水稀释);电针组注射等量的生理盐水。末次干预后进行关节炎指数评分。
1.4 踝关节病理学变化
末次干预后,麻醉大鼠,剖开足部露出踝关节,向关节腔中注射1 mL生理盐水,回抽关节液1 mL冻存备用;取出踝关节,部分用于制备切片样品,剩余部分液氮处理冻存备用。切片样品采用甲醛固定,骨组织脱钙液脱钙处理,常规方法制作切片,厚度5 µm。严格按照染色试剂盒说明书方法染色处理,显微镜下观察病理学变化。
1.5 关节处病理学指标检测
1.5.1 滑膜组织
取出预先冻存的关节液,3 000 r/min离心4 min,取上层液体,按照试剂盒说明书方法检测IL-1β和TNF-α含量。取出部分预先液氮处理的踝关节滑膜组织,研磨成粉,加入组织裂解液充分裂解,静置5 min,取上层清液,根据ELISA试剂盒说明书方法检测PCNA含量。
1.5.2 软骨组织
踝关节处剥离软骨组织,剪碎后加入胰蛋白酶消化1 h,接着加入Ⅱ型胶原酶过夜消化,3 000 r/min离心4 min,弃上清,加入80 µL结合缓冲剂重悬细胞,加入10 µL碘化丙啶和Annexin V-FITC的混合溶液,孵育15 min,加入500 µL结合缓冲剂,充分清洗,上机检测软骨细胞凋亡情况。
1.6 荧光定量PCR检测
取出部分预先液氮处理的踝关节滑膜组织,研磨成粉,用总RNA提取试剂(total RNA extraction reagent,TRIZOL)提取总RNA,利用反转录试剂盒将总RNA反转录为cDNA,上机检测TLR4、MyD88和TRAF6的mRNA表达水平。引物序列由北京擎科生物技术有限公司合成。GAPDH Sense primer为AGTTCAACGGCACAGTCAAG,Antisense primer为TACTCAGCACCAGCATCACC; TLR4 Sense primer为CGCTCTGGCATCATCTTCAT,Antisense primer为CGAGGTAGGTGTTTCTGCTAAG; MyD88 Sense primer为CTTGTTCTCTCTACCGTTGGTC,Antisense primer为CCAAGTACTCGAAACCCATCTC; TRAF6 Sense primer为GCGCTGTGCAAACTACATTT,Antisense primer为AAGGATCGTGAGGCGTATTG。采用2-ΔΔCt法计算TLR4、MyD88和TRAF6的mRNA相对表达量。
1.7 蛋白印迹(Western blot,WB)法检测
取部分大鼠踝关节滑膜组织,液氮处理研磨成粉,加入裂解液,提取蛋白并测定其浓度,变性处理后加入12% SDS-PAGE凝胶孔道,电泳结束后转膜处理,TBST清洗3次,每次10 min,5%脱脂奶粉于水平摇床封闭2 h,加入一抗(TLR4抗体、MyD88抗体、TRAF6抗体、GAPDH抗体,1:500),4 ℃下过夜。弃封闭液,TBST清洗3次,每次10 min。加入二抗(1:1 500),室温下孵育40 min,TBST清洗3次,每次10 min,风干后倒入混合显色液,浸泡1 min,将膜取出,吸干多余液体,置于凝胶成像系统上进行条带灰度分析。
1.8 统计学分析
采用SPSS25.0统计软件进行数据分析。符合正态分布的计量资料用均数±标准差表示,组间差异比较用单因素方差分析,数据两两比较采用SNK-q检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 4组干预前后关节炎指数评分比较
干预前和干预后,模型组、电针组和电针通路激活组关节炎指数评分均显著高于健康组(P<0.05);电针组和电针通路激活组干预后关节炎指数评分较干预前显著降低(P<0.05);电针组和电针通路激活组干预后关节炎指数评分均低于模型组(P<0.05);电针通路激活组干预后关节炎指数评分较电针组显著升高(P<0.05)。详见表1。
表1 4组干预前后关节炎指数评分比较(±s) 单位:分
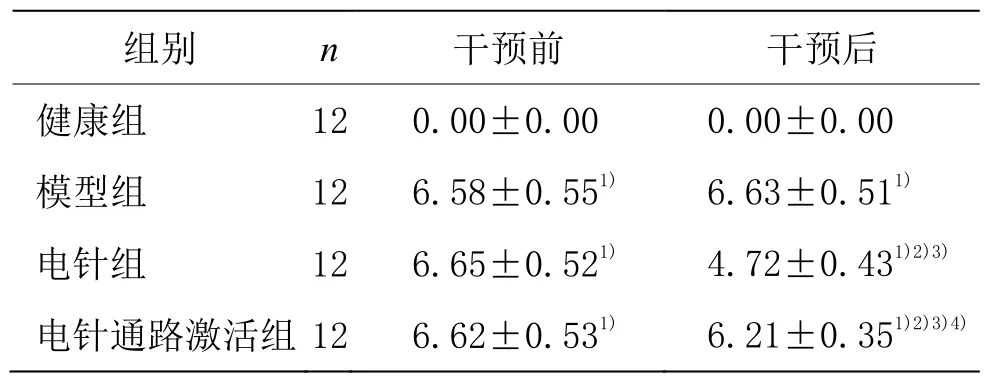
表1 4组干预前后关节炎指数评分比较(±s) 单位:分
注:与健康组比较1)P<0.05;与同组干预前比较2)P<0.05;与模型组比较3)P<0.05;与电针组比较4)P<0.05。
组别 n 干预前 干预后健康组 12 0.00±0.00 0.00±0.00模型组 12 6.58±0.551) 6.63±0.511)电针组 12 6.65±0.521) 4.72±0.431)2)3)电针通路激活组 12 6.62±0.531) 6.21±0.351)2)3)4)
2.2 干预后4组大鼠踝关节病理变化比较
健康组大鼠关节结构完整,无炎性细胞浸润,组织表面光滑平整,滑膜组织及软骨组织细胞排列紧密;模型组大鼠关节结构不完整,出现严重磨损,软骨组织存在大量炎性细胞,滑膜组织增厚明显;电针组大鼠关节结构轻度破坏,破坏程度较模型组轻,有少量炎性细胞浸润,滑膜组织厚度趋于正常;电针通路激活组大鼠关节结构破坏较电针组严重,有部分炎性细胞浸润,滑膜组织增生加重。详见图1。
2.3 4组关节处病理学指标比较
与健康组比较,其余3组关节液中TNF-α、IL-1β和滑膜组织中PCNA的含量以及软骨细胞凋亡率均显著升高(P<0.05);与模型组比较,电针组和电针通路激活组关节液中TNF-α、IL-1β和滑膜组织中PCNA的含量以及软骨细胞凋亡率均显著降低(P<0.05);与电针组比较,电针通路激活组关节液中TNF-α、IL-1β和滑膜组织中PCNA的含量以及软骨细胞凋亡率均显著升高(P<0.05)。详见图2和表2。
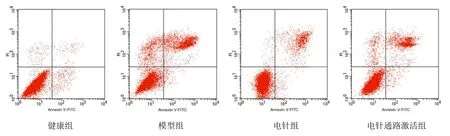
图2 流式细胞仪检测4组软骨细胞凋亡情况图
表2 4组大鼠TNF-α、IL-1β和PCNA含量及软骨细胞凋亡率比较(±s)

表2 4组大鼠TNF-α、IL-1β和PCNA含量及软骨细胞凋亡率比较(±s)
注:与健康组比较1)P<0.05;与模型组比较2)P<0.05;与电针组比较3)P<0.05。
组别 n TNF-α/(pg·mL-1) IL-1β/(ng·mL-1) 健康组 12 64.57±17.81 0.78±0.17 模型组 12 124.62±14.721) 1.89±0.261) 电针组 12 79.65±23.241)2) 1.23±0.311)2) 电针通路激活组 12 107.73±15.411)2)3) 1.58±0.231)2)3) PCNA/(ng·mL-1) 细胞凋亡率(%)4.92±1.74 5.16±1.83 20.78±2.321) 21.04±2.311)8.62±1.411)2) 11.65±4.161)2)14.52±1.841)2)3) 16.72±2.311)2)3)
2.4 4组大鼠滑膜组织TLR4、MyD88和TRAF6的mRNA表达水平比较
模型组大鼠滑膜组织TLR4、MyD88和TRAF6的mRNA表达水平显著高于健康组(P<0.05),电针组大鼠滑膜组织TLR4、MyD88和TRAF6的mRNA表达水平显著低于模型组(P<0.05),电针通路激活组TLR4、MyD88和TRAF6的mRNA表达水平显著高于电针组(P<0.05)。详见表3。
表3 4组大鼠滑膜组织TLR4、MyD88和TRAF6的mRNA表达水平比较(±s)
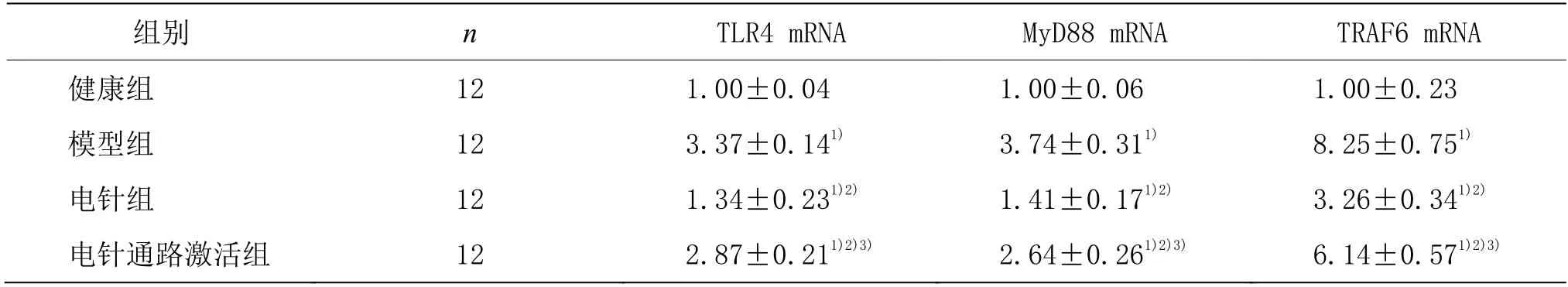
表3 4组大鼠滑膜组织TLR4、MyD88和TRAF6的mRNA表达水平比较(±s)
注:与健康组比较1)P<0.05;与模型组比较2)P<0.05;与电针组比较3)P<0.05。
组别 n TLR4 mRNA MyD88 mRNA TRAF6 mRNA健康组 12 1.00±0.04 1.00±0.06 1.00±0.23模型组 12 3.37±0.141) 3.74±0.311) 8.25±0.751)电针组 12 1.34±0.231)2) 1.41±0.171)2) 3.26±0.341)2)电针通路激活组 12 2.87±0.211)2)3) 2.64±0.261)2)3) 6.14±0.571)2)3)
2.5 4组大鼠滑膜组织TLR4、MyD88和TRAF6的蛋白表达水平比较
模型组大鼠滑膜组织TLR4、MyD88和TRAF6的蛋白表达水平均显著高于健康组(P<0.05),电针组滑膜组织TLR4、MyD88和TRAF6的蛋白表达水平均显著低于模型组(P<0.05),电针通路激活组大鼠滑膜组织TLR4、MyD88和TRAF6的蛋白表达水平显著高于电针组(P<0.05)。详见图3和表4。

图3 4组大鼠滑膜组织TLR4、MyD88和TRAF6的蛋白表达条带图
表4 4组大鼠滑膜组织TLR4、MyD88和TRAF6的蛋白表达水平比较(±s)

表4 4组大鼠滑膜组织TLR4、MyD88和TRAF6的蛋白表达水平比较(±s)
注:与健康组比较1)P<0.05;与模型组比较2)P<0.05;与电针组比较3)P<0.05。
组别 n TLR4/GAPDH MyD88/GAPDH TRAF6/GAPDH健康组 12 0.59±0.09 0.64±0.05 0.67±0.06模型组 12 2.65±0.171) 3.27±0.411) 2.74±0.141)电针组 12 0.74±0.111)2) 1.27±0.241)2) 1.04±0.221)2)电针通路激活组 12 2.06±0.131)2)3) 2.13±0.261)2)3) 1.86±0.231)2)3)
3 讨论
类风湿关节炎属全身性自身免疫疾病,以慢性危害关节为特征,伴有淋巴结肿大、皮下结节,滑膜组织病变残缺等特征,严重时会导致畸形,造成不同程度的残疾。滑膜组织参与了病变的整个过程,近年来滑膜组织病理学不断完善,滑膜病变程度也被认为是判断关节炎病情的重要指标[15-16]。西药与中药在治疗类风湿关节炎时,具有较多的不良反应,使患者难以坚持治疗干预[17],而电针干预具有安全、便利等特点,因此已被广泛应用于类风湿关节炎的治疗中[18]。既往研究显示,四关穴在临床上常作为主穴用于治疗类风湿关节炎,且能有效减轻全膝关节置换术的术后疼痛[19-20]。故本研究以四关穴为针刺腧穴,旨在探讨TLR4、MyD88和TRAF6通路作为电针干预靶点的可能性。
本研究结果显示,健康组大鼠具有正常的关节及滑膜组织,且关节炎指数均为0;模型组出现明显的类风湿关节炎病征;通过电针干预,局部病征消退,关节结构轻度破坏,有少量炎性细胞,滑膜组织增生减轻,关节炎指数显著下降,这说明电针干预可以有效缓解类风湿关节炎。关节炎伴随关节软骨的破坏以及骨质增生,在这一病理过程中细胞因子IL-1β和TNF-α起着至关重要的作用[21]。在患者滑膜及软骨间会有高表达的TNF-α和IL-1β产生,而正常关节间IL-1β和TNF-α的表达量极低,且两者与软骨损伤呈正相关,滑膜组织中PCNA含量的上升也加剧了关节炎的症状[22]。PCNA在类风湿关节炎患者的滑膜组织中表达升高,PCNA又与细胞增殖相关,说明PCNA表达的增高导致滑膜增生,从而使关节破坏,加速病情进展[23]。因此,为进一步验证电针干预对滑膜组织的影响,通过试剂盒检测IL-1β、TNF-α和PCNA含量,发现患病大鼠IL-1β、TNF-α和PCNA含量显著上升,而电针干预后IL-1β、TNF-α和PCNA含量明显下降,这与过往文献[24]报道一致,进一步证明了电针干预对关节炎疾病的作用。
有研究表明,关节炎作为炎症疾病,受多种炎症因子的调控,TLR4、MyD88、TRAF6等蛋白的高表达会激活炎症因子,诱导疾病的发生[5]。本研究结果显示,类风湿关节炎大鼠滑膜组织中TLR4、MyD88和TRAF6的mRNA及蛋白的表达均显著高于健康大鼠,而电针干预后滑膜组织中TLR4、MyD88和TRAF6的mRNA及蛋白的表达均显著降低。为进一步验证电针干预对TLR4/ MyD88/TRAF6通路的调控作用,在电针干预的同时向大鼠腹腔内注射通路激活剂,研究发现加入TLR4/ MyD88/TRAF6通路激活剂后,类风湿关节炎的缓解程度明显降低,且干预后关节炎指数下降程度低于电针组,IL-1β、TNF-α和PCNA含量下降被有效缓解。TLR4、MyD88和TRAF6的mRNA及蛋白表达较电针组显著升高,这说明通路激活剂缓解了电针干预对通路的抑制作用,使关节炎改善变缓,进一步证明电针干预确实通过调节TLR4、MyD88、TRAF6等参与调控类风湿关节炎疾病。
综上所述,电针干预可有效抑制TLR4、MyD88和TRAF6的mRNA和蛋白的表达,改善关节及滑膜组织的结构,抑制炎症因子的表达,促进滑膜组织细胞增生和软骨组织细胞凋亡,降低关节炎指数评分,从而起到缓解类风湿关节炎的作用。可见,电针干预对类风湿关节炎具有很好的干预效果,有很大的应用空间,同时有多个通路参与调控类风湿关节炎,电针干预是否还通过其他通路参与缓解类风湿关节炎,仍需要进一步的实验加以说明。

