耳穴贴压联合中药对重度萎缩性鼻炎患者术后炎性因子水平及生活质量的影响
徐冰,王俊杰
[河南省中医院(河南中医药大学第二附属医院),郑州 450002]
萎缩性鼻炎是一种以鼻腔黏膜萎缩或退行性改变为主要病理表现的炎性疾病[1],发病具有明显的地域性特征,病因可能与环境因素、免疫因素、遗传因素、慢性感染、植物神经失调、脂溶性维生素不足、缺铁性贫血等有关[2]。本病多发于青春期,女性发病明显多于男性,且在经期病情加重,推测可能与内分泌有关[3]。萎缩性鼻炎患者鼻腔黏膜出现萎缩,鼻腔解剖结构改变,鼻腔通气减少,鼻黏膜纤毛功能降低,黏膜表皮发生鳞状化,鼻黏膜生理防御功能降低,大量嗜酸性粒细胞浸润,可诱发鼻窦炎、中耳炎、咽炎等一系列病变[4]。萎缩性鼻炎治疗相当棘手,发病早中期多采用保守治疗,包括补充微量元素、促黏膜生长因子、抗生素等[5]。对于重度患者主要采用手术治疗,其中羟基磷灰石鼻腔填塞术为最常用的手术方法,但仍存在创伤大及术后复发率高的不足。中医药治疗萎缩性鼻炎经长期的临床实践,本研究采用耳穴贴压联合鼻痔散加减治疗将行鼻腔填塞术的重度萎缩性鼻炎患者,观察其对患者术后临床症状、血清及鼻分泌液炎性因子水平、生活质量及并发症情况的影响。
1 临床资料
1.1 一般资料
选择2020年3月至2022年9月河南省中医院收治的72例将行鼻腔填塞术的重度萎缩性鼻炎患者,采用随机数字表法分为两组,观察组和对照组,每组36例。对照组中男9例,女27例;年龄20~50岁,平均(38±2)岁;病程2.5~13.4年,平均(6.30±1.50)年。观察组中男8例,女28例;年龄21~50岁,平均(38±3)岁;病程2.6~13.6年,平均(6.40±1.70)年。两组性别、年龄和病程比较,差异无统计学意义(P>0.05),有可比性。
1.2 诊断标准
1.2.1 西医诊断标准
参照《耳鼻咽喉科全书:鼻科学》[6]中萎缩性鼻炎的诊断标准。鼻腔咽喉干燥,鼻塞,头痛头昏,嗅觉减退,鼻涕带血,鼻分泌物脓臭;影像学检查显示鼻甲缩小,鼻腔增宽,外壁增厚,鼻中隔软骨骨化。
1.2.2 中医辨证标准
参照《中医耳鼻喉科学》[7]中肺气虚寒证的辨证标准。主症为鼻腔增大,恶寒,气短,鼻流清涕;次症为鼻黏膜色淡,易患感冒,恶臭脓痂,咯痰色白,连续喷嚏,语声低;舌淡,舌苔薄白,脉浮。
1.2.3 病情分级标准
参照《耳鼻咽喉科全书:鼻科学》[6]中的病情分级标准。轻度为鼻中隔距中下鼻甲游离缘小于0.5 cm;中度为鼻中隔距中下鼻甲游离缘0.5~1.0 cm;重度为鼻中隔距中下鼻甲游离缘大于1 cm。
1.3 纳入标准
符合上述诊断标准和中医辨证标准;病情分级为重度;年龄20~50岁;患者签署知情同意书。
1.4 排除标准
合并先天鼻腔畸形、急性上呼吸道感染、出血倾向者;合并心、肝、肾功能严重不全者;过敏体质者。
2 治疗方法
两组均予鼻腔填塞术[8-9]。术前5 d采用0.9%氯化钠注射液冲洗鼻腔,每日2次,清除脓痂。手术期间患者取仰卧位,予常规消毒,用1%盐酸丁卡因棉片对鼻黏膜进行表面麻醉,1%利多卡因对唇龈沟黏膜进行浸润麻醉。采用拉钩勾起患者上唇、翻起、固定。手术切口选取上唇龈沟下4 mm,深度达中隔软骨,采用组织剥离器沿中隔软骨向鼻孔方向缓慢钝性分离,充分暴露梨状孔下端,然后缓慢深入鼻底,疏通下鼻道黏膜、后鼻孔、鼻中隔。于鼻内镜下,在切口处填充羟基磷灰石,鼻腔填塞后缝合、加压。
2.1 对照组
术后予石蜡油鼻腔保湿,常规抗感染治疗5 d。鼻喷重组牛碱性成纤维细胞生长因子外用溶液(珠海亿胜生物制药厂,国药准字S10980077,4 200 IU/mL),每日2次,共治疗4周。
2.2 观察组
术后,在对照组治疗基础上予耳穴贴压联合鼻痔散加减治疗。取耳部外鼻、内鼻、肺、内分泌、交感、神门和风溪穴。将王不留行籽用洁净的镊子放置在6 mm×6 mm的胶布中央,患者耳廓局部常规消毒,用粘有王不留行籽的胶布贴于单侧耳部穴位处,嘱患者用拇指与食指放在耳廓两侧自行按压王不留行籽,以患者有酸胀感和微痛以及耳廓充血和发热为宜。每次贴单侧,按压时间持续1~2 min,每日3~5次。3日更换1次耳穴贴,双耳交替贴压。另予鼻痔散加减,药物组成为黄芪20 g,桑白皮、枳实、白芷、辛夷、苍耳子各15 g,桔梗10 g。每日2剂,第1剂水煎后分早晚2次口服,第2剂水煎并灭菌处理后冲鼻腔1次。共治疗4周。
3 治疗效果
3.1 观察指标
3.1.1 鼻腔鼻窦结局测试-20(sino-nasal outcome test-20,SNOT-20)[10]评分
治疗前后分别观察患者流涕、喷嚏、咳嗽、耳闷胀、头晕、耳痛、入睡困难、夜间易醒、疲惫、焦躁等情况,并进行评分,评分越高说明症状越严重。
3.1.2 鼻腔内窥镜评价量表(Lund-Kennedy nasal endoscopy scoring scale,Lund-Kennedy)[11]评分
治疗前后分别观察患者息肉、水肿、分泌物和瘢痕情况。每项分值0~2分,双侧0~16分。分值越高说明症状越严重。
3.1.3 萎缩性鼻炎患者症状及体征评价量表(sign evaluation scale for patients with atrophic rhinitis,SSPAR)[12]评分
包括鼻塞、鼻咽干燥、嗅觉减退、头痛头晕、鼻结痂和鼻黏膜受损,每项分值0~3分。分值越高说明症状越严重。
3.1.4 中医证候积分[7]
主证包括鼻腔增大、恶寒、气短和鼻流清涕,每项分值0~4分;次证包括鼻黏膜色淡、易患感冒、恶臭脓痂、咯痰色白、连续喷嚏、语声低,每项分值为0~2分。分值越高说明症状越严重。
3.1.5 影像学检查指标
治疗前后分别采用CT扫描,检测患者下鼻甲骨的大小,计算下鼻甲左右径(inferior turbinate left and right diameter,ITLRD)和下鼻甲上下径(inferior turbinate upper and lower diameter,ITULD)。
3.1.6 鼻黏液纤毛传输速率(mucociliary transport rate,MTR)
鼻孔前端放置半径2 mm的糖精小颗粒,观察患者感受到甜味所用的时间(t),在患者下鼻甲下段的前端细卷棉子测量放置糖精小颗粒位置至咽后壁的距离(L),MTR=L/t。
3.1.7 实验室检测指标
治疗前后分别采用酶联免疫吸附法检测患者血清和鼻分泌液中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-17(interleukin-17,IL-17)、白细胞介素-33(interleukin-33,IL-33)、免疫球蛋白E(immunoglobulin E,IgE)和嗜酸性粒细胞阳离子蛋白(eosinophil cationic protein,ECP)的水平。
3.1.8 并发症发生情况
试验过程中,观察患者心、肝、肾的功能以及术后并发症的发生情况。
3.2 疗效标准[7]
临床控制:临床自觉症状消失,鼻腔完全畅通,嗅觉恢复。
显效:临床自觉症状明显改善,鼻腔通气功能明显好转,嗅觉恢复。
有效:临床自觉症状改善,鼻腔通气和嗅觉改善。
无效:未达到有效标准。
总有效率=[(总例数-无效例数)/总例数]×100%。
3.3 统计学方法
采用SPSS23.0统计软件进行数据分析和统计。符合正态分布的计量资料用均数±标准差表示,比较采用t检验。计数资料比较采用卡方检验。以P<0.05表示差异具有统计学意义。
3.4 治疗结果
3.4.1 两组临床疗效比较
由表1可见,观察组总有效率为97.2%,高于对照组的80.6%,差异具有统计学意义(P<0.05)。
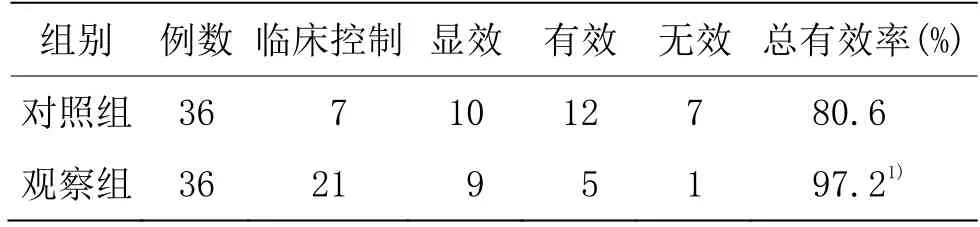
表1 两组临床疗效比较 单位:例
3.4.2 两组治疗前后SNOT-20、Lund-Kennedy和SSPAR评分以及中医证候积分比较
由表2可见,两组治疗前SNOT-20、Lund-Kennedy和SSPAR评分以及中医证候积分比较,差异无统计学意义(P>0.05),具有可比性。两组治疗后SNOT-20、Lund-Kennedy和SSPAR评分以及中医证候积分均低于同组治疗前(P<0.05),且观察组治疗后上述评分均低于对照组(P<0.05)。
表2 两组治疗前后SNOT-20、Lund-Kennedy和SSPAR评分以及中医证候积分比较(±s) 单位:分

表2 两组治疗前后SNOT-20、Lund-Kennedy和SSPAR评分以及中医证候积分比较(±s) 单位:分
注:与同组治疗前比较1)P<0.05;与对照组比较2)P<0.05。
评分 对照组(36例) 观察组(36例)治疗前 治疗后 治疗前 治疗后SNOT-20 37.91±2.47 23.56±2.031) 38.03±2.49 11.18±1.871)2)Lund-Kennedy 6.21±0.53 4.19±0.481) 6.27±0.50 2.15±0.321)2)SSPAR 1.64±0.35 1.15±0.281) 1.67±0.37 0.71±0.211)2)中医证候积分 18.76±2.14 9.30±2.031) 18.02±2.09 3.42±1.911)2)
3.4.3 两组治疗前后ITLRD、ITULD和MTR水平比较
由表3可见,两组治疗前ITLRD、ITULD和MTR水平比较,差异无统计学意义(P>0.05)。两组治疗后ITLRD、ITULD和MTR水平高于同组治疗前(P<0.05),且观察组治疗后ITLRD、ITULD和MTR水平高于对照组(P<0.05)。
表3 两组治疗前后治疗前后lTLRD、lTULD和MTR水平比较(±s)

表3 两组治疗前后治疗前后lTLRD、lTULD和MTR水平比较(±s)
注:与同组治疗前比较1)P<0.05;与对照组比较2)P<0.05。
指标 对照组(36例) 观察组(36例)治疗前 治疗后 治疗前 治疗后ITLRD/mm 6.51±1.03 9.27±1.251) 6.76±1.07 11.52±1.371)2)ITULD/mm 8.43±1.17 12.59±1.451) 8.64±1.19 15.27±1.841)2)MTR/(mm·min-1) 3.06±0.39 5.71±0.471) 3.05±0.40 9.41±0.511)2)
3.4.4 两组治疗前后血清和鼻分泌液中炎性因子水平比较
由表4可见,两组治疗前血清和鼻分泌液中TNF-α、IL-1β、IL-17和IL-33水平比较,差异无统计学意义(P>0.05)。两组治疗后血清和鼻分泌液中TNF-α、IL-1β、IL-17和IL-33水平低于同组治疗前(P<0.05),且观察组治疗后血清和鼻分泌液中TNF-α、IL-1β、IL-17和IL-33水平低于对照组(P<0.05)。
表4 两组治疗前后血清和鼻分泌液中炎性因子水平比较(±s) 单位:µg·L-1

表4 两组治疗前后血清和鼻分泌液中炎性因子水平比较(±s) 单位:µg·L-1
注:与同组治疗前比较1)P<0.05;与对照组比较2)P<0.05。
指标 对照组(36例) 观察组(36例)治疗前 治疗后 治疗前 治疗后血清TNF-α 29.35±5.39 21.09±4.721) 30.01±5.42 11.37±4.631)2)血清IL-1β 23.86±4.81 18.52±4.161) 24.01±4.87 10.21±4.031)2)血清IL-17 472.61±41.28 307.51±35.721) 479.01±42.58 183.73±22.711)2)血清IL-33 19.25±3.48 11.62±3.051) 20.53±3.62 7.65±2.731)2)鼻分泌液TNF-α 16.53±4.71 10.62±3.541) 17.02±4.82 6.82±1.051)2)鼻分泌液IL-1β 11.72±2.81 7.54±1.031) 11.81±2.76 4.52±0.811)2)鼻分泌液IL-17 291.36±21.53 216.20±16.731) 297.25±20.64 113.62±11.421)2)鼻分泌液IL-33 12.63±2.62 8.35±1.951) 12.71±2.71 5.41±1.131)2)
3.4.5 两组治疗前后血清和鼻分泌液中IgE和ECP水平比较
由表5可见,两组治疗前血清和鼻分泌液中IgE和ECP水平比较,差异无统计学意义(P>0.05)。两组治疗后血清和鼻分泌液中IgE和ECP水平低于同组治疗前(P<0.05),且观察组治疗后血清和鼻分泌液中IgE和ECP水平低于对照组(P<0.05)。
表5 两组治疗前后血清和鼻分泌液中lgE和ECP水平比较(±s)

表5 两组治疗前后血清和鼻分泌液中lgE和ECP水平比较(±s)
注:与同组治疗前比较1)P<0.05;与对照组比较2)P<0.05。
指标 对照组(36例) 观察组(36例)治疗前 治疗后 治疗前 治疗后血清IgE/(kU·L-1) 18.63±3.49 11.15±3.081) 18.31±3.56 7.36±2.351)2)血清ECP/(µg·L-1) 10.24±2.51 8.17±2.031) 11.04±2.49 5.39±1.831)2)鼻分泌液IgE/(kU·L-1) 41.54±5.13 27.61±4.171) 40.64±5.21 15.86±3.421)2)鼻分泌液ECP/(µg·L-1) 24.41±3.72 15.63±3.151) 25.16±3.68 8.91±2.291)2)
3.5 两组并发症发生情况比较
试验期间,两组患者均未出现心电图、肝功能、肾功能、血常规、尿常规的明显异常改变。对照组术后出现发热2例、切口肿胀3例、切口感染1例、头昏头痛1例;观察组出现切口肿胀1例且经对症处理后消失。观察组术后并发症发生率为2.8%,低于对照组的19.4%(P<0.05)。
4 讨论
鼻腔具有通气、调温、保湿、清洁、过滤等组织功能,其功能的正常运行与鼻黏膜上皮细胞的结构完整性密切相关[13]。气体进入鼻腔后,被分为层流与湍流,鼻黏膜组织、鼻甲骨膜及鼻骨质发生萎缩,引起鼻腔增宽,气体流经鼻腔时,湍流增大而层流减小,使鼻腔保湿、清洁等功能受到影响,引起鼻腔干燥,进一步加重黏膜及鼻骨萎缩[14]。GARCIA G J等[15]采用流体动力法测试萎缩性鼻炎患者鼻腔水流、气流和热能的传输速度,结果显示萎缩性鼻炎患者鼻腔增大引起的湍流可导致鼻黏膜上皮组织的黏液蒸发增加。萎缩性鼻炎根据病因分为原发性与继发性两种,原发性主要与内分泌功能紊乱、维生素缺乏、植物神经功能传导失常有关,继发性主要与鼻腔手术创伤、鼻外伤、鼻腔局部长期接触刺激气体或有害粉尘、特殊呼吸道传染病等有关[16-17]。萎缩性鼻炎的治疗目的一方面是为鼻黏膜上皮组织营造一个畅通、湿润和清洁的鼻腔内环境,以恢复鼻腔的生理功能,另一方面是减轻鼻黏膜组织的炎性反应,促进纤毛柱状上皮生长,避免鼻黏膜鳞状化[18]。
萎缩性鼻炎归属中医学“鼻槁”范畴[19]。寒邪犯肺,蒸腾不足,津不上承,鼻窍肌膜不得濡养,鼻腔干燥,日久损伤鼻窍,引起鼻黏膜萎缩。鼻痔散出自清代吴世昌的《奇方类编》,由辛夷、桑白皮、栀子、枳实、桔梗、白芷组成,功效温肺散寒、芳香开窍,主治鼻痔。其中辛夷辛温升散,散风寒、通鼻窍,走气分而入肺,助脾胃清阳上行通于鼻,治头面鼻窍之病。桑白皮泻肺平喘,枳实破气消痞。桔梗苦辛平,宣肺祛痰,排脓利窍。白芷辛温,通窍止痛,清灵透发,消痈通脉。加黄芪入肺经,味甘补肺气,性温散肺寒。去栀子,加苍耳子,芳香升散,透达表里,宣通鼻窍,调畅气机,助清气上行以通鼻窍。诸药配合,补、泻、宣、通并用,具有温肺散寒、补益肺气、宣通鼻窍的功效。
“耳者宗脉之所聚也”,耳穴与脏腑经脉紧密相连,各脏腑组织均在耳廓有对应的反应点[20]。耳穴贴压是将药籽(王不留行籽最为常用)固定在耳穴上,经按压、揉搓等方式不断刺激脏腑在耳廓的反射区,以调节脏腑经脉的方法[21]。耳穴贴压在耳穴上可不断产生刺激作用,且具有操作简单、痛苦小和疗效明显的优点,易被患者接受[22]。耳外鼻和内鼻穴可通利鼻窍,调理局部气血运行,增强鼻的通气功能[23]。“肺开窍于鼻”,按压耳肺穴可补肺气,通鼻窍,效力直达病所[24]。耳内分泌穴可活血通经,调节机体代谢[25]。按压耳交感穴可镇静安神及活血止痛。刺激耳神门穴可消炎止痛及宁心安神,促进炎性因子吸收[26]。按压耳风溪穴有祛风除湿、益气固表的作用,提高机体免疫力。
本研究采用SNOT-20、Lund-Kennedy和SSPAR评分以及中医证候积分评价患者的生活质量,观察组治疗后患者临床症状明显减轻,鼻外表现明显缓解,鼻内窥镜检查鼻腔黏膜水肿及瘢痕改变明显改善。表明耳穴贴压联合鼻痔散加减可明显缓解重度萎缩性鼻炎患者术后的临床症状,提高其生活质量。下鼻甲拥有独立的二块骨,呈卷曲状,维持鼻腔外侧壁的结构稳定,对气体进入肺部以前的循环及过滤具有重要作用[27]。萎缩性鼻炎患者鼻解剖结构改变,下鼻甲狭窄,鼻通气量减少,过滤功能减弱。本研究采用CT扫描计算下鼻甲骨孔径,观察组治疗后ITLRD和ITULD增大,提示耳穴贴压联合鼻痔散加减可清除附着于下鼻甲的污秽浊毒,修复受损鼻黏膜,以扩展下鼻甲骨孔径,增加肺的通气功能。鼻黏液纤毛传送有助于黏附在鼻黏膜的病原微生物排出鼻腔,为维持鼻腔正常防御机制的重要条件。MTR反映鼻纤毛传输能力,当MTR降低,电镜下显示短纤毛数量增多,正常纤毛排列紊乱,鼻上皮细胞变性,黏膜萎缩。观察组治疗后患者MTR加快,提示耳穴贴压联合鼻痔散加减可能具有提高鼻纤毛传送能力,缓解鼻黏膜炎症损伤,修复受损鼻腔功能的作用。
炎性因子反复刺激鼻黏膜,为诱发萎缩性鼻炎的重要因素。炎性因子TNF-α为多向性的促炎细胞介质,为介导炎性感染及免疫应答的重要指标。机体感受炎性刺激后,启动免疫应答反应,刺激TNF-α产生,TNF-α可增强中性粒细胞对鼻黏膜的黏附性,引起鼻黏膜细胞凋亡,出现鼻黏膜萎缩[28]。TNF-α亦可刺激IL-1β、IL-17分泌,以趋化炎性因子转移及局部聚集,使鼻黏膜被炎症介质浸润,引起鼻腔炎性反应,导致鼻黏膜组织细胞的受损和凋亡[29]。IL-33可通过促进Th2型趋化因子的释放,诱导IgE分泌[30]。IgE可诱导T细胞分化,释放IL-17、IL-33等炎性介质,加重鼻黏膜损伤[31]。ECP为活化的嗜酸性粒细胞释放的毒性蛋白,在嗜酸性细胞趋化作用下参与嗜酸性粒细胞的趋化、迁移、聚集过程,引起鼻黏膜炎性反应[32]。观察组治疗后患者TNF-α、IL-1β、IL-17、IL-33、IgE和ECP均降低。表明耳穴贴压联合鼻痔散加减可能具有抑制炎性因子分泌,拮抗鼻黏膜组织细胞的非正常凋亡,保护鼻黏膜的作用。
综上所述,在外用西药治疗基础上,耳穴贴压联合鼻痔散加减可有效改善重度萎缩性鼻炎患者术后的临床症状,提高生活质量,降低血清及鼻分泌液中炎性因子水平,减少并发症的发生。

