甘蓝红营养强化型曲奇饼干的制备与消化特性
方晓峰,熊勇,彭盛峰*,刘伟
(1.南昌大学食品科学与资源挖掘全国重点实验室,江西 南昌 330047;2.江西丹霞生物科技股份有限公司,江西 鹰潭 335001)
花青素属于多酚类黄酮类,是许多植物器官(如花、叶和果实等)的呈色物质[1]。游离的花青素性质极不稳定,绝大多数花色苷是以糖苷键形式存在[2]。当pH值为1~3时,其呈现为红色的黄嘌呤阳离子形式,稳定性较好;在pH值为5时,其甲醇伪碱结构易通过水催化的互变异构平衡转化为查尔酮;而当pH值为7~8时,形成了蓝紫色的奎诺碱[3]。研究表明,花色苷具有多种生物活性,如清除自由基、抗氧化、抗炎症等,在辅助抗癌、保护视力、保护心血管、改善大脑功能等方面也具有一定功效[4]。
花色苷稳定性较差,在加工(温度、pH等)、贮藏(氧气、金属离子、光等)和消化(酶等)过程中易发生降解[5-6]。此外,花色苷在水中溶解度较高,而在油脂中不溶。这些因素极大地限制了花色苷在油基功能食品中的应用。为克服花色苷的油不溶性、稳定性差和低生物利用率等问题,需要寻找合适的载体传递和保护花色苷。油包水乳液能有效负载亲水性生物活性物质,提高其稳定性并控制其在胃肠道中的释放,从而提高其生物利用率,在食品领域具有巨大潜力。然而目前关于花色苷油包水乳液在食品基质中应用的报道较少,油包水乳液对花色苷在食品基质中的稳定性和消化特性尚不清晰。
因此,本研究以甘蓝红为花色苷模型化合物,采用油包水(W/O)乳液包埋甘蓝红,考察水相pH、乳化剂种类和质量浓度、油水相比例等因素对甘蓝红与油包水乳液体系的稳定性影响,构建高稳定性的甘蓝红W/O乳液体系。将油包水乳液添加到酥性曲奇饼干中,以甘蓝红水溶液为对照,考察甘蓝红存在形式对饼干中花色苷稳定性的影响,以体外模拟消化模型考察甘蓝红油包水乳液在体外消化过程中的消化特性,分析了油包水乳液对甘蓝红消化稳定性以及生物可接受率的影响,实现了高稳定性花色苷W/O乳液在油基食品中的应用,为水溶性天然色素花色苷扩大应用范围提供了理论基础和技术支撑。
1 材料与方法
1.1 材料与仪器
甘蓝红色素(80%,E=80,江西丹霞生物科技股份公司),金龙鱼玉米油(益海嘉里粮油食品公司),聚甘油聚蓖麻醇酸酯(PGPR)(河南郑州大河食品有限公司动物),甘油单油酸酯(GMO)、甘油单硬脂酸酯(GMS)、磷脂(郑州大河食品科技有限公司),蔗糖脂肪酸酯(日本三菱),OSA淀粉、明胶、乳清分离蛋白(WPI)(上海阿拉丁生物科技股份有限公司),黄油(内蒙古蒙牛奶酪有限公司),奶粉(山西雅士利乳液有限公司),盐(威海市高岛南海盐业有限公司),玉米淀粉(天津市鸿禄食品有限公司),高筋面粉(东莞穗丰粮食集团有限公司),低筋面粉(江苏江南上一道科技股份有限公司),白糖(天虹数科商业股份有限公司),乙醇、正己烷等试剂均为分析纯,购自西陇化工股份有限公司。
ULTRA TURRAX© T18 digital分散机(德国IKA集团),MasterSizer 3000型微米粒度仪(英国Malvern公司),LUMiSizer型稳定分析仪(德国LUM GmbH有限公司),UV-1600PC型紫外分光光度计(上海美谱达公司), SHJ-4A型水浴锅(江苏东鹏仪器制造有限公司),907 Titrando型pH-stat自动电位滴定仪(瑞士万通中国有限公司)。
1.2 实验方法
1.2.1 油包水(W/O)乳液的制备
将甘蓝红色素溶于水中得到甘蓝红色素(质量分数10%)母液,避光密封保存备用。将不同乳化剂溶解于玉米油中得到油相,甘蓝红溶液为水相,70%油相和30%水相用分散机于12 000 r·min-1下高速剪切2 min,得到油包水乳液,避光放入4 ℃冰箱备用。
pH对甘蓝红色素的影响:制备质量分数为0.2%的甘蓝红色素水溶液,在80 ℃下水浴加热2 h,在特定的时间点(0、15、 30、 60、90、120 min)取样,使用紫外分光光度计在520 nm下测定溶液的吸光度值,并使用校准曲线计算出花色苷浓度。
乳化剂的筛选:使用2.0%不同种常用乳化剂(PGPR、GMO、GMS、蔗糖脂肪酸酯、磷脂)构建甘蓝红W/O乳液。通过对乳液离心稳定性的评价筛选出合适的乳化剂。
乳化剂浓度的筛选:将上述所筛选出的最适乳化剂按不同比例(0.5%、1.0%、2.0%、3.0%)添加入乳液中,按上述方式评价乳液稳定性。采用粒径作为优化乳液体系的另一指标。
油水相比例的筛选:基于上述乳化剂的种类与浓度的确定,采用不同的油水相比例(5:5、6:4、7:3、8:2、9:1,V/V)制备乳液,采用离心稳定性和粒径作为评价乳液体系的指标。
内水相表面活性剂对W/O乳液氧化稳定性和甘蓝红稳定性的影响:将常用的WPI、OSa淀粉和明胶以W/O乳液的0.2% 的比例加入水相,通过初级氧化考察不同添加剂对甘蓝红W/O乳液的氧化稳定性的影响,同时通过花色苷的保留率考察其对乳液中甘蓝红的稳定性影响。
1.2.2 离心稳定性
离心稳定性的测定方法主要参考Liu等[7]的实验方法,采用LUMisizer稳定性分析仪测定甘蓝红油包水(W/O)乳液的物理稳定性。测定参数如下:样品量为0.4 mL;转速为3 600 r·min-1;时间为3 600 s;时间间隔为10 s;温度为25 ℃。为了评估加速离心稳定性,选用不稳定指数作为评价指标。不稳定指数是样品不稳定性的数值表示,其范围为0(稳定)~1(不稳定)。
1.2.3 粒径测量
使用马尔文微米粒度仪对W/O乳液的粒径进行测量。将所制备的W/O乳液用正十二烷稀释到合适的倍数,取1 mL样品置于测试皿中进行粒径分布的测量。每个样品至少测定3次取平均值。
1.2.4 初级氧化稳定性(POV值)
油脂氧化的初级氧化产物氢过氧化物用POV值表征[8]。测定方法参照文献[9]的方法。取0.3 mL乳液与1.5 mL的异辛烷/异丙醇(3:1,V/V)混匀,充分震荡,1 000g室温下离心2 min。取0.2 mL离心后的有机层与2.8 mL甲醇/正丁醇(2:1,V/V)混合,再加入15 μL NH4SCN(3.94 mol·L-1)和 15 μL Fe2+(现用现配)混合,避光条件下反应20 min后,于510 nm 波长下测定吸光值,用过氧化氢异丙苯制作标准曲线计算POV值。
1.2.5 花色苷保留率测量
取0.100 0 g W/O乳液样品与10 mL离心管中,用移液管加入2.5 mL乙醇和3 mL 正己烷,涡旋30 s,加入2.5 mL 蒸馏水,涡旋1 min后静置,除去上层有机层,将水溶液转移至25 mL容量瓶中,用缓冲液/乙醇(1:1)定容,后6 000 r·min-1离心3 min,在520和700 nm下测定吸光度值,每个样品测3次。
总花色苷质量分数w的计算公式如下:
(1)
式中:A为测量波长为520~700 nm时的吸光度;M1为矢车菊-3-葡萄糖苷的摩尔质量,M1=449.2 g·mol-1;f为稀释倍数;ε为矢车菊-3-葡萄糖苷的摩尔消光系数,ε=26 900 L·mol-1·cm-1;l为光路长,单位为cm;V1为缓冲液体积,单位为mL;m1为样品的质量,单位为g。试验结果以平行测定的算术平均值为准。在重复性条件下获得的2次独立测定结果的绝对差值不大于其算数平均值的5%。
1.2.6 甘蓝红营养强化型曲奇饼干的制备
甘蓝红营养强化型曲奇饼干的制备工艺如下所示:
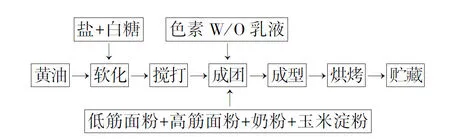
工艺要点如下。
1)软化:称好的黄油需要适度软化,使得空气饱含其中。
2)搅打:软化后的黄油需重复搅打,搅打至体积膨胀、色泽转浅白色。
3)烘焙:烤箱设置上下火170 ℃, 烘焙15 min。
1.2.7 甘蓝红添加形式对饼干中花色苷稳定性的影响
饼干样品的制备:甘蓝红油包水饼干样品的制备方式与1.2.6节中的方式一致,黄油与W/O乳液的比例为5:4。阳性对照组饼干的制备是将W/O乳液的各组分在不混合的情况下直接加入到面团中。
烘焙过程中花色苷的保留率:将烘焙前后的饼干称重,采用1.2.5节中花色苷保留率的方法测量烘焙过程中不同样品饼干中的花色苷保留率。
花色苷的贮藏稳定性:将制备好的不同饼干样品,常温遮光密封保存,在固定时间点(1、7、14、21、28 d)测量样品中花色苷的保留率。测量方法与上述一致。所有样品至少测试3组平行并报告平均值。
1.2.8 甘蓝红营养强化型饼干的消化特性
参考Brodkorb等[10]的方法并作略微修改,利用模拟胃肠道模型开展其体外消化实验。
口腔:将饼干与口腔液(含3 mg·mL-1黏液素)按1:1比例混合,调节pH至6.8,孵育10 min。
胃部:将口腔消化液与胃液(含3.2 mg·mL-1胃蛋白酶)按1:1比例混合,调节pH至2.5,孵育2 h。
小肠:在胃消化食糜(30 mL)中加入肠液、胆盐,再调节pH至接近7.0,加入脂肪酶,通过pH恒定滴定仪恒定pH至7.0。
1)游离脂肪酸消化速率。通过pH恒定滴定仪的NaOH滴定量表征其游离脂肪酸消化速率,由式(2)计算:
vFFA=100%×(V2×c×M2)/2m2
(2)
式中:vFFA为游离脂肪酸消化速率;V2为中和脂质分解出的酸所需的滴定液的体积;c为氢氧化钠的浓度;M2为所使用的油的相对分子质量;m2为消化系统中油脂的质量。
2)稳定性和生物可接受率。体外消化模型结束后,将肠液以12 000 r·min-1离心30 min,收集中间胶束相。将提取出的含甘蓝红色素的溶液用紫外可见分光光度计在520 nm处检测分析。使用标准曲线确定甘蓝红色素质量浓度。生物可接受率B*、稳定性S*分别可由式(3)、式(4)计算:
B*=100 ×C1/C2
(3)
S*=100 ×C2/C0
(4)
式中:C1表示混合胶束层中甘蓝红的质量浓度;C0表示在初饼干中甘蓝红的质量浓度;C2表示在总的小肠消化结后消化液中甘蓝红的质量浓度。
1.2.9 消化过程中花色苷的降解
消化步骤与1.2.8节中步骤一致,在口腔末期、胃期(30、60、90、120 min)和肠期(30、60、90、120 min)取样,测定花色苷的含量。测试方法与1.2.5节一致。
1.3 数据统计与分析
数据处理采用SPSS 17.0对数据进行统计学分析,结果表示为平均值±标准偏差,不同字母表示指标之间的显著差异性(P<0.05)。
2 结果与分析
2.1 甘蓝红W/O乳液的制备
以甘蓝红W/O乳液粒径、离心稳定性以及甘蓝红稳定性为指标,考察甘蓝红W/O乳液制备过程中,内水相pH、乳化剂种类及浓度、内水相表面活性剂组成等因素对其的影响。不同pH下甘蓝红色素的热稳定性(80 ℃)见图1,图中Rr表示甘蓝红色素的保留率,t1为甘蓝红色素的加热时间。

t1/min图1 不同pH下甘蓝红色素的热稳定性(80 ℃)Fig.1 Thermal stability of cabbage red pigment at different pH (80 ℃)
内水相pH:由图1可知,在80 ℃下,当甘蓝红色素水溶液pH为3时表现出最好的稳定性。随着pH值的降低,甘蓝红色素的稳定性也随之提升。在加热2 h的条件下,pH 值 ≥ 4的甘蓝红色素水溶液中花色苷的保留率都低于60%,而当其pH值为3时,保留率超过80%,且在15 min时,花色苷的降解接近平衡。这可能与花色苷在不同pH下存在形式密切相关[11]。当乳液pH约为3或更低时,黄嘌呤阳离子占主导地位。而随着pH的升高,黄嘌呤阳离子2号位的水合反应与其酸性羟基相关的质子转移反应之间发生了动力学与热力学竞争。第一反应生成无色的甲醇伪碱,它能开环形成黄色的反查耳酮,而第二反应生成更多的紫色醌基。当pH在6~7之间时,醌类碱的进一步去质子化可以形成更蓝的共振稳定的醌类阴离子,低pH条件下的花色苷存在形式更加稳定。
乳化剂种类、浓度及油水相比例:用LUMiSizer稳定分析仪考察不同乳化剂对W/O乳液离心稳定性的影响。由表1可知,不同种乳化剂对W/O乳液体系稳定性影响表现差异极大,PGPR的稳定效果最佳,不稳定系数仅为0.047,磷脂、GMO、GMS和蔗糖酯构建的乳液都极不稳定,不稳定系数都大于0.24。这可能是由于PGPR能够降低界面张力与油水黏度比,从而稳定乳液体系[12],PGPR稳定的样品具有较好的离心稳定性[13]。这种现象可以归因于初始乳液的液滴直径较小,在样品离心过程中具有很强的抗聚集性。这些结果表明,通过PGPR稳定的甘蓝红W/O乳液稳定性最佳。基于此,采用不同浓度的PGPR构建W/O乳液,由表2可知,所有样品的不稳定指数均呈较低的趋势(<0.10),结果表明,样品具有较好的离心稳定性。用动态散射光纳米粒度仪测定乳液的粒径分布,如表2所示,随着乳化剂浓度的提高,甘蓝红W/O乳液的粒径随之降低。粒径减小,表面张力增加,重力作用降低,增加其稳定性[14]。根据食品添加剂国标GB 2760—2014,PGPR允许使用的最大质量分数为1.0%,参考离心稳定性与粒径,1.0% PGPR已具有极强稳定性和较小粒径,因此最终选择PGPR的质量分数为1.0%。如表2所示,不同油水相比例的样品不稳定指数都较低(<0.12),5:5和6:4的油水比例的乳液样品不稳定系数相近,无显著性差异(P>0.05),在0.12左右。而7:3、8:2和9:1的油水比例的乳液样品不稳定系数也相近(<0.08),无显著性差异(P>0.05),但明显低于前者。因此,我们可以认为高油水比的样品更加稳定。表2中,样品的油水比例与粒径分布呈负相关,油水相比例越高,W/O乳液的粒径越小。较小的粒径也有助于增强乳液体系的稳定,延长货架期。

表1 乳化剂种类对甘蓝红W/O乳液离心稳定性影响Tab.1 Effect of emulsifier types on centrifugal stability of cabbage red W/O emulsion

表2 PGPR质量分数和油水相比例对甘蓝红W/O乳液粒径及离心稳定性影响Tab.2 Effects of PGPR mass fraction and oil-water phase ratio on particle size and centrifugal stability of cabbage red W/O emulsion
内水相表面活性剂:将添加不同种表面活性剂的甘蓝红W/O乳液样品置于紫外灯下加速氧化,通过测定其过氧化值(peroxide value,POV)来表征初级氧化产物的形成(图2)。用POV表示乳液的初级氧化,t2表示紫外光光照时间。如图2所示,添加了明胶、OSa淀粉的和未添加表面活性剂的对照组的POV趋势相似:POV在最初的几天内增加,在之后的时间里缓慢降低,但是添加了明胶的乳液样品的POV到达顶点的时间明显提前。而添加了WPI的乳液样品的POV在一周内不断增加,可能是还未达到顶点,POV还未出现降低的趋势,也有可能顶点出现在4~7 d之间未被及时检测。以上结果表明,所有的样品都发生了氧化反应,但存在一定的差异。明胶的加入,加速了甘蓝红W/O乳液的脂质氧化,这可能与油水界面中脂质过氧化氢与过渡金属离子的反应有关。研究表明,脂质过氧化氢被过渡金属等促氧化剂分解为高活性自由基是促进脂质氧化的主要途径[15]。而明胶作为胶原蛋白的变性产物,本身含有如Ca2+、Fe2+等二价金属离子,这些离子可以与明胶多肽上的羧酸基团形成离子键[16]。脂质过氧化氢是具有表面活性的化合物,因此能够在乳化液滴的油水界面上积累[17-18]。而WPI的加入却延缓了样品中脂质氧化的速率,这可能与巯基和芳香氨基酸清除自由基以及过渡金属螯合作用[19]有关。

t2/h图2 不同表面活性剂对甘蓝红W/O乳液初级氧化的影响Fig.2 Effects of different surfactants on primary oxidation of cabbage red W/O emulsion;
同时也测定了不同乳液样品中花色苷的保留率,如图3所示,所有样品中的总花色苷均在贮藏过程中逐渐减少。在一周后,对照组和添加了明胶与OSa淀粉的样品中总花色苷保留率接近(<30%),加入了明胶的样品花色苷保留率最低,仅为23%。而加入了WPI的样品在一周后的花色苷保留率仍能达到63%,远高于其他3组样品。这可能与W/O乳液的脂质氧化有关。WPI在油水界面上与脂质氢过氧化物发生反应,减少了内水相花色苷与脂质氢过氧化物的接触,从而降低了花色苷的降解。

t2/h图3 不同表面活性剂对乳液中花色苷稳定性的影响Fig.3 Effects of different surfactants on the stability of anthocyanins in emulsion
2.2 甘蓝红W/O乳液营养强化型曲奇饼干的制备
由图4可知,将甘蓝红以不同方式(W/O乳液和水溶液形式)添加到饼干面团中,在烤箱中上下火170 ℃烘焙15 min 后,以W/O乳液负载的甘蓝红强化型酥性饼干中花色苷的保留率为76.16%,显著高于各组分独立以水溶液形式添加入面团中的阳性对照组的50.23%。烘焙前后的面团与饼干表观变化也证实了这一点,W/O乳液饼干的颜色明显比阳性对照组的更深。这些结果表明以W/O乳液形式添加入饼干的花色苷有着更强的稳定性。这可能是由于W/O乳液的外脂相层锁住了内水相,从而减缓了内水相中水分的挥发与花色苷的降解。而直接以水溶液形式添加入面团中的花色苷随着水分的迁移与外界直接接触的机会大大增加,使得花色苷极易降解。同时,较为稳定的低pH内水相环境也使得花色苷的存在形式不会有太大的改变,增强花色苷在烘焙过程中的稳定性。

图4 甘蓝红不同添加形式的饼干烘焙前后表观变化和饼干中花色苷的保留率Fig.4 Biscuit samples with different cabbage red addition forms before and after baking and the retention rate of anthocyanins in biscuits
饼干中花色苷的贮藏稳定性直接影响产品的品质与风味。由图5可知,W/O乳液饼干和花色苷以水溶液形式直接添加入面团的阳性对照组饼干在3个月的贮藏过程中花色苷保留率均有缓慢下降。两者的花色苷保留率在84 d时分别为92.53%和90.16%,W/O乳液饼干中的花色苷保留率明显更高。W/O乳液的包埋效果极大地减少了花色苷与外部环境的接触,使得花色苷有更好的稳定性。

ts/d图5 不同贮藏时间ts时饼干中花色苷的保留率Rr变化Fig.5 Changes in the retention rate(Rr) of anthocyanins in biscuits under different storage times(ts)
2.3 甘蓝红W/O乳液营养强化型曲奇饼干消化特性
通过索氏提取法测定饼干样品中的油脂含量,W/O乳液饼干和空白饼干的油含量相似,约为35%。饼干消化样品的初始油含量为2.0%,脂肪分子(甘油三酯)进入体内之后,在脂肪酶和胆汁等辅助成分作用下分解,从而导致体系pH降低。在消化过程中,可以通过维持体系的酸碱环境为中性,计算出样品中脂肪水解释放出的游离脂肪酸的量。结果如图6所示,在前30 min内,油脂的释放率最快,之后呈现缓慢增加的趋势;W/O乳液饼干的NaOH消耗量和FFA释放率分别为2.54 mL和90.33%,水溶液饼干的NaOH消耗量和FFA释放率分别为2.49 mL和88.44%,两者的脂质消化速率相近,并无明显差异,这说明花色苷在较低浓度下,添加方式不会影响游离脂肪酸的消化过程。
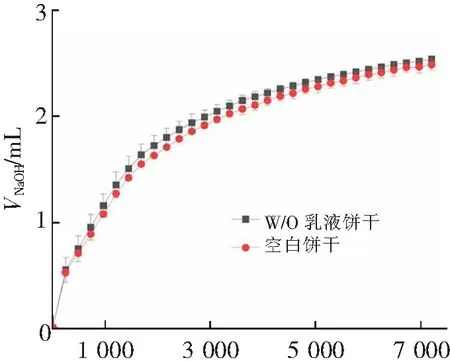
t/s(a) NaOH的消耗量
在口腔消化前,将甘蓝红色素溶于空白饼干消化样品中形成对照组,考察甘蓝红色素不同添加形式在体外消化过程中的消化特性。如图7所示,W/O乳液饼干中甘蓝红的稳定性与生物可接受率分别为40.45%和62.13%,而空白对照饼干中则为25.57%和51.34%,与文献[20]的研究结果相似,直接食用的花色苷的生物可接受率不高,通过乳液包埋后甘蓝红的生物利用率和稳定性明显提升,这归因于甘蓝红在模拟消化过程中稳定性的增加,内水相中的抗氧化剂有助于降低花色苷在消化过程中对氧化降解的敏感性,同时乳液的包埋也减缓了花色苷氧化降解的发生,乳化也可以提高消化产物在混合胶束中的增溶[21]。此外,测量甘蓝红色素在消化各阶段不同时间点(口腔末期、胃期30 min、胃期60 min、胃消化末期、肠期30 min、肠期60 min和肠消化末期)的保留率变化,如图8所示,图中td为体化消化时间。与文献[22]的研究相似,甘蓝红的降解主要发生在肠消化阶段,在口腔与酸性胃消化阶段保持稳定。乳液的包埋以及内水相中抗氧化剂的添加和pH的调节,可明显提升甘蓝红在肠消化过程中稳定性,延缓甘蓝红的降解。
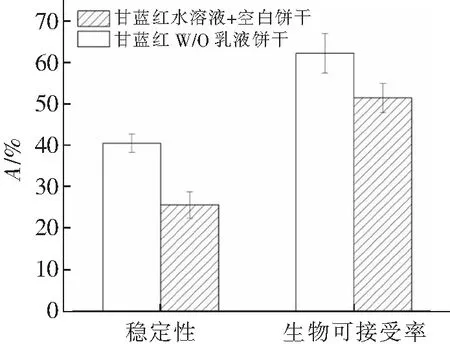
图7 花色苷的稳定性和生物可接受率Fig.7 Stability and bioaccessibility of anthocyanins
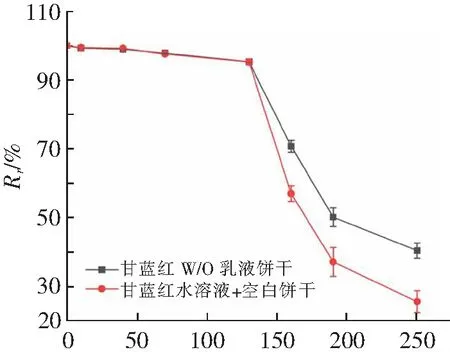
td/min图8 消化过程中的花色苷保留率变化Fig.8 Changes of anthocyanin retention during in vitro digestion
3 结论
总之,本文研究了W/O乳液内水相的pH大小和抗氧化剂种类以及乳化剂浓度等乳液制备参数对甘蓝红和W/O乳液整体稳定性的影响。基于高稳定性甘蓝红W/O乳液的构建,并将其应用于固体油基食品饼干中,考察不同甘蓝红添加方式对饼干中紫甘蓝稳定性和消化特性的影响。 结果表明,pH越低,甘蓝红的稳定性越高,这与甘蓝红在不同pH条件下的存在形式有关。乳液制备参数直接影响紫甘蓝W/O乳液的稳定性,通过离心稳定性与粒径的测量,最终选择1%的PGPR作为乳化剂,油水比例为8:2。WPI的添加延缓了乳液中脂质氧化的速率。以W/O乳液包埋形式添加的甘蓝红饼干的花色苷稳定性明显优于以水溶性形式直接添加的对照组饼干,乳液的保护效果明显。在消化过程中通过乳液包埋后甘蓝红的生物利用率和稳定性显著提升。本研究中开发的花色苷营养强化型饼干,为水溶性天然色素花色苷扩大应用范围、提高稳定性和生物可接受率,进而为实现社会生产实践提供一定的理论基础和实验参考。

