菘蓝碳氮代谢与基质C/N对氮处理的动态响应
崔英静 孙莉琼 师建玲 李晓帆 鲍婷婷 王峰峰唐晓清, 王康才
(1南京农业大学中药研究所,江苏 南京 210095;2苏州启帆农业科技有限公司,江苏 苏州 212000)
菘蓝(IsatisindigoticaFort.)为十字花科菘蓝属两年生草本植物,叶、根均可入药,分别为大青叶与板蓝根,大青叶具有清热解毒、凉血消斑的功效,板蓝根具有清热解毒、凉血利咽的功效[1],其药典指标成分分别为靛玉红、(R,S) -告依春。菘蓝叶内的靛蓝是重要的天然染料,广泛应用于食品、医药和印染工业。靛蓝、靛玉红为吲哚类生物碱,(R,S) -告依春是含有氮杂环结构的生物碱,这三种成分均是含氮化合物,其含量受外源氮素的影响。氮是植物生长所必需的大量元素之一,对植物体内的碳氮代谢起着至关重要的作用。已有研究表明,施加氮素的用量、形态及相应的配比显著影响菘蓝叶、根指标成分的累积及产量[2-4],靛蓝、靛玉红[5]和(R,S) -告依春[6]含量随着氮素浓度的增加呈现先增加后减少的变化趋势。但前人研究多注重施氮后单一时间点的变化,缺少施氮后菘蓝碳氮代谢关键酶、基因表达量及有关化合物的动态变化过程研究。
土壤有机质对改良土壤耕性、调节土壤结构具有重要作用。土壤全氮是指土壤中所有形式的有机氮与无机氮的综合,是为植物生长提供有效氮的库。土壤C/N 是衡量土壤营养平衡的重要指标,其值大小影响土壤的氮循环[7]。植物吸收氮素后,其自身各部位C/N同时变化,不同器官的C/N 反映了其对生存环境的适应,一般植物向低C/N 变化[8]。植物碳氮代谢受多个基因的影响[9-11],因碳氮代谢的复杂性,影响碳氮代谢的基因具有多种生理生化功能[12-13],其中,BIG基因的突变体会导致拟南芥C/N 增大,进而调节植物碳氮平衡[14]。鉴于此,本试验通过外源施加氮素改变基质C/N,影响菘蓝吸收氮素的性能,在此过程中,测定基质与菘蓝叶、根的碳素与氮素含量,计算基质与菘蓝叶、根C/N;测定碳代谢关键酶磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxylase,PEPC)和蔗糖磷酸合成酶(sucrose phosphate synthase,SPS)与氮代谢关键酶硝酸还原酶(nitrate reductase,NR)、谷氨酰胺合成酶(glutamine synthetase,GS)、谷氨酸合成酶(glutamate synthetase,GOGAT)的活性及其基因表达量,揭示基质C/N 变化后菘蓝碳、氮代谢的动态变化过程;最后测定菘蓝叶、根指标成分在施氮后的含量变化,分析施氮后菘蓝叶、根的适宜采收时间,以期为菘蓝氮营养的高效利用提供参考。
1 材料与方法
1.1 试验材料
以河北居群的菘蓝种子(角果)为试验材料,经南京农业大学唐晓清教授鉴定为十字花科植物菘蓝(IsatisindigoticaFort.)。
1.2 试验设计
于2022 年4 月播种,避雨盆栽,每盆定植4 株。栽培基质为蛭石∶珍珠岩(2∶1),基本营养液采用霍格兰营养液配方,pH 值为6.0;KH2PO4提供菘蓝生长所需的磷、钾。出苗30 d后,设置4组处理,每组20盆,处理液分别为0、5、15、20 g·L-1的CO(NH2)2,记为CK、N1、N2、N3,隔4 d处理一次,每盆施加处理液100 mL,共处理4次。在4次处理结束后12、28、44、64 d取样。每次取样,取3盆12株菘蓝叶、根的相同部位,约10 g鲜样,混合后剪碎并于-80 ℃冰箱保存,用于测定碳氮代谢关键酶的活性及其基因表达量。收取整株菘蓝,叶、根分开,108 ℃杀青,60 ℃烘干至恒重,粉碎过60目筛,干燥保存,用于测定靛蓝、靛玉红和碳氮元素含量。将已收取菘蓝的3 盆基质充分混匀,取适量基质(干燥前约10 g),用于测定其碳氮元素含量。
1.3 测定项目与方法
1.3.1 基质、菘蓝碳和氮元素含量的测定 采用重铬酸钾外加热法[15]测定基质和植物碳元素含量,采用F30800090 CN 802碳氮分析仪(意大利VELP Scientifica Srl公司)对全氮含量进行分析,计算基质及菘蓝叶、根的C/N。每个处理重复3次。
1.3.2 碳氮代谢关键酶活性的测定 使用BC2195磷酸烯醇式丙酮酸羧化酶(PEPC)活性检测试剂盒、BC0605 蔗糖磷酸合成酶(SPS)活性检测试剂盒(北京Solarbio 公司)测定碳代谢关键酶PEPC、SPS 的活性。氮代谢关键酶NR、GS、GOGAT 的活性使用A096-1-2硝酸还原酶试剂盒(南京建成生物工程研究所)、BC0915谷氨酰胺合成酶(GS)活性检测试剂盒、BC0075谷氨酸合成酶(GOGAT)活性检测试剂盒(北京Solarbio公司)测定。每个处理重复3次。
1.3.3 碳氮代谢关键酶基因表达量的测定 将-80 ℃冰箱中菘蓝叶、根的冻存样品碾碎充分混匀后取适量于液氮中研磨,而后取约0.3 g 平均分成3 份,按RR047A RNAsimple Total RNA Kit 试剂盒(北京TIANGEN 公司)方法提取菘蓝叶、根的RNA,反转录使用Primer ScriptTMRT reagent kit with gDNA Eraser(Derfect Real Time)(北京宝日医生物技术有限公司)体系,以TIP41作为内参基因[16],碳代谢关键酶PEPC、SPS和氮代谢关键酶NR、GS、GOGAT基因表达量采用实时荧光定量PCR(quantitative real-time PCR,qRTPCR)方法测定,使用2×T5 Fast qPCR Mix(SYBR Green l)体系(北京擎科生物科技有限公司),具体所用引物见表1,体系混合后由QuantStudio 6 Flex 荧光定量PCR仪(美国赛默飞公司)测定后,分析程序运行结果时,假定目的片段和内参基因的扩增效率一致,均为100%,用2-ΔΔCT法定量分析,每个处理重复3次。

表1 碳氮代谢关键酶基因的引物Table 1 Primers for key enzyme genes of carbon and nitrogen metabolism
1.3.4 叶中靛蓝、靛玉红含量的测定 参照《中华人民共和国药典》(2020版一部)[1]高效液相色谱法(通则0512),采用超高效液相色谱(ultra-high-performance liquid chromatography,UPLC)法测定靛蓝和靛玉红含量,条件略作修改,分析柱为Aglient ZORBA×Eclidise Plus C18(2.1 mm×50 mm,1.8 μm);流动相为甲醇-水(v∶v=72∶28);流速0.30 mL·min-1;柱温30 °C;检测波长289 nm;进样体积2 μL。以靛蓝、靛玉红的色谱峰面积(Y)与其对应的含量(X,μg·mL-1)作标准曲线,计算回归方程。靛蓝:Y1=892.05X1+1 406.3,R1²=0.988 9(n=3),线性范围为0~10 μg·mL-1,靛玉红:Y2=51 134X2-2 441.5,R2²=0.997 7(n=3),线性范围为0~10 μg·mL-1。供试品溶液的制备:精密称定0.25 g菘蓝叶细粉,置于索氏提取器中,加三氯甲烷浸泡15 h,加热回流提取至提取液无色。回收溶剂至干,残渣加甲醇溶解并转移至100 mL 量瓶中,加甲醇至刻度,摇匀,过滤,取续滤液备用。精密吸取对照品溶液2 μL,注入超高效液相色谱仪测定相应峰面积,根据标准曲线计算即得靛蓝、靛玉红含量。每个处理重复3次。
1.3.5 根中(R,S) -告依春含量的测定 参照《中华人民共和国药典》(2020版一部)[1]高效液相色谱法(通则0512),UPLC 条件同1.3.4,流动相为甲醇-0.02%磷酸(v∶v=7∶93)。以(R,S)-告依春色谱峰面积(Y)与其对应的含量(X,μg·mL-1)作标准曲线,计算回归方程:Y=183.49X+227.32,R²=0.994 9(n=3),线性范围为0~100 μg·mL-1。供试品溶液的制备:精密称定1 g 菘蓝根细粉,置于圆底瓶中,精密加入水50 mL,称定重量,煎煮2 h,放冷,再称定重量,用水补足减失的重量,摇匀,过滤,取滤液,得供试品溶液。其余操作同1.5,每个处理重复3次。
1.4 数据处理
采用Excel 2019 及SPSS 20.0 软件中的单因素方差分析法(P<0.05)进行数据分析,处理间显著性比较采用Duncan’s新复极差法。
2 结果与分析
2.1 施氮后菘蓝叶与根碳代谢的动态变化
菘蓝叶中,随着施氮后天数的增加,CK、N1 的PEPC 活性呈现先降低后升高再降低的趋势,N2 则先降低后升高,N3 逐渐降低(表2);菘蓝叶中N1、N2、N3的PEPC基因表达量呈现先升高后降低的趋势(图1);SPS 的活性均随着时间延长呈现先降低后升高的变化趋势;N1 的SPS基因表达量呈现先降低后升高再降低的趋势,N2 则呈现先降低后升高的趋势,N3 的变化趋势与N1 相反。不同处理组的碳代谢产物可溶性糖含量的变化不同(图2)。随着施氮后天数的增加,CK 叶中可溶性糖含量逐渐增加,N1、N2、N3 的可溶性糖含量先减少后增加。不同天数,处理组生物量整体高于对照组,各组生物量随施氮后天数的增加逐渐增加(表3)。总体分析,N1、N2、N3可溶性糖含量与PEPC基因表达量的变化趋势相反,与SPS 活性的变化趋势相似。施氮12、28、64 d 后,N2 中PEPC 的活性高于其他组,PEPC基因表达量在施氮后12~64 d较高。N2、N3的SPS活性在施氮12、64 d 较高,CK、N1 的SPS 活性在施氮后12、64 d较高。施氮后12、64 d,N2的SPS基因表达量高于其他组。
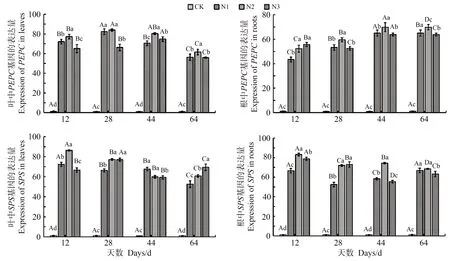
图1 施氮后菘蓝叶与根中碳代谢关键酶酶基因的表达(n=3)Fig.1 Expression of key enzyme genes of carbon metabolism in I.indigotica leaves and roots after nitrogen application (n=3)
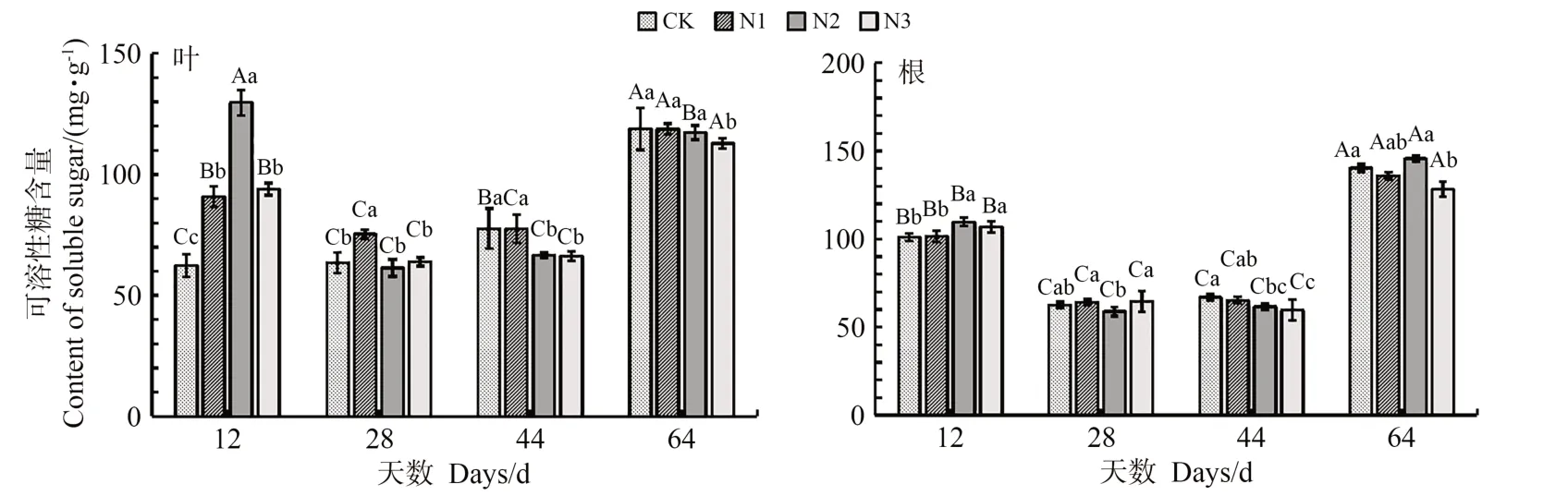
图2 施氮后菘蓝叶与根中可溶性糖含量的变化(n=3)Fig.2 Changes of soluble sugar content in I.indigotica leaves and roots after nitrogen application (n=3)

表2 施氮后菘蓝叶与根中碳代谢关键酶活性的变化(n=3)Table 2 Changes of key enzyme activities of carbon metabolism in I.indigotica leaves and roots after nitrogen application (n=3)

表3 施氮后菘蓝生物量的变化(n=10)Table 3 Changes of biomass of I.indigotica after nitrogen application (n=10)/g
菘蓝根中,随着施氮后时间延长,CK、N1、N2、N3的PEPC、SPS活性均呈现先降低后升高的趋势;N1、N2的PEPC基因表达量先升高后降低,N3 先降低后升高再降低;N1、N3 的SPS基因表达量先降低后升高,N2先降低后升高再降低;同时,CK、N1、N2、N3 根中可溶性糖含量先降低后升高。总体分析,N1、N2、N3可溶性糖含量与PEPC基因表达量的变化趋势相反,与SPS活性的变化趋势相似,该结果与叶相同。施氮后28~64 d,N2 的PEPC 活性及基因表达量高于其他组。施氮后12、28、64 d,SPS 的活性较高,SPS基因表达量在施氮后12、44、64 d 较高。N3 施用氮素多于N2,但其对碳代谢关键酶活性及基因表达量的促进作用略低于N2。
2.2 施氮后菘蓝叶与根氮代谢的动态变化
菘蓝叶中,随着施氮后天数的增加,CK的NR活性先升高后降低,N1 先降低后升高,N2、N3 则先降低后升高再降低(表4);N1 的NR基因表达量逐渐降低,N2、N3则先升高后降低(图3);CK的GS活性先升高后降低,N1 先升高后降低再升高,N2 先降低后升高,N3逐渐降低;N1 的GS基因表达量先降低后升高再降低,N2、N3 先升高后降低;CK 的GOGAT 活性先升高后降低再升高,N1 先降低后升高再降低,N2、N3 则先升高后降低;N1、N2、N3 的GOGAT基因表达量均先升高后降低再升高。GS 与GOGAT 活性、基因表达量的变化趋势相反。随着施氮后天数的增加,CK、N3 的靛蓝含量先增加后减少,N1 逐渐减少,N2 先增加后减少再增加,仅N1 组靛蓝含量的最大值出现在施氮后12 d,其余处理组靛蓝含量的最大值均出现在施氮后28 d,施氮后28 d,N2 组靛蓝含量显著高于CK,为0.37 mg·g-1(图4);CK、N1 的靛玉红含量先减少后增加再减少,N2、N3 则先增加后减少,各处理靛玉红含量的最大值均出现在施氮后44 d,其中N2 最高,为0.74 mg·g-1。总体分析,CK 靛蓝含量与NR、GS 活性的变化趋势相似,靛玉红含量与GOGAT 活性的变化趋势相反。N1的靛蓝含量与NR基因表达量变化趋势相似;靛玉红含量与GS基因表达量、GOGAT 活性变化趋势相似,与GOGAT基因表达量、GS 活性变化趋势相反。N2 靛蓝含量与NR活性的变化趋势相反,与GOGAT基因表达量的变化趋势相似;靛玉红含量与NR、GS基因表达量、GOGAT 活性的变化趋势相似。N3 靛蓝、靛玉红含量与NR、GS基因表达量、GOGAT 活性的变化趋势相似。施氮后12~64 d,N2的NR 活性始终处于较高水平。施氮后12、28、44、64 d,GS 和GOGAT 活性升高的时间点相互交错,如N1 菘蓝叶中GS 活性先升高后降低再升高,GOGAT 活性则先降低后升高再降低。施氮后12、28、64 d,NR基因表达量表现为N3>N2>N1,施氮后44 d则表现为N2>N3>N1。施氮后12、44、64 d,GS基因表达量表现为N2>N1>N3,施氮后28 d 则表现为N3>N2>N1。试验过程中,GOGAT基因表达量均表现为N2>N1>N3。总体上,N2氮代谢关键酶的活性较高。

图4 施氮后菘蓝叶与根中指标成分的变化(n=3)Fig.4 Changes of index components in I.indigotica leaves and roots after nitrogen application (n=3)

表4 施氮后菘蓝叶和根中氮代谢关键酶活性的变化(n=3)Table 4 Changes of key enzyme activities of nitrogen metabolism in I.indigotica leaves and roots after nitrogen application (n=3)
菘蓝根中,随着施氮后天数的增加,CK、N1、N2 的NR 活性先升高后降低,N3 先降低后升高;N1、N3 的NR基因表达量逐渐降低,N2 先降低后升高;CK 的GS活性逐渐升高,N1、N2、N3先升高后降低再升高;N1的GS基因表达量先降低后升高再降低,N2 先降低后升高,N3 逐渐降低;CK 的GOGAT 活性逐渐降低,N1、N2先升高后降低再升高,N3 先升高后降低;N1 的GOGAT基因表达量先降低后升高再降低,N2 先升高后降低,N3 逐渐降低;根中(R,S)-告依春的含量逐渐增加,各处理最大值均出现在施氮后64 d,(R,S)-告依春含量表现为N2>N1>N3>CK,最大值为7.50 mg·g-1。N1 的NR基因表达量变化趋势与叶相似,N2、N3 与叶相反。在菘蓝叶、根中,GS 与GOGAT 活性均存在相反的变化趋势。碳代谢关键酶SPS的活性和基因表达量与氮代谢第1 个关键酶NR 的活性和基因表达量变化趋势相反。PEPC 的活性和基因表达量与NR 变化趋势相似。分析施氮后菘蓝叶、根中指标成分含量的变化与处理浓度的相关性(表5),除施氮后44 d 叶中靛蓝含量、施氮后28 d 根中(R,S)-告依春含量与处理浓度的相关性较小外,其余时间点菘蓝指标成分含量均与氮素浓度显著相关。

表5 施氮后菘蓝叶和根中指标成分含量与氮素浓度的相关性分析Table 5 Correlation analysis between changes in index component content and nitrogen concentration in leaves and roots of I.indigotica after nitrogen application
2.3 施氮对基质碳氮比的影响
外源施加氮素可以降低基质C/N。施氮后,基质及菘蓝叶、根碳氮含量及碳氮比的变化见图5。处理结束后(0 d),处理组N1、N2、N3 基质中的氮含量高于CK,此时各组的C/N 最小。随着施氮后天数的增加,基质中的碳含量逐渐增加,氮含量则逐渐减少。施氮后64 d,N1、N2、N3基质的碳元素含量比CK低2.86%、1.29%、23.32%;仅N1 氮元素含量较CK 低1.10%,N2、N3 氮元素含量则分别较CK 高23.78%、21.71%。随着施氮后天数的增加,各组基质的C/N 逐渐增大,CK、N1组基质C/N整体显著高于N2、N3。
菘蓝碳、氮含量的变化趋势与基质相反。随着施氮后天数的增加,菘蓝叶、根中的碳含量呈波动变化,而氮含量整体逐渐增加,C/N 整体逐渐减小。各组叶中氮含量在施氮后12~28 d 的增加量较大,同时,吸收氮素关键酶NR 活性较大,根中同样存在此规律。菘蓝叶中碳元素含量整体呈现先减小后增加的变化趋势;根中碳元素含量整体呈现逐渐减小的变化趋势。叶中C/N 在施氮后28 d表现为CK>N1>N2>N3;施氮后44 d 表现为CK>N1>N3>N2;施氮后64 d 表现为N1>CK>N3>N2。根中C/N 在施氮后12 d 表现为N3>CK>N1>N2;施氮后28 d 后表现为N1>CK>N3>N2;施氮后44 d 表现为N1>CK>N3>N2;施氮后64 d 表现为CK>N1>N3>N2。
3 讨论
3.1 氮素对菘蓝C/N的影响
土壤C/N 直接反映土壤肥力大小。外源施加氮素使基质C/N 减小,土壤肥力增大。随着菘蓝生长进程的推进,基质中碳含量逐渐增加,氮含量逐渐降低;与之相反,菘蓝叶、根中的碳含量减少,氮含量增多。栽培菘蓝后的基质C/N明显增大,肥力发生变化。施氮后64 d,基质氮含量由高到低分别为N2、N3、CK、N1,与土壤氮素残留量随土壤C/N 的增大而逐渐增加的结论相符[20],这可能是因为植物对氮元素的吸收受基质本身含有氮素的限制。
器官代谢越活跃时,氮分布越多,该器官C/N 越小[21]。本研究发现,施氮后,菘蓝叶、根C/N逐渐降低,即菘蓝体内的代谢活动增强,与施氮后菘蓝碳氮代谢关键酶活性增大的现象相符。N2、N3 菘蓝叶、根的C/N 小于N1 及CK,这说明N2、N3 组菘蓝的代谢较强。植物通过降低C/N 使其在较短的时间内吸收较多养分以满足其生长需求[22]。植物不同部位C/N 不同,体现了植物对自身氮素的分配[8,21]。施氮后菘蓝叶的C/N小于根,说明菘蓝叶的代谢活动强于根[21]。可见,叶是菘蓝进行各种代谢的主要部位。
3.2 外源施加氮素后菘蓝碳、氮代谢的变化
外加氮源可直接影响菘蓝的氮代谢,间接影响与氮代谢相互制约的碳代谢。碳代谢为植物的基本代谢,其代谢产物贯穿氮代谢等其他代谢过程,为其提供碳骨架、ATP等,而氮代谢为碳代谢提供其需要的氨基酸及酶[23]。NR 为氮代谢的第一个关键酶,其活性大小可以直接反映植物的氮代谢能力[24]。外加氮素可以增大菘蓝NR 活性。施加不同浓度氮素,菘蓝叶和根中碳、氮代谢关键酶的活性及其基因表达量升高的时间点不同。叶中NR 活性及基因表达量均高于根,同时叶中氮素含量高于根,这说明叶吸收氮素更多,造成该现象的主要原因可能是叶需要更多的氮素满足其代谢的基本需求。N2 的NR 活性高于其他组,N2 组菘蓝叶、根中氮元素的增大量高于其他组,说明N2 组菘蓝所吸收的氮素较多。GS 催化含氮无机化合物合成谷氨酰胺(glutamine,Gln),是将无机氮转化为有机氮的一条主要途径,其活性是衡量植物氮素同化的重要生理指标,GOGAT 与GS 构成循环,参与氮的初级吸收等[25]。施氮后,GS、GOGAT 活性及基因表达量升高的时间点晚于NR,这可能是由二者所催化的反应以NR所催化的反应产物为底物而致[25]。
PEPC 是植物固定CO2的第一个关键酶,可催化磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)生成草酸乙酰等[26],而PEP 是合成吲哚等生物碱的关键物质[27],菘蓝叶中的靛蓝、靛玉红均属于吲哚类生物碱。PEPC 亦可调节C/N[28]。本研究发现,在菘蓝叶和根中,N2 的PEPC 活性及基因表达量较高。碳代谢关键酶PEPC 与氮代谢关键酶NR 的活性及基因表达量变化趋势相似,在施氮后12~28 d 较大,结合菘蓝叶、根中氮素在施氮后12~28 d 增大量较大的现象,综合说明PEPC 活性与菘蓝吸收的氮元素量呈正相关。SPS是调控蔗糖合成的关键酶,SPS 活性与植物蔗糖含量成正比[29]。蔗糖是植物的储能物质,具有多种生理作用。施氮64 d后菘蓝根中SPS活性与基因表达量较施氮后28、44 d显著升高,这可能是因为生长后期菘蓝将一部分营养物质向地下部分转移[30],符合菘蓝叶、根中可溶性糖含量在施氮后64 d 升高的结果。PEPC 参与产能反应[26],SPS催化能量储存物质的合成,二者所催化反应的属性相反,本试验同样发现PEPC 与SPS活性及基因表达量的变化趋势相反,这可能是因为施加氮素后,菘蓝首先进行的氮代谢强度较高,消耗能量;之后菘蓝的氮代谢强度减弱,累积能量。
菘蓝内的指标成分对不同氮水平的响应不同[31]。施氮后,N2处理的菘蓝叶、根中的指标成分含量较高,但其含量达到最高的时间点不同,造成该现象的原因可能是菘蓝不同生长时期对其相应指标成分的需求量不同。
4 结论
本研究发现,随着施氮后天数的增加,菘蓝叶、根中累积的氮素逐渐增多,与此相反,基质中的氮素减少;碳代谢关键酶PEPC 活性呈波动变化,SPS 活性及基因表达量、可溶性糖含量先减小后增加;碳代谢产物可溶性糖含量与PEPC基因表达量的变化趋势相反。氮代谢产物靛蓝、靛玉红、(R,S)-告依春含量与NR、GS、GOGAT 活性及基因表达量密切相关。15 g·L-1CO(NH2)2处理的各种酶活性及基因表达量较高。叶中靛蓝、靛玉红及根中(R,S)-告依春的含量分别在施氮后28、44、64 d 较高,15 g·L-1CO(NH2)2处理更有助于菘蓝指标成分的累积。

