人参皂苷Rg2对阿霉素诱导的心脏毒性模型小鼠心肌的保护作用机制研究
孟培培,王 蓓,刘 光,董魁星,麻继臣
阿霉素(DOX)是一种DNA拓扑异构酶Ⅱ抑制剂,是一种被广泛使用的抗肿瘤药物,通常用于治疗血液肿瘤、神经母细胞瘤和乳腺癌等[1-2]。然而,其剂量依赖性的心脏毒性作用往往会导致心功能异常,影响其临床应用,可表现为心肌病、心律失常、心功能不全甚至心力衰竭等一系列病理变化[3-4]。阿霉素诱导的心脏毒性涉及氧化应激、纤维化、自噬和细胞凋亡失调[5]。人参具有舒张血管、抗肿瘤、抗糖尿病、抗应激及抗氧化作用[6]。人参皂苷Rg2是原人参三醇的主要成分之一,具有提高心肌氧利用率、增强超氧化物歧化酶(SOD)活性、清除自由基等作用,可改善心肌缺血损伤[7-8]。此外,人参皂苷Rg2还通过抑制炎性因子的表达、减少坏死性下垂,保护心肌细胞免受缺氧/复氧诱导的损伤[8]。研究显示,人参皂苷Rg2可抑制心脏毒性模型大鼠的心肌细胞凋亡,但其保护性机制尚未明确[9]。本研究探讨人参皂苷Rg2对阿霉素诱导的心脏毒性模型小鼠心肌的保护作用和潜在机制。
1 材料与方法
1.1 实验动物
6~8周龄C57BL/6雄性小鼠60只,体质量20~25 g,购自广州锐格生物科技有限公司,许可证号:SYXK(粤)2021-0259。将小鼠分组饲养在通风笼中,温度(25±1)℃,相对湿度(55±10)%,昼夜循环12 h,小鼠食物和水按标准喂养。
1.2 主要试剂
人参皂苷Rg2和右美托咪定购自美国Sigma公司;末端脱氧核苷酸转移酶脱氧尿苷三磷酸切口末端标记(TUNEL)试剂盒购自北京碧云天公司;比色分析试剂盒购自美国Sigma公司;酶联免疫吸附试验(ELISA)试剂盒购自武汉伊莱瑞特生物公司;丙二醛(MDA)、SOD、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)购自南京建成生物公司;抗体购自美国Abcam公司。Masson三色染色试剂盒(货号:G1340)购自北京索莱宝科技有限公司。苏木精-伊红(HE)染色试剂盒(货号:C0105S)购自上海碧云天生物技术有限公司。
1.3 动物模型构建及分组[9-12]
适应性饲养2周后,将小鼠随机分为对照组、模型组、右美托咪定组、Rg2-L组、Rg2-M组、Rg2-H组和Rg2-H+LY294002组,其中Rg2-H组和Rg2-H+LY294002组每组5只,其余各组每组10只。除对照组仅给予无菌生理盐水腹腔注射外,模型组、右美托咪定组、Rg2-L组、Rg2-M组、Rg2-H组、Rg2-H+LY294002组小鼠通过腹腔注射20 mg/kg 阿霉素建立心脏毒性模型。在模型建立前30 min,右美托咪定组给予右美托咪定50 μg/kg腹腔注射,Rg2-L组、Rg2-M组和Rg2-H组分别给予5、10、20 mg/kg人参皂苷Rg2腹腔注射,Rg2-H+LY294002组给予10 mg/kg LY294002、20 mg/kg人参皂苷Rg2腹腔注射,之后每日注射1次,连续干预5 d,5 d后处死小鼠,收集左心组织进行后续实验。
1.4 超声心动图
各组小鼠给予5%异氟烷麻醉,在超声心动图采集期间,小鼠保持全身麻醉,持续给予2%异氟烷。使用配备MS400换能器(Visual Sonics)的VisualSonics Vevo 2100系统进行经胸超声心动图检查。收缩功能指标由长轴M型扫描获得。收集的参数包括左室舒张末期内径(LVEDD)、左室收缩末期内径(LVESD)、左室射血分数(LVEF)和左室短轴缩短率(LVFS)。
1.5 组织学分析
将小鼠心脏于10%甲醛中固定24 h,然后包埋在石蜡中。将包埋的石蜡标本切成5 μm的切片,采用苏木精-伊红(HE)染色[13]和Masson染色[14],并用数码显微镜拍摄照片。取每个部分的5个不同视野进行数据分析。
1.6 人参皂苷Rg2对血清心肌肌钙蛋白I(cTnI)、心脏型脂肪酸结合蛋白(H-FABP)、肌红蛋白(MB)和肌酸激酶同工酶(CK-MB)水平的影响
按ELISA试剂盒说明书检测cTnI、H-FABP和MB水平。使用比色分析试剂盒检测血清CK-MB水平。
1.7 氧化应激标志物MDA、SOD、CAT和GSH-Px活性测定
切除小鼠心室组织并用冰冷的缓冲液在匀浆器中制备匀浆液。匀浆液在室温下以1 780×g离心15 min。按照制造商说明,使用诊断试剂盒测定上清液中SOD、CAT、GSH-PX和MDA的活性。
1.8 TUNEL检测心肌凋亡情况[15]
使用原位凋亡检测试剂盒(日本Takara公司)进行TUNEL染色检测心肌凋亡。石蜡包埋的心脏组织切片在二甲苯中脱蜡,用梯度乙醇的水溶液再水化,并在室温下用蛋白酶K消化15 min。然后将载玻片在含有TUNEL反应混合物(37 ℃)中的加湿室中培养1 h,并于DAPI中培养10 min。
1.9 蛋白免疫印迹(Western Blot)法
用放射免疫沉淀法缓冲液在4 ℃下提取心肌组织总蛋白,使用二喹啉甲酸法(BCA)试剂盒(北京碧云天公司)测定蛋白质浓度。用十二烷基硫酸钠-聚丙烯酰胺凝胶(SDS-PAGE)对目标蛋白进行电泳,然后转移至聚偏氟乙烯(PVDF)膜上。5 %脱脂牛奶封闭1 h后,用稀释的一抗Caspase-3(1∶1 000)、磷脂酰肌醇3-激酶(PI3K)(1∶1 000)、蛋白激酶B(AKT)(1∶1 000)和β-actin(1∶1 000)于4 ℃孵育过夜。用与辣根过氧化物酶结合的二抗结合一抗,并用增强化学发光法(ECL)显示。β-actin用作内参对照。结果由Image J分析的灰度值表示。
1.10 统计学处理
2 结 果
2.1 人参皂苷Rg2对小鼠LVESD、LVESD、LVEF和LVFS的影响
与对照组比较,模型组LVESD升高,LVEF和LVFS降低,差异均有统计学意义(P<0.05);与模型组比较,右美托咪定组、Rg2-M组和Rg2-H组LVESD降低,LVEF和LVFS升高,差异均有统计学意义(P<0.05)。详见表1。
表1 各组小鼠LVEDD、LVESD、LVEF和LVFS比较(±s)
2.2 人参皂苷Rg2对小鼠心肌组织病理损伤的影响
与对照组比较,模型组小鼠心肌细胞空泡数量增加,成纤维细胞明显升高,伴有炎性细胞浸润和心肌细胞肌浆溶解;与模型组比较,右美托咪定组、Rg2-M组和Rg2-H组纤维排列整齐,细胞排列更加规则,成纤维细胞明显减少,炎性细胞浸润较少。详见图1、图2。
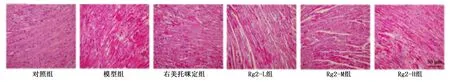
图1 各组小鼠心肌组织病理损伤改变(HE染色,×100)
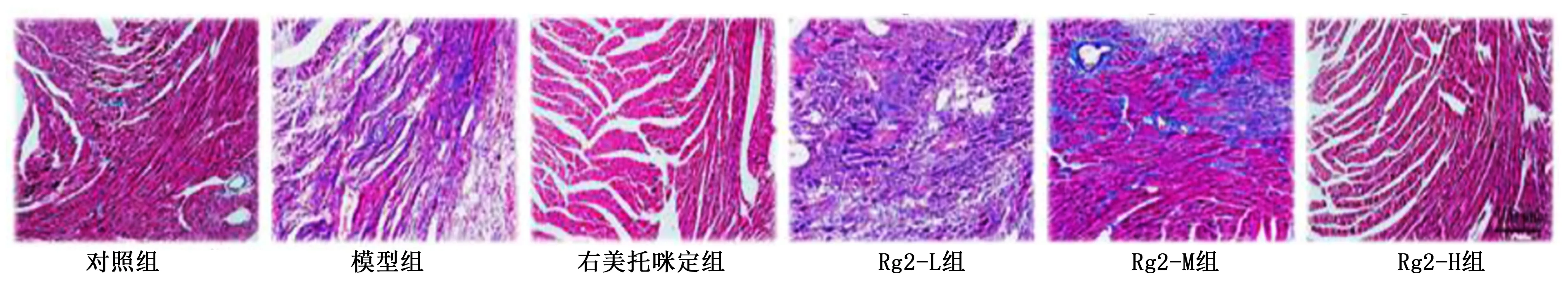
图2 各组小鼠心肌组织病理损伤改变(Masson染色,×100)
2.3 人参皂苷Rg2对小鼠血清cTnI、H-FABP、MB和CK-MB表达水平的影响
与对照组比较,模型组小鼠血清中cTnI、MB、H-FABP和CK-MB水平明显增加,差异有统计学意义(P<0.05)。与模型组比较,右美托咪定组、Rg2-M组和Rg2-H组cTnI、H-FABP、MB和CK-MB水平明显降低,差异均有统计学意义(P<0.05)。详见图3。
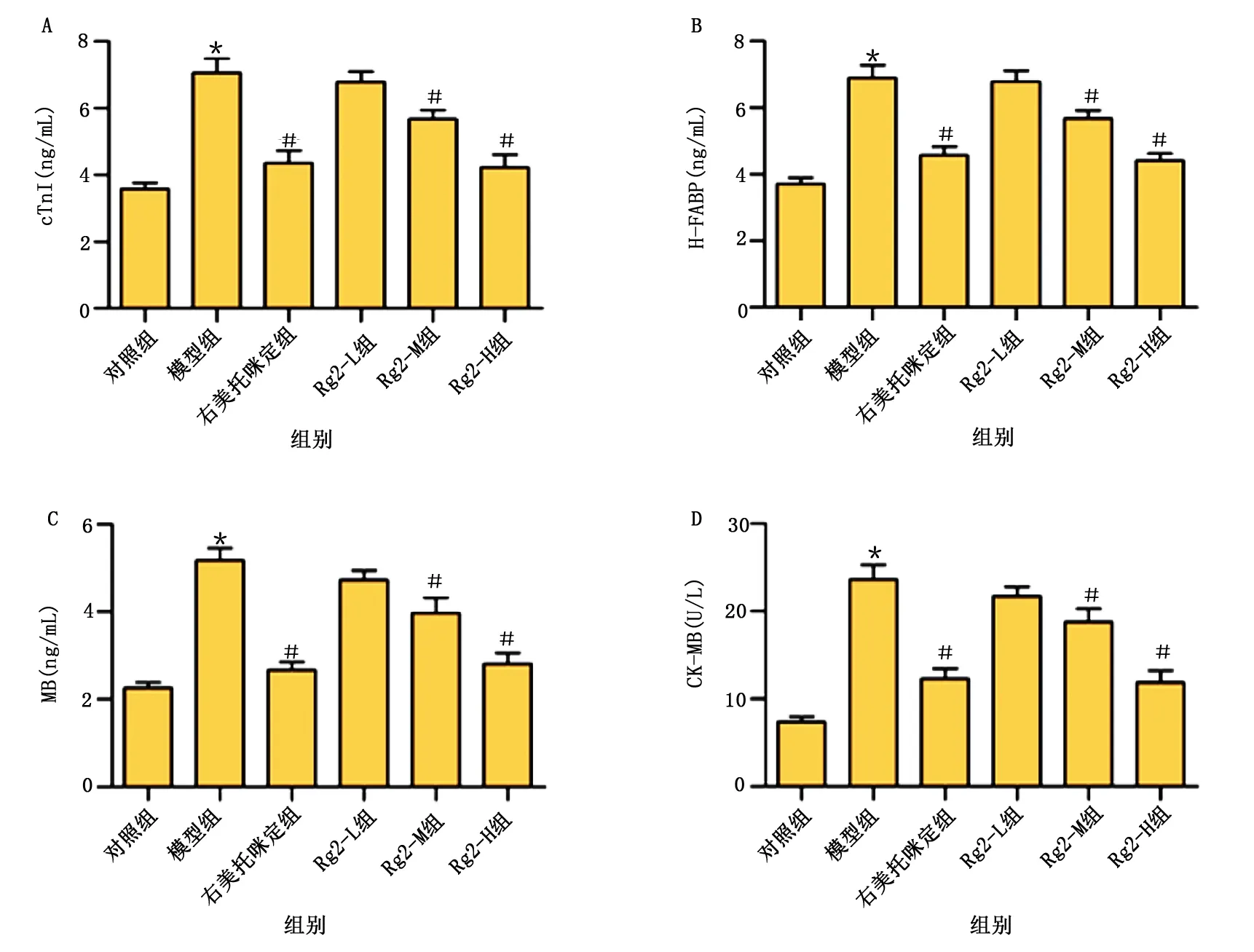
图3 各组小鼠血清cTnI、H-FABP、MB和CK-MB水平比较(A为各组cTnI水平比较;B为各组H-FABP水平比较;C为各组MB水平比较;D为各组CK-MB水平比较。模型组与对照组比较,* P<0.05;与模型组比较,# P<0.05)
2.4 人参皂苷Rg2对氧化应激标志物表达水平的影响
与对照组比较,模型组MDA含量明显增加,SOD、CAT和GSH-Px的活性明显降低,差异均有统计学意义(P<0.05)。与模型组比较,右美托咪定组、Rg2-M组和Rg2-H组MDA表达降低,SOD、CAT和GSH-Px的活性升高,差异均有统计学意义(P<0.05)。详见图4。

图4 各组MDA、SOD、CAT和GSH-Px比较(A为各组MDA含量比较;B为各组SOD活性比较;C为各组CAT活性比较;D为各组GSH-Px活性比较。模型组与对照组比较,* P<0.05;与模型组比较,# P<0.05)
2.5 人参皂苷Rg2对小鼠心肌凋亡细胞、Caspase-3表达的影响
与对照组比较,模型组小鼠心肌凋亡细胞率明显升高,Caspase-3表达上调,差异均有统计学意义(P<0.05)。与模型组比较,右美托咪定组、Rg2-M组和Rg2-H组心肌凋亡细胞率降低,Caspase-3蛋白表达下调,差异均有统计学意义(P<0.05)。详见图5~图7。

图5 各组小鼠心肌组织细胞凋亡染色图(TUNEL染色,×100)

图6 各组小鼠心脏组织Caspase-3蛋白表达条带图
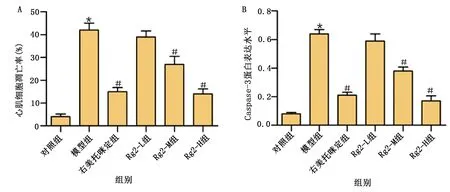
图7 各组小鼠心肌细胞凋亡率和Caspase-3蛋白表达比较(A为各组细胞凋亡率比较;B为各组Caspase-3相对蛋白表达量比较。模型组与对照组比较,* P<0.05;与模型组比较,# P<0.05)
2.6 人参皂苷Rg2对PI3K/AKT通路的影响
与对照组比较,模型组PI3K和AKT蛋白相对表达水平降低,差异有统计学意义(P<0.05)。与模型组比较,右美托咪定组、Rg2-M组和Rg2-H组PI3K和AKT蛋白相对表达水平升高,差异均有统计学意义(P<0.05)。详见图8、图9。
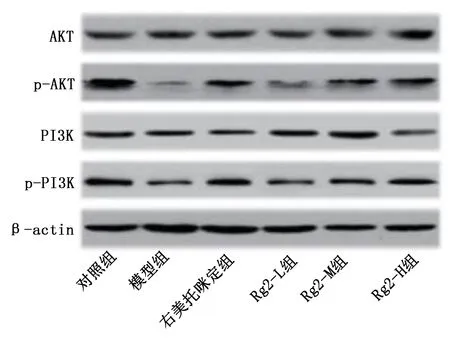
图8 各组小鼠心脏组织PI3K、p-PI3K、AKT和p-AKT蛋白表达条带图
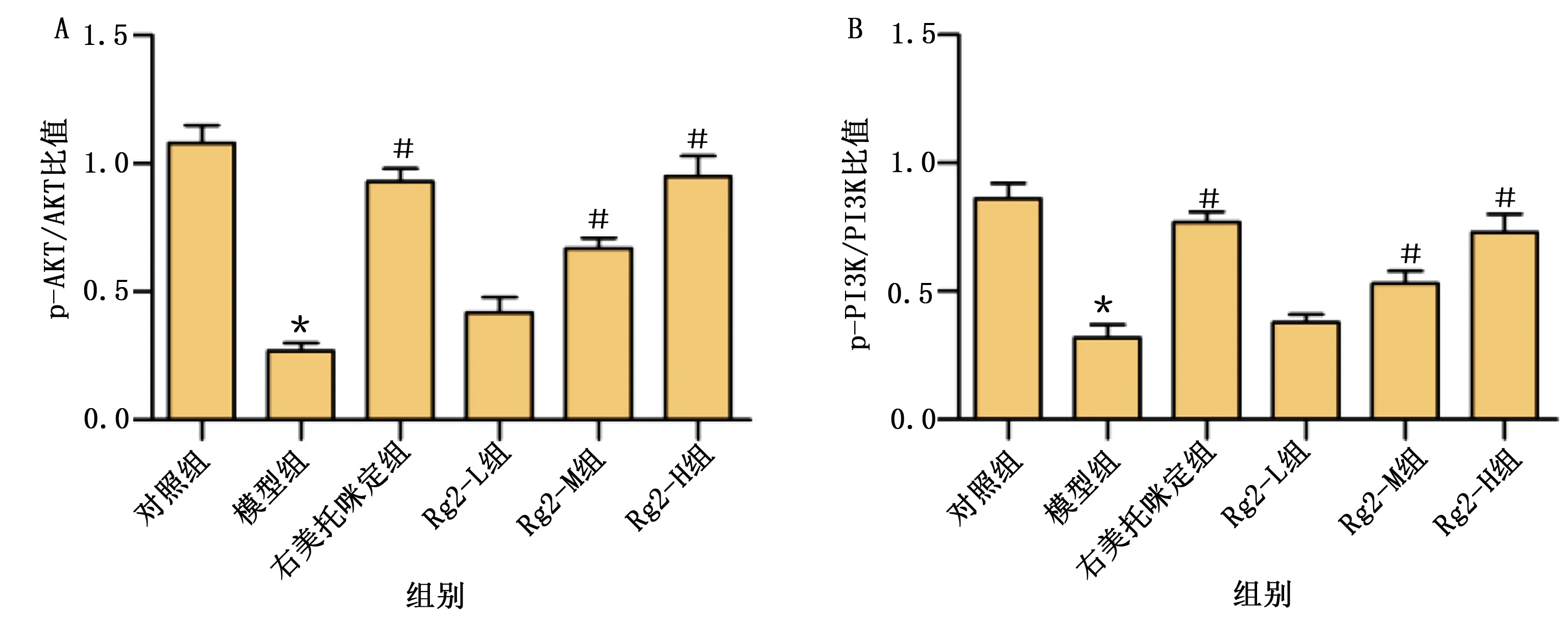
图9 各组小鼠心脏组织PI3K和AKT磷酸化水平比较(A为各组p-AKT/AKT比较;B为各组p-PI3K/PI3K比较。模型组与对照组比较,* P<0.05;与模型组比较,# P<0.05)
2.7 人参皂苷Rg2通过调控PI3K/AKT通路对心脏毒性模型小鼠心肌损伤的影响
与Rg2-H组比较,LY294002抑制了人参皂苷Rg2的抗纤维化、抗氧化应激和抗凋亡作用(P<0.05)。详见图10~图13。

图10 各组小鼠心脏组织PI3K、p-PI3K、AKT和p-AKT蛋白表达条带图
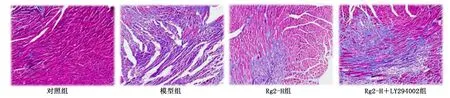
图11 各组小鼠心肌组织病理损伤改变(Masson染色,×100)
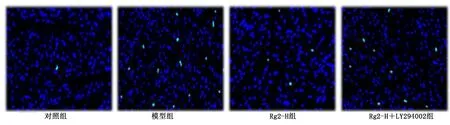
图12 各组小鼠心肌组织细胞凋亡染色图(TUNEL染色,×100)
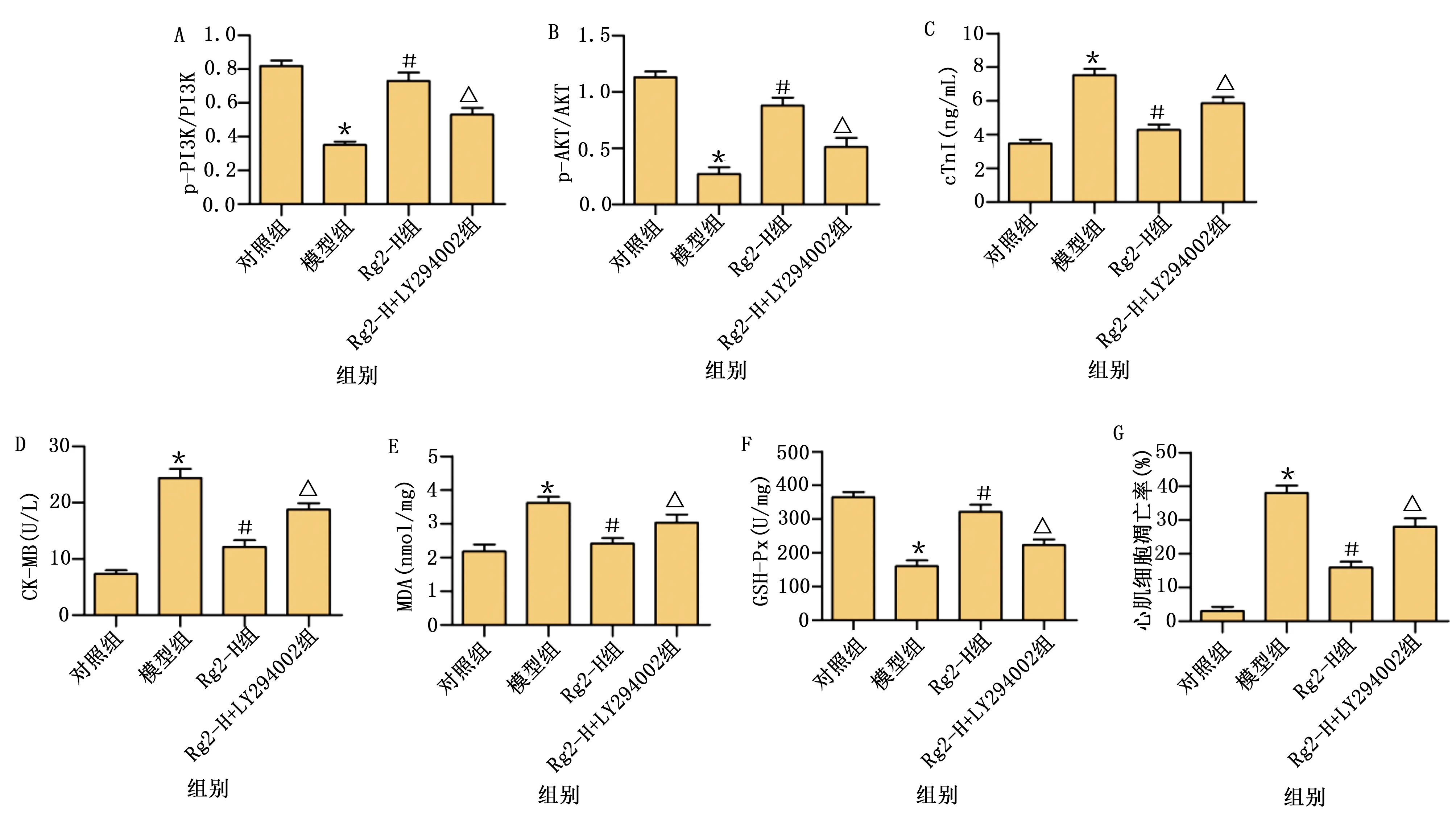
图13 各组p-PI3K/PI3K和p-AKT/AKT比值、cTnI、CK-MB、GSH-Px和细胞凋亡率比较(A为各组p-PI3K/PI3K比较;B为各组p-AKT/AKT比较;C为各组cTnI水平比较;D为各组CK-MB水平比较;E为各组MDA水平比较;F为各组GSH-Px比较;G为各组细胞凋亡率比较。模型组与对照组比较,* P<0.05;与模型组比较,# P<0.05;与Rg2-H组比较,△ P<0.05)
3 讨 论
阿霉素是应用较广泛的化疗抗癌药物之一,长期使用可导致心血管毒性等严重影响,胸痛、心悸、心电图异常、LVEF降低和心肌酶谱改变等是阿霉素诱导的心脏毒性的临床症状[2,16]。目前,阿霉素促进心脏损伤的机制仍存在争议,本研究采用阿霉素诱导的急性心脏毒性小鼠模型作为研究对象,探讨人参皂苷Rg2对阿霉素模型小鼠心肌的保护作用,结果显示,阿霉素模型小鼠出现心功能下降,心肌细胞空泡数量增加,成纤维细胞明显增多,伴有炎性细胞浸润和心肌细胞肌浆溶解等病理改变,人参皂苷Rg2处理可明显干预这些病理变化,提示人参皂苷Rg2在心脏毒性中具有保护作用。
氧化应激是原发性和继发性心肌损伤的主要因素,在阿霉素诱导的心脏毒性模型中,SOD活性降低,ROS积累增加,心脏毒性加重[17]。MDA是一种剧毒的脂质过氧化物质,可以迁移到细胞内外,从而加剧氧化应激引起的损伤范围[18]。本研究中,人参皂苷Rg2减少了MDA含量,同时也增加了抗氧化酶SOD、CAT和GSH-Px的活性,提示人参皂苷Rg2可降低阿霉素诱导的心脏氧化应激,从而改善心功能。氧化应激还可通过激活心磷脂氧化和增加线粒体通透性加速细胞死亡,从而触发Caspase信号并促进心肌细胞凋亡[19]。本研究中,人参皂苷Rg2处理明显减少了小鼠心肌凋亡细胞数量和Caspase-3蛋白表达,提示人参皂苷Rg2可抑制阿霉素诱导的小鼠心肌细胞凋亡。
PI3K/AKT通路是细胞生长和存活的主要调节因子,可为心肌细胞提供必要的细胞生存信号,激活PI3K/AKT从而改善阿霉素诱导的心肌损伤[20-22]。在本研究中,人参皂苷Rg2处理可明显上调PI3K和AKT蛋白相对表达量,提示人参皂苷Rg2可激活PI3K/AKT信号通路,而PI3K抑制剂LY294002处理显著逆转了人参皂苷Rg2的抗氧化应激和抗凋亡作用,进一步提示人参皂苷Rg2通过激活PI3K/AKT通路来保护阿霉素诱导的心脏毒性模型小鼠的受损心肌。
综上所述,本研究阐明了人参皂苷Rg2对阿霉素诱导的心脏毒性模型小鼠的受损心肌的保护作用,其机制与通过激活PI3K/AKT信号通路、抵抗氧化应激损伤、抑制心肌细胞凋亡有关。

