生长分化因子15和细胞因子对老年冠心病合并衰弱病人的诊断价值
杨雪 甯春 赵娟 郝敬波 杨荣礼
CHD是我国老年人最主要死亡原因之一,其发病率伴随我国老龄化的进展逐年上升。衰弱是一种与增龄相关的生理功能储备下降所致的机体功能下降、易损性增加的老年综合征。研究发现,老年CHD病人中衰弱发病率较高,合并衰弱会增加跌倒、感染、死亡等不良事件的发生率,早期识别及干预衰弱尤为重要[1-2]。目前衰弱的筛查方法多为量表,缺少更加客观有效的方式,衰弱的发病机制也尚不明确,慢性炎症可能为其主要介导因素[3-4]。生长分化因子15(growth differentiation factor 15, GDF15)是转化生长因子超家族一员,可以预测身体衰退,与肌肉质量和许多与年龄相关的疾病呈负相关[5]。本研究通过探讨GDF15及细胞因子对老年CHD合并衰弱的诊断价值,以期为临床早期诊断及干预提供参考。
1 对象与方法
1.1 研究对象 收集2022年7~9月徐州医科大学附属医院收治的老年CHD病人共88例,所有研究对象年龄60~94岁,平均(71.14±7.34)岁,其中男47例,女41例。纳入标准:(1)年龄≥60岁;(2)符合CHD诊断标准[6];(3)意识清楚,能够正常交流。排除标准:(1)近1个月内有急性感染、服用抗生素;(2)合并炎症性疾病;(3)合并自身免疫性疾病;(4)合并恶性肿瘤及严重的器官功能不全;(5)接受免疫抑制剂治疗、器官移植术后、粒细胞缺乏等存在影响炎症因子水平的其他疾病。所有资料的收集与处理均经研究对象知情同意,并由医学伦理委员会审核通过(XYFY-2022KL33601)。
1.2 方法
1.2.1 衰弱评估及分组:入组病人评分采用Frail衰弱量表,共包括5项内容:(1)疲乏;(2)耐力下降;(3)自由活动能力下降;(4)多种疾病共存;(5)体质量下降。答“是”每项所占分值为1分,“否”则为0分,合计分值为5分,0分为无衰弱,1~2分为衰弱前期,3分及以上为衰弱期。根据Frail衰弱量表,将病人分为衰弱组(≥3分)和非衰弱组(<3分)。
1.2.2 一般临床资料收集:收集2组年龄、性别、BMI、CHD分型、病程、吸烟史、饮酒史、多重用药史(5种及以上药物同时服用)、年龄修正查尔森共病指数(age-adjusted Charlson comorbidity index, ACCI)等基线资料。采集病人入院第2天空腹10 h以上的静脉血,检测WBC、Hb、PLT及血清白蛋白(albumin, ALB)等一般实验室数据。
1.2.3 GDF15及T细胞因子水平测定:病人均在入院后第2天空腹状态下取肘静脉血2~3 mL,静置至自然凝固,常温下离心20 min,分离上清,置于-80 ℃冰箱保存备用。血清GDF15水平采用ELISA法测定,试剂购自上海江莱生物科技有限公司;细胞因子(IL-1β、IL-2、IL-5、IL-6、IL-8、IL-10、IL-α、IL-r、IL-α)水平采用多重微球流氏免疫荧光发光法测定,试剂购自青岛瑞斯凯尔生物科技有限公司。均按照检验说明书操作。

2 结果
2.1 2组病人一般临床资料比较 此次研究共纳入老年CHD病人88例,衰弱组27例,非衰弱组61例,衰弱组年龄、ACCI均高于非衰弱组,差异有统计学意义(P<0.05),其他一般临床资料2组间差异均无统计学意义(P>0.05),见表1。
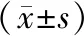
表1 2组一般临床资料比较
2.2 2组GDF15及细胞因子水平测定比较 衰弱组IL-1β、IL-5、IL-6、IL-10、IFN-α、IFN-γ、 TNF-α和GDF15水平均明显高于非衰弱组(P<0.05或P<0.01)。见表2。
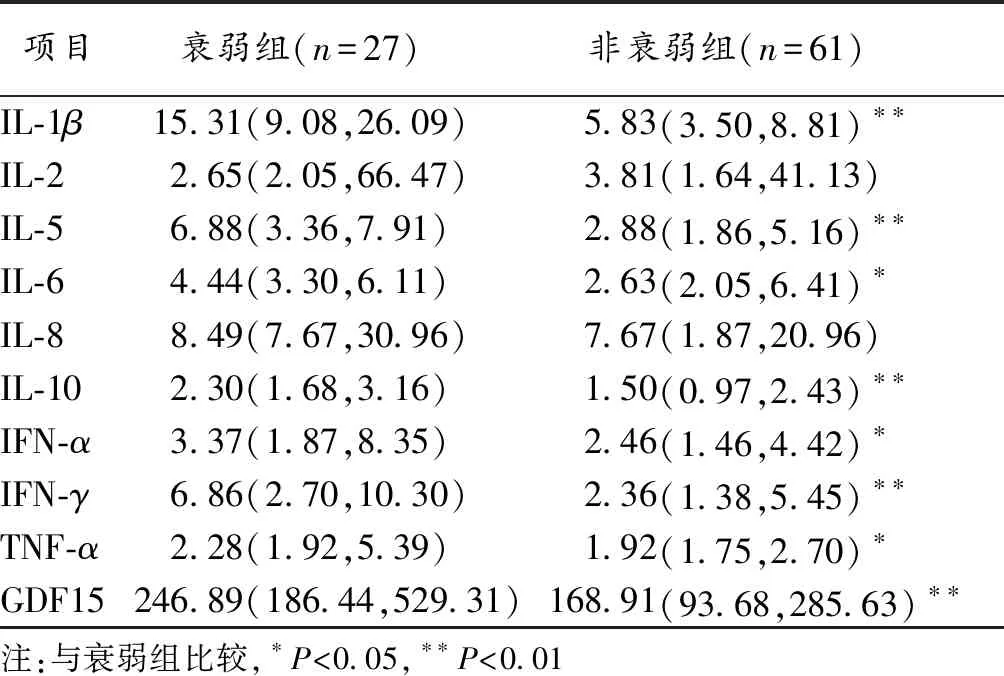
表2 2组GDF15及细胞因子水平测定比较[M(Q1,Q3),pg/mL]
2.3 GDF15联合其他细胞因子对老年CHD病人合并衰弱的诊断价值 将上述单因素研究中差异有统计学意义的指标纳入多因素分析,筛选出IFN-α、IFN-γ、GDF15为老年CHD病人合并衰弱的独立影响因素(P<0.05),见表3。将上述三项指标作为预测老年CHD病人合并衰弱的血液学指标进行诊断价值研究,ROC曲线分析结果显示:单项指标检测老年CHD病人合并衰弱的灵敏度波动在37.00%~85.20%,特异度波动在54.10%~91.80%,而联合检测的敏感度为85.19%,特异度为78.69%,AUC为0.868,优于单项指标检测诊断价值(Z分别为2.380、3.219、2.070,P均<0.05),见表4及图1。
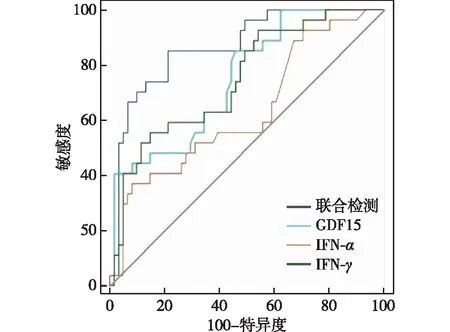
图1 各指标单项及联合检测对老年CHD合并衰弱病人诊断价值的ROC曲线
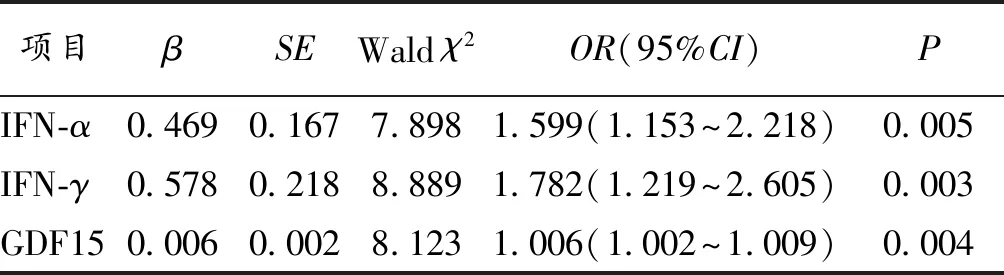
表3 老年CHD病人合并衰弱的影响因素的Logistics回归分析
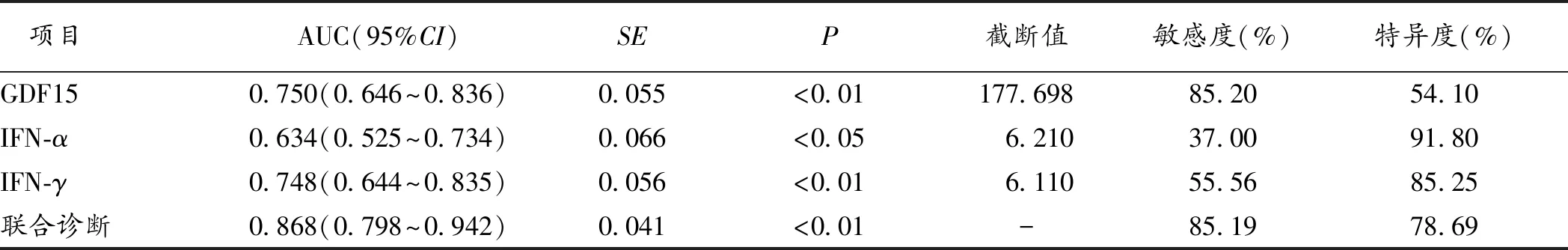
表4 各指标单项及联合检测对老年CHD合并衰弱病人诊断价值分析
3 讨论
近年来,伴随着人口老龄化的进展,与老龄化相关的疾病及并发症患病人数也逐年增多,其中衰弱和CHD均是老年人健康的主要威胁之一[3]。目前关于衰弱的评估仍采用量表或问卷形式,主观性强,易产生误差,因此,关于衰弱相关血液学标志物的研究具有重要意义。
GDF15是一种转化生长因子β(transforming growth factor-β, TGF-β)超家族细胞因子,由两个多肽链经单链间二硫键连接而成,是一种通过与高亲和力受体胶质细胞源性神经营养因子家族α样受体(glial-derived neurotrophic factor receptor alpha-like, GFRAL)结合而发挥生理作用的同源二聚体[7]。当机体处于癌症、全身炎症、代谢性疾病等病理条件时,GDF15会处于过表达的状态[8-9]。本研究中衰弱组GDF15水平明显高于非衰弱组,高GDF15水平是老年CHD病人合并衰弱的危险因素,这与Arauna等[10]的研究结果一致。其可能机制为:首先,GDF15能通过信号转导与转录激活因子3(signal transducer and activator of transcription 3, STAT3)的磷酸化及参与线粒体功能障碍诱导骨骼肌的氧化应激和分解代谢变化,进一步诱发肌肉功能障碍及肌肉纤维凋亡;其次,GDF15可诱导GFRa-RET受体的磷酸化,导致AKT、ERK和PLC-γ通路的激活,引起食欲、摄食量和体质量下降,间接影响肌肉质量[11-13]。肌肉力量减弱是衰弱的重要特征之一,老年人的肌肉萎缩、活动下降等伴随增龄逐渐加剧,GDF15水平与老年人肌肉质量与性能下降有关,体现了老年病人衰弱的发生与发展。
低级别炎症表现为促炎和抗炎细胞因子的失衡,也被认为与衰弱密切相关。已知炎症和衰弱都随着年龄的增长而增加,促炎细胞因子可能通过促进蛋白质降解直接影响衰弱,或通过它们对各自代谢途径的影响而间接影响衰弱的发生[14]。本研究中衰弱组病人IFN-γ水平显著升高,这与Mohamad等[15]的研究结果一致。Yang等[16]发现IFN-γ可激活间充质细胞(mesenchymal stem cells, MSC)的免疫调节作用,增加活性氧(ROS)及衰老相关的分泌表型(senescence-associated secretory phenotype, SASP)的产生,加剧细胞衰老,诱导小鼠骨髓MSC的衰老样特征,参与衰弱的发生发展。IFN-α同样参与调控免疫系统活化,本研究结果显示,衰弱与非衰弱组的IFN-α表达水平差异有统计学意义,其可能通过促进机体免疫功能,调节细胞因子的表达,激活炎性反应从而加剧老年人衰弱的发展,尚无其他研究报道IFN-α与衰弱的相关性,具体机制仍需进一步探讨。此外,本研究中IL-1β、IL-6、IL-8、Il-10、TNF-α水平与衰弱无明显相关性,这与部分研究的结果不同,差异可能与研究样本量及人群的不同有一定关系[17-18]。
ROC曲线分析结果显示,IFN-α、IFN-γ、GDF15对诊断老年CHD合并衰弱具有一定价值,且联合诊断效能高于各指标单独检测,这提示GDF15和上述细胞因子可能从肌肉状态和炎症反应的角度反映老年CHD合并衰弱的病情发展,可以作为老年CHD合并衰弱的生物标志物,为其诊断提供依据,为衰弱相关机制及干预的研究提供方向。
综上所述,IFN-α、IFN-γ、GDF15联合诊断可均衡敏感度与特异度,提高诊断效能,有助于客观、早期识别老年CHD合并衰弱,积极施行干预措施,逆转病人衰弱状态,改善病人预后。

