老年退行性关节炎的疼痛机制
佟思含 黄轶刚 张长青
退行性骨关节炎是最常见的关节病变,多累及手部指间关节、膝关节和髋关节,其核心病理改变为进行性关节软骨破坏,并继发软骨下骨损伤及滑膜炎等,最终导致整体关节损害。年龄增长是该疾病最重要的诱发因素,50岁以上人群发病率显著提升[1-2]。病人可出现关节疼痛、僵硬及活动受限等症状,其中疼痛往往是影响生活质量的首要因素,且疼痛程度与骨关节炎关节内病变严重性并不完全平行,其疼痛机制非常复杂,既存在炎症刺激导致的外周和中枢敏化,也与老年人对于疼痛的感知变化有关。
1 退行性骨关节炎的病理变化
1.1 正常关节软骨 骨关节炎病变起源于关节软骨。正常关节软骨由软骨细胞和细胞外基质构成,后者主要包含Ⅱ型胶原、蛋白聚糖和70%的水[3]。胶原主要提供抗拉强度,蛋白聚糖通过亲水侧链保持水分从而提供抗压弹性[4]。软骨细胞被包埋在由Ⅳ型胶原蛋白组成的细胞周基质中,与细胞外基质分隔开,可通过表面的纤毛感受关节所受到的机械负荷,分泌细胞因子调节成骨细胞和破骨细胞活性,还可生成细胞外基质维持关节稳态[2]。
1.2 软骨退变 机械负荷、衰老等因素可导致软骨发生退变。在骨关节炎早期,细胞周围基质破坏,使软骨细胞暴露于细胞外基质而功能失调;随着疾病的进展,胶原蛋白网络和蛋白聚糖被软骨细胞分泌的基质金属蛋白酶和蛋白聚糖酶分解,细胞中核因子-κB(NF-κB)表达上调促进炎症细胞因子分泌[2,5];晚期软骨细胞内血管内皮生长因子(vascular endothelial growth factor,VEGF)表达增加,软骨内血管长入,进一步加速关节的破坏。
老年人体内衰老的软骨细胞表现出衰老相关分泌表型(senescence-associated secretory phenotype,SASP),即细胞周期停滞,并释放一系列SASP因子(包括细胞因子、趋化因子、蛋白酶和生长因子)到周围的微环境中[6]。前二者可诱发巨噬细胞聚集、炎症反应及疼痛;基质金属蛋白酶可降解软骨细胞外基质,使关节异常负荷增大,进一步加速软骨破坏;生长因子如转化生长因子β与骨赘形成及软骨下骨板增厚有关[7]。
软骨细胞由于处于乏氧条件,其新陈代谢通过自噬完成,回收受损细胞器,提高细胞存活率。但随着年龄增长,自噬相关蛋白如Unc-51样激酶1、beclin-1和LC3在老年人软骨细胞中表达减少,自噬减弱,因此细胞内受损细胞器和大分子积累,导致细胞凋亡增加和软骨退变[8]。哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是调节自噬的核心靶点,在调节关节软骨稳态中起着重要作用;mTOR还是SASP的关键调节因子,抑制mTOR可有效降低SASP因子的表达。因此,mTOR已成为骨关节炎治疗的新靶点[7]。
1.3 骨病变 骨细胞可以感受机械负荷的变化并分泌细胞因子调节成骨细胞/破骨细胞活性,二者失衡可引发软骨下骨病变[9]。软骨退变造成的应力增加激活成骨细胞的活性,引起皮质骨的增厚和骨赘的形成,这是骨关节炎病变中的一个重要的特点[2]。骨关节炎还伴随着骨髓的病变,以骨髓水肿、脂肪坏死、局部骨髓纤维化和骨小梁微骨折为特征,多见于脱落软骨下方。其中,MRI上所见骨髓水肿的病人通常伴有较明显的关节疼痛,这与骨髓水肿处的炎症反应和髓腔内的压力升高有关[10]。
异常应力可导致局部微损伤和坏死,启动破骨细胞介导的骨吸收,局部可有骨囊肿形成,一般位于软骨损伤最严重的部位。但这其实并非真正意义上的囊肿,因为没有上皮细胞,且为纤维组织而非囊液填充,因此称之为“骨内损伤”或“假性囊肿”更为合适。囊内有神经纤维分布,但这一结构与疼痛是否相关目前尚不明确。
1.4 滑膜炎 关节滑膜由成纤维细胞和巨噬细胞组成,可分泌滑液到关节腔中维持关节的正常功能。骨关节炎时,软骨细胞会分泌大量的炎症介质进入关节内,软骨降解碎片作为损伤相关分子模式作用于滑膜细胞上的TOLL样受体,促进细胞因子和趋化因子的产生,导致滑膜增生和免疫细胞浸润[2]。此外,骨关节炎病人的滑膜中有大量的补体沉积,与趋化因子共同介导更多的炎症细胞浸润[2,11]。与健康人的滑膜相比,骨关节炎病人的滑膜中VEGF、IL、TNF-α、神经生长因子(nerve growth factor,NGF)、趋化因子等水平显著升高,这些物质不仅能进一步加重关节的损伤,而且直接作用于滑膜内感觉神经纤维,对于疼痛的发生发展至关重要[12]。
2 痛觉的传递通路
正常关节软骨内没有神经纤维,神经纤维主要分布在滑膜、软骨下骨、骨膜以及韧带中。神经分为传导本体感觉的厚髓鞘Aα纤维、低阈值触觉的Aβ纤维、快痛觉的薄髓鞘Aδ纤维及慢痛觉的无髓鞘C纤维。介导痛觉的两类纤维游离末梢(Aδ纤维、C纤维)在支配组织中形成痛觉感受器[5],具体传导通路如下。
2.1 外周感受器 感受器上的瞬时受体电位香草酸亚型1(TRPV1)、瞬时受体电位M8(TRPM8)、PIEZO2等离子通道将热、冷、机械等刺激引起的痛觉信号转化为背根神经节内初级感觉神经元的动作电位,并通过轴突上的Na+、K+通道去极化向脊髓传递[13-14]。
2.2 脊髓后角 初级感觉神经元在脊髓后角与板层神经元形成突触,疼痛信号到达脊髓后激活中枢突电压门控钙离子通道引起Ca2+的大量内流及细胞内Ca2+升高,促使包含谷氨酸的囊泡释放,激活板层神经元上谷氨酸受体阳离子通道(AMPA、NMDA),允许Na+等离子内流形成突触后兴奋性电位[13]。脊髓背角还存在抑制性中间神经元,通过分泌γ-氨基丁酸或者甘氨酸引起突触后膜Cl-内流,形成抑制性电位,可以部分抑制痛觉的产生[15]。
2.3 脊髓上 痛觉信号主要由脊髓丘脑束向上传递至丘脑,并由内侧丘脑投射到前扣带皮层和岛叶皮层,主要参与疼痛的情感部分,产生不愉快的感觉;外侧丘脑投射到初级和次级躯体感觉皮层和岛叶皮层,负责处理疼痛的感觉辨别(主要是位置和强度)[16]。脑干中还存在着下行易化和抑制系统投射到脊髓后角进一步调控痛觉,脊髓丘脑束发出侧支投射至中脑的导水管周围灰质和延髓的头端腹侧区形成痛觉传递旁路,并可对此进行调节[15]。
3 骨关节炎的疼痛机制
在骨关节炎早期阶段,疼痛通常由活动引发并可以预测,这是由于受损关节的异常负荷增大,激活了关节内机械性痛觉感受器。在中期阶段,则发展为持续性的疼痛,尤其是在夜间,提示随着炎症的发展,积累的炎症因子敏化了感觉神经元[17];晚期病人的疼痛更加剧烈并为不可预测性[18]。病人X线影像表现和疼痛的相关性较弱,但MRI上的骨髓水肿、滑膜炎症和关节积液与疼痛紧密相关[17,19]。
骨关节炎的疼痛来源于关节中神经末梢增多,炎症介质导致的外周敏化以及增加的外周冲动传入引起的中枢敏化,最近研究还发现自主神经系统紊乱也可以加重关节内炎症(图1)[19-20]。
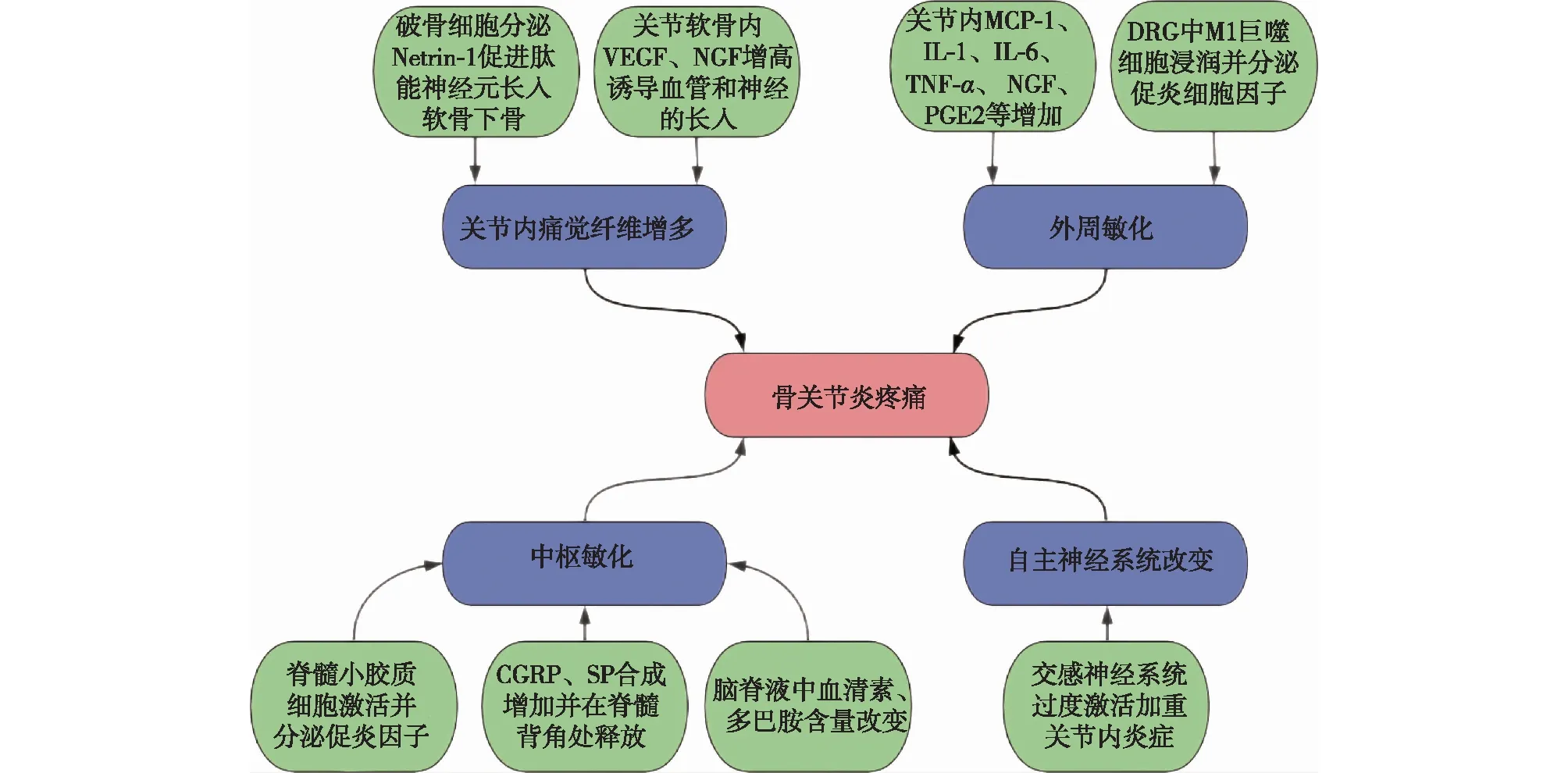
注:Netrin-1:神经导向因子-1;DRG:背根神经节;CGRP:降钙素基因相关肽;SP:P物质
3.1 神经末梢长入 骨关节炎病人可见软骨下骨、髓腔和关节囊痛觉纤维增多,且无神经支配的关节软骨出现神经末梢长入。在小鼠骨关节炎模型中可见软骨下骨神经末梢密度增加,这是由增多的破骨细胞分泌神经导向因子1(netrin-1)促进周围肽能神经元的长入。使用Dmp1cre-RANKLfl/fl小鼠特异性降低破骨细胞的数量可以减少神经的长入,提示抑制破骨细胞的活性可以缓解骨关节炎的疼痛和疾病的进展[21]。关节软骨由于受力和氧化状态的改变,导致关节内VEGF和NGF增高,感觉神经和血管会沿着骨软骨碎裂后形成的通道长入,从而参与痛觉的形成[22-23]。
滑膜对骨关节炎疼痛的影响存在争议。早期关节滑膜内感觉神经纤维增多,但后期减少[21],提示炎性滑膜中神经末梢数量的变化可能不是骨关节炎疼痛的直接来源,而更多的影响来自炎症因子的分泌。
3.2 外周敏化 在炎症关节中,伤害感受器的阈值降低导致神经元兴奋性升高。骨关节炎病人对机械负荷敏感性增加,使非伤害性刺激诱发疼痛,对有害刺激则产生痛觉过敏。大鼠的骨关节炎模型可观察到传入神经放电频率明显增加,证实了初级感觉神经变得敏化[24]。这种敏化与关节及背根神经节(dorsalrootganglion,DRG)内炎症细胞浸润和炎症因子增加有关。
3.2.1 关节内:临床研究提示,滑膜炎症反应可导致关节疼痛,其机制在于滑膜中有大量炎症细胞浸润并分泌促炎介质作用于感觉神经,其关节内含量与疼痛水平密切相关[19]。
炎性滑膜中趋化因子如单核细胞趋化蛋白1(MCP-1)的增加[25]不仅可以募集更多的巨噬细胞浸润,还可以直接作用于感觉神经末梢敏化TRPV1通道,关节腔内注射趋化因子受体2(CCR2)的拮抗剂可以有效地减轻痛觉过敏[26]。浸润的巨噬细胞分泌经典的促炎细胞因子如IL-1、IL-6和TNF-α,这些促炎细胞因子可以刺激软骨细胞分泌基质金属蛋白酶和蛋白聚糖酶,加速软骨破坏[5,27]。
骨关节炎病人关节滑液内NGF水平升高明显,通常由滑膜内巨噬细胞和成纤维细胞分泌[28],NGF可以与神经上的高亲和力受体TrkA结合,分别通过PI3K通路和第二信使神经酰胺敏化TRPV1和电压门控钠通道[29-30]。最近的研究发现,NGF激活伤害感受器上的Piezo2离子通道,介导机械性痛觉过敏[14]。
其他白细胞介素家族的成员,比如IL-17、IL-33最近也被证明在炎性关节中表达增加并且介导了痛觉敏化,中和这些细胞因子可以有效缓解骨关节炎疼痛[19]。
软骨下骨病变也与外周敏化有关。在骨损伤的状态下,大量的前列腺素(prostaglandin,PG)E2从成骨细胞中释放出来,与EP4受体结合促进成骨细胞向骨细胞的分化,导致骨结构的异常,同时上调环氧化酶-2(COX-2)的表达,进而生成更多PGE2[31]。初级感受神经元上存在大量的PGE2受体,与其结合后可以通过cAMP-PKA通路磷酸化钠离子通道增强电导[32]。PGE2还可以通过EP2、EP4受体上调炎症因子IL-6的表达,加重疼痛[5]。
3.2.2 DRG:DRG内同样存在上述巨噬细胞浸润及促炎因子增加。膝关节骨关节炎模型中可观察到L3~L5 DRG有大量巨噬细胞浸润,这是由DRG中高表达的趋化因子配体2(CCL2)与巨噬细胞上的趋化因子受体2(CCR2)介导的,特异性敲除CCR2后巨噬细胞浸润减少[33]。浸润的巨噬细胞极化为M1表型并分泌促炎细胞因子如TNF-α,通过p38MAPK通路引起神经元中Na+电流的增加导致疼痛[34],鞘内注射IL-4/IL-10融合蛋白使巨噬细胞向M2极化有效缓解了骨关节炎的疼痛,同时,局部耗竭DRG中的巨噬细胞可完全解决炎症引起的疼痛,提示疼痛主要为DRG内而非关节处巨噬细胞所致[35-36]。
3.3 中枢敏化 膝关节炎模型动物不仅会出现膝关节的痛觉过敏,还会发生缩足阈值的降低[21]。胫骨前肌内注射高渗盐水引起的疼痛在骨关节炎病人中持续更久并且强度更高;在双侧都患有膝骨关节炎的病人中,单侧膝关节内注射麻醉药可以同时缓解两侧膝关节的疼痛[37]。这种和发病关节距离较远部位的痛觉过敏提示骨关节炎中枢敏化的存在。可能的机制包括:(1)来自外周的反复的痛觉传入导致初级感受神经元释放CCL2、CX3CL1、ATP等激活小胶质细胞[38],被激活的小胶质细胞释放IL-1β、TNF-α等影响突触前膜的递质释放和突触后膜的受体功能,引起兴奋性突触效能的增强和抑制性突触效能的减弱[37];(2)由外周神经摄取的NGF可以通过NGF-TrkA信号转导引起的转录改变,增加初级感受神经元中降钙素基因相关肽(CGRP)和P物质(SP)合成,这两种物质已经被证明可以在脊髓背角处增加谷氨酸的释放或者磷酸化NMDA受体,导致突触后兴奋性电位增强[39-40];(3)起源于中脑等结构的下行调节系统对于疼痛的发生发展至关重要,血清素和多巴胺是这一系统中的重要成员,骨关节炎病人脑脊液中血清素和多巴胺代谢物水平改变可导致中枢敏化[24,41]。
3.4 自主神经系统 当接收到持续的疼痛信号传入时,交感神经系统被激活,导致与副交感神经的平衡发生变化。炎性关节滑膜及关节囊内也存在明显交感神经增生。当副交感神经的抗炎作用被抑制时,巨噬细胞的成熟和软骨细胞炎症因子表达的增加,加速了骨关节炎进展和疼痛的发生[20,42]。一些非药物治疗可能通过恢复自主神经系统的稳态减轻骨关节炎的炎症和疼痛,如电刺激迷走神经、运动和身心干预等[20]。
4 老年骨关节炎病人疼痛特点
65岁以上的老年人对急性疼痛敏感性下降,但对骨关节炎导致的慢性疼痛敏感性增加[43]。老年人由于随着年龄的增长,外周无髓纤维数量减少以及轴突退变,引起传导速度下降,导致短暂、局部刺激的痛阈增加[43]。与急性疼痛相反的是,老年病人对于慢性疼痛的忍耐力相对较差。而且相比于年轻人,老年人对于热刺激诱发的疼痛并不敏感,却更容易受到关节炎中机械力所造成疼痛的影响[44]。
大多数的观点认为,外周神经敏化在老年和年轻病人中对痛觉的影响差异较小,而造成老年病人对骨关节炎疼痛更敏感的主要原因是脊髓和脊上的变化[43,45-46]。(1)脊髓:在衰老大鼠的脊髓背角处,虽然生理状态下SP和CGRP的含量下降,但是持续的伤害性刺激或者神经损伤会引起衰老大鼠释放更多的神经肽[43]。神经免疫网络在年老个体内也有明显的变化,中枢神经系统尤其是脊髓内的肥大细胞对炎症介质的敏感性提高并且更容易脱颗粒;小胶质细胞被激活并且促进神经元的高兴奋状态,两者共同增强中枢致敏[46]。(2)脊髓上:老年人中枢神经系统内对于痛觉传递的抑制作用减少并且更容易被疼痛信号激活。脑干下行抑制系统功能的减退,加重了有害刺激导致的疼痛感受。其中阿片肽受体数量显著减少,需要更多的吗啡才能获得镇痛效果[47]。还有研究发现,老年大鼠对刺激表现出内源性疼痛抑制途径减少,也可能和大脑中边缘系统的变化有关[48]。大鼠骨关节炎模型的MRI证实,老年雌性大鼠在骨关节炎的后期表现出中脑导水管周围灰质通路的过度激活,并且前扣带皮层也参与这一过程,这和之前的研究结果相一致,老年雌性大鼠在碘乙酸钠诱导骨关节炎后表现出夸张且持久的痛觉过敏反应[16,49]。
然而,最近的一项关于老年骨关节炎病人和年轻病人之间的对比研究却有着不同的观点。该研究发现不同年龄病人之间存在痛觉感受差异,但大于65岁的病人时间疼痛总和及条件性疼痛调节与年轻者相比并没有明显差异,由于这两个指标反映了中枢神经系统的变化,因此该研究认为年龄增长带来的痛觉改变主要影响的是外周神经系统[50]。
疼痛的感觉最终在脑中被读取,因此除了产生疼痛信号的生理性原因之外,心理状态也会影响疼痛的感知[20]。一项纳入100例老年病人的横断面临床研究表明,骨关节炎的疼痛会加重抑郁和焦虑,并且严重损害生活质量水平[51]。来自家庭成员的支持可以明显影响老年人的疼痛体验,与在养老院或者独自生活的人相比,家人的照顾减少了疾病带来的痛苦和不愉快。动物的陪伴也可有效降低老年慢性关节疼痛病人的痛觉感知,减少疼痛相关性失眠[16]。然而无论分心与否,与年轻人相比,老年人对于疼痛刺激引起的不愉快程度更高[52]。老年人复杂的疼痛感知机制涉及无数相互影响的因素,包括情感维度的变化,这增加了治疗的复杂性。
5 小结
退行性骨关节炎的疼痛机制非常复杂,与关节内神经末梢增生、外周和中枢敏化及自主神经系统紊乱等一系列病理变化有关,其中神经-免疫细胞的相互作用尤为重要。老年人对慢性疼痛耐受性的降低进一步加重了疼痛治疗的复杂性。因此,在退行性骨关节炎病人的疼痛管理中,要充分考虑到老年病人生理和心理的特殊性,为他们提供更加有效的治疗方式。

