皮肤衰老的特征与机制
雷锐 吴金峰
随着我国人口老龄化和人均预期寿命的提高,了解衰老的特征和机制对促进健康老龄化至关重要。衰老是指与发病率和死亡率增加有关的功能和可重复性的时间依赖性持续变化的过程[1],主要由内在因素(遗传)及外在因素(环境影响、营养、生活方式等)共同决定。皮肤作为最大的表皮器官,与环境直接接触,使其更易受到外部环境的影响而导致衰老。皮肤老化和其他器官的老化一样,特征是结构和功能的退行性改变,因为其肉眼可见,皮肤的老化相较其他器官更为明显。随着年龄的增长,人类皮肤不断暴露于对其功能产生影响的内部和外部刺激,表现为皱纹、皮肤干燥、屏障完整性降低和表皮变薄。
皮肤的衰老过程主要分为内在衰老和外在衰老。内在衰老或称时间顺序性衰老,是一个不可避免的时间顺序和生理改变的过程,导致皮肤老化的内在因素有时间、遗传因素和激素等。而外源性衰老则主要局限于暴露的皮肤部位,如面部、颈部和手部,导致外源性皮肤老化的因素,包括阳光、空气污染、香烟、营养因素、温度、压力等。因此,外源性衰老是基于内在衰老,并受环境因素的影响而导致的。而引起外源性衰老中最重要的因素是紫外线,故而外源性衰老也称作光老化[2]。
1 皮肤衰老的临床及组织学特征
皮肤由外表皮层、内真皮层、皮下组织及皮肤附属器组成。表皮是多层上皮,主要由角质形成细胞组成。角化细胞的一种特殊形式的程序性细胞死亡——角化为环境提供了有效且持续更新的屏障[3],除表皮细胞外,表皮还存在黑色素细胞网络,黑素细胞产生黑色素,保护人体免受紫外线辐射,此外还包括免疫系统的树突状抗原呈递细胞网络,即朗格汉斯细胞。这些网络相互协调以维持皮肤功能正常运作[4]。不同细胞间的协调性随年龄增加而下降,导致皮肤衰老。相较表皮,真皮细胞密度较低,主要由含大量蛋白质和特殊碳水化合物的细胞外基质(ECM)组成,细胞成分主要是成纤维细胞,其可分泌合成ECM。皮肤油脂的分泌受雄激素和肾上腺皮质激素的调节,而随着年龄增长,激素分泌减少使得皮脂分泌减少,且伴随皮脂腺萎缩、数目减少等。此外,皮肤水合能力也随着年龄增加而下降,使皮肤呈渐进性老化[5]。皮肤的内在衰老和外在衰老在临床和组织学方面存在相似之处,但也有着明显的不同。
1.1 皮肤内在衰老的临床与组织学特征 临床上皮肤自然老化的特征包括皮肤变薄、干燥、细小皱纹、弹性降低、色素异常沉着等[6]。随着年龄增长而发生的变化之一是表皮网状脊的丧失导致的表皮层变薄,这种变化伴随着真皮乳头的衰减和丧失,其中包含部分负责表皮营养的精致毛细血管袢。此外,网脊的衰减也导致皮肤抵抗剪切力的能力下降[7]。组织学上表现为表皮变薄,表皮与真皮结合处变平萎缩,胶原蛋白、弹性蛋白等ECM含量减少,真皮层变薄[8]。随着年龄增长,皮肤细胞数目减少且功能减退。表皮中角质形成细胞增殖分化减少,黑素细胞和朗格汉斯细胞减少;真皮中成纤维细胞、肥大细胞等细胞数量减少,体积变小[9]。
1.2 皮肤外在衰老的临床与组织学特征 光老化在皮肤上的临床表现包括表皮增厚、皮肤粗糙、失去弹性、皱纹粗大加深、毛细血管扩张、异常色素沉着[6],出现皮肤癌的可能性更高[10]。相较自然老化中成纤维细胞的数目减少、活性降低,光老化中的成纤维细胞功能亢进,且真皮内炎症细胞的数目增加,其释放的细胞因子可刺激蛋白水解酶的表达,进而引起胶原蛋白和弹性蛋白等ECM的降解。严重光老化皮肤中还可见真皮内堆积的大量变性、蓬乱增生的弹性纤维,这些物质的积累导致皮肤增厚粗糙、失去弹性[5]。此外,黑素细胞合成黑色素异常增多导致严重的色素沉着,且光老化皮肤常伴有血管壁增厚,血管周围常有炎性细胞浸润,血管网排列紊乱等[9]。
2 皮肤衰老的分子机制
皮肤衰老涉及多种机制和信号通路,其中氧化应激起着关键作用。光老化虽然在临床与组织学上与皮肤内在衰老存在明显差异,但它是发生在内在衰老的基础之上,由紫外线加速皮肤衰老过程,两者具有共同的分子机制[11]。因此,以下将从紫外线对皮肤的影响、氧化应激、细胞衰老及ECM降解4个方面对皮肤衰老的机制进行讲述。
2.1 紫外线在光老化中的作用及机制 光老化主要是由皮肤暴露在紫外线下造成的。紫外线辐射(UVR)有3种类型:UVA (320~400 nm)、UVB (280~320 nm)和UVC (100~280 nm)。其中UVC被臭氧层吸收,因此只有UVA和UVB到达地球表面。由于UVB波长较短,大多数被表皮吸收,仅一小部分到达乳头状真皮层。而UVA可以深入表皮[12]。与UVA相比,UVB优先被吸收紫外线的分子,如芳香氨基酸、DNA、不饱和脂质等发色团吸收,并在结构上对其进行转化,引发UVA之间或与其他分子间的化学作用,发挥生物功能。例如,DNA对中波紫外线的吸收形成嘧啶二聚体,引起DNA突变。UVA辐射则通过促进氧化损伤,通过增加活性氧(ROS)水平间接导致DNA损伤。DNA损伤的大量积累导致p53激活,可能诱导健康角化细胞凋亡[13]。
紫外线辐射产生ROS,引起破坏性氧化应激,还可以激活花生四烯酸途径,介导炎症反应[14]。而DNA损伤也可通过不同途径诱导炎症反应,炎症也会引发DNA损伤,导致恶性循环,进而加剧皮肤光老化过程[15-16]。此外,UVR还会刺激皮肤ECM成分如胶原蛋白、弹性蛋白和糖蛋白的降解。UVR暴露显著增加基质金属蛋白酶(MMPs)的表达和分泌,诱导ECM蛋白降解[17]。而弹性蛋白及其剪接变体表达的增加又可引起光老化皮肤中弹性蛋白及其片段的真皮积累,这一过程被称为太阳弹性症[18]。ECM成分的病理改变可促进组织纤维化和细胞衰老,并引发炎症反应[19]。总之,紫外线辐射直接或间接地扰乱皮肤的内稳态,诱发细胞应激,从而加剧皮肤衰老。
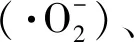
2.2.1 ROS来源:ROS的来源包括各种酶和非酶物质,如线粒体电子传递链、环加氧酶、过氧化物酶体氧化酶、还原型辅酶Ⅱ(NADPH)氧化酶和脂加氧酶。电子传递链位于线粒体内膜内,ROS作为线粒体有氧代谢电子传递链的副产物不断产生,在皮肤中,大约1.5%~5%的氧气消耗通过内在过程转化为ROS[21]。但线粒体对皮肤中ROS产生的贡献仅在干细胞中显著,因为在角化过程中,角质形成细胞降解了包括细胞核、线粒体、过氧化物酶体和内质网在内的细胞器。近年的研究发现,内质网以及过氧化物酶体产生的ROS与线粒体一样多,甚至更多[22]。在过氧化物酶体中充满了各种各样的酶,其中黄酮类酶/氧化还原酶可产生H2O2作为副产物。过氧化物酶体不仅产生H2O2,而且还能像线粒体一样形成超氧化物。内质网则主要通过细胞色素P450家族成员以及蛋白质二硫异构酶PDI和内质网氧化还原蛋白-1 (ERO1)的组合产生ROS[23]。皮肤是人体与环境的界面,因此经常接触污染物、外来生物和紫外线照射,这些外源性因素导致产生的ROS则称为外源性ROS,其中又以紫外线照射引起的ROS在皮肤衰老中起的作用尤为重要。
2.2.2 抗氧化系统:人体细胞对ROS损伤具有多种保护机制,消除自由基的最重要的抗氧化酶是谷胱甘肽过氧化物酶(GPx)。这种抗氧化酶可以通过与谷胱甘肽的巯基反应去除单线态氧、H2O2和有机过氧化物。其他抗氧化酶还包括超氧化物歧化酶(SOD)和过氧化氢酶,它们分别消除超氧化物自由基和H2O2。非酶促抗氧化剂包括泛醇、类胡萝卜素、维生素C(抗坏血酸)和维生素E等[22]。为了应对多种来源的ROS,皮肤也发展出复杂独特的抗氧化机制。研究发现,大多数抗氧化剂在表皮中的浓度高于真皮层,角质层的抗氧化能力主要依赖于SPRR蛋白家族,这些蛋白质可以通过形成分子内二硫键来抑制ROS[24]。
2.2.3 ROS对皮肤细胞的损伤:当体内ROS产生过多时,可损伤DNA、蛋白质、脂质,进而对细胞产生损伤。ROS可通过与DNA碱基的相互作用直接破坏DNA,目前研究最多的DNA损伤类型是由单线态氧介导的鸟嘌呤氧化成8-氧鸟嘌呤(8-oxoG),它的核苷酸类似物8-氧脱氧鸟苷(8-oxo-dG)在复制过程中通过配对腺嘌呤而不是胞嘧啶分子,以及将鸟嘌呤转化为胸腺嘧啶分子,产生GC到TA的转化,导致细胞功能异常[24]。此外,ROS还可损伤RNA,这些氧化损伤导致翻译效率降低,进而引起蛋白质异常和酶功能异常[25]。
ROS的另一个靶标是线粒体DNA (mtDNA)。由于缺乏修复机制和组蛋白,mtDNA易发生氧化应激诱导的损伤,并且比基因组DNA具有更高的突变频率。单线态氧由UVA和光敏剂相互作用反复产生,可引起mtDNA的大规模缺失。mtDNA的这种损伤导致电子传递链和氧化磷酸化过程的缺陷,最终导致ATP产生减少。氧化磷酸化受损也会增加单线态氧的产生,从而导致更多的mtDNA突变[26]。反复暴露于UVA后,成纤维细胞发生mtDNA缺失,并通过线粒体和细胞核之间的逆行途径导致基因表达模式改变,而成纤维细胞的功能和结构变化会影响皮肤结构,如胶原蛋白,并导致皮肤光老化[27]。
ROS还可影响脂质和蛋白质。脂质过氧化不饱和脂肪酸链的ROS产生脂质氢过氧化物作为主要产物,它们对DNA碱基具有反应性,可通过产生无法修复的MDA-DNA加合物损伤DNA[28],而膜脂损伤又可导致膜流动性改变、细胞膜渗漏或膜结合细胞受体功能障碍。当某些氨基酸在氧化应激中转化为氧化形式时,蛋白质会发生修饰和随后的构象变化,氧化反应产生的活性物质还可以氧化其他生物靶点并诱导蛋白质交联[27]。此外,氨基酸可以被不同途径产生的不同ROS氧化,如单线态氧主要破坏氨基酸的侧链,而侧链的氧化可导致有关蛋白质或酶的性质和功能发生变化[29]。
2.2.4 ROS对皮肤衰老相关信号通路的影响:尽管少量ROS的存在已被证明对维持身体或细胞的健康有益,如激活环加氧酶和脂加氧酶,调节炎症过程等[30],但ROS仍诱导和加速包括皮肤老化在内的衰老过程,同样,光老化的发生也与ROS的产生有关[31]。紫外线会导致ROS增加,而ROS可通过刺激丝裂原活化蛋白激酶(MAPK)和激活由c-Fos和c-Jun组成的异二聚体激活蛋白1 (AP-1)诱导MMPs的合成[32]。MMPs可以降解ECM中的胶原蛋白和弹性蛋白,促进皮肤衰老。此外,ROS和活化的MAPK信号通路可以激活NF-κB,从而影响介导炎症的多种细胞因子的表达[33]。另外,活化的NF-κB可调节血红素氧合酶-1 (HO-1)的表达,间接增加细胞中游离铁的水平,从而通过Fenton反应促进ROS的进一步产生[34]。
2.3 细胞衰老在皮肤衰老中的作用及机制 细胞失去增殖能力,进入不可逆的细胞周期停滞状态,被称为细胞衰老或复制性衰老。衰老的细胞停滞在有丝分裂的G1期,且对有丝分裂 E2F信号不敏感[35]。衰老细胞的特点是不能增殖、不能抗凋亡、分泌促进炎症和组织恶化的因子,这种特殊的分泌状态被称为衰老相关分泌表型(SASP)[36]。细胞衰老既可以发生在生理状态如组织修复过程中,也可发生在病理状态如癌症中[37]。生理状态下,诱导细胞衰老的信号是端粒缩短和功能障碍(即所谓的复制性衰老)。其他因素如直接和持续的DNA损伤、氧化应激、肿瘤抑制因子或原癌基因的激活、线粒体功能障碍也可诱导细胞衰老[2]。衰老细胞通常表现为形态异常,如体积增大、变平、颗粒增多等,衰老相关β-半乳糖苷酶(SA-β-Gal)目前被认为是识别衰老细胞的金标准[38]。
衰老在伤口愈合过程中可防止纤维化,抑制肿瘤形成,但它也是导致年龄相关疾病的主要因素[39]。衰老是由衰老过程中发生的端粒缩短和基因组不稳定引发的,由于皮肤持续暴露于UVR和污染等外部压力源,累积的环境因素可能会促进衰老和炎症表型,而衰老细胞的积累可导致慢性炎症和代谢功能障碍,进一步加剧皮肤的衰老过程[40]。
目前认为成纤维细胞的衰老在皮肤衰老中起主要作用。成纤维细胞是构成皮肤真皮层的主要细胞类型,它们产生ECM的组成部分。在UVR照射下可检测到细胞周期蛋白依赖性激酶p16INK4a和p21以及肿瘤蛋白p53水平升高,衰老相关SA-β-gal的表达增加,核层蛋白B1(Lamin B1)减少[41],表明成纤维细胞获得衰老样表型。随后衰老成纤维细胞数量的增加导致产生富含促炎细胞因子的SASP,包括IL-1、IL-6、IL-8、IL-18、MMPs和各种其他炎症趋化因子,这些细胞因子可以诱导c-Jun N-末端激酶(JNK)和转录因子激活蛋白(AP-1),它们随后激活MMPs,导致胶原蛋白分解和弹性丧失,从而形成皱纹[42]。成纤维细胞可以释放对调节表皮细胞增殖和分化平衡至关重要的胰岛素样生长因子(IGF)-1,而衰老成纤维细胞由于功能失调线粒体中超氧阴离子的产生增加,IGF-1信号明显降低。IGF-1通路的抑制不仅抑制真皮层胶原合成,而且由于DNA损伤诱导的磷酸化组蛋白、γH2AX和p16INK4a阳性表皮细胞的积累增加,导致表皮萎缩[43]。此外,在衰老的成纤维细胞中ROS浓度的增加还会增强AP-1和NF-κB依赖的信号通路,从而导致炎症[44]。
与成纤维细胞相比,皮肤角质形成细胞的周转率更高,因此对皮肤衰老的影响仅限于表皮。UVR产生ROS可导致MAPKs的磷酸化,随后激活细胞外信号调节激酶(ERK)、p38和JNK, 这些分子随后激活AP-1的c-Jun和c-fos成分,进一步增加MMPs的表达。其他升高的SASP包括促炎细胞因子,如TNF-α、IL-1α、IL-1β和IL-6[45]。此外,最近一项关于黑素细胞衰老的研究报道,衰老的黑素细胞SASP以旁分泌方式诱导端粒功能障碍,并通过激活CXC趋化因子受体3(CXCCR3)依赖性线粒体ROS来限制周围细胞的增殖。因此,衰老的黑素细胞会影响和损害基底角化细胞的增殖,并导致表皮萎缩[46]。
2.4 ECM降解在皮肤衰老中的作用及机制 如前所述,氧化应激及细胞老化过程中都存在ROS通过刺激丝裂原活化蛋白激酶(MAPK)和激活由c-Fos和c-Jun组成的异二聚体AP-1诱导MMPs的合成[47]。MMPs可以降解ECM中的胶原蛋白和弹性蛋白,其中胶原酶(MMP-1)是唯一能够分解完整纤维性胶原的MMP,其他类型的MMP,如92 kDa明胶酶(MMP-2)、基质裂解酶(MMP-3)和72 kDa明胶酶(MMP-9)可以进一步分解降解的胶原片段[48]。此外,NF-κB和AP-1可以降低基质金属蛋白酶抑制剂(TIMPs)的转录水平,而TIMPs/MMPs的下降更有利于进一步降解胶原和弹性蛋白[49]。
转化生长因子-β(TGF-β)通过Smad途径促进ECM形成,是诱导Ⅰ型前胶原合成和分泌的主要途径之一。而UVR可通过激活AP-1下调TGF-βⅡ型受体的表达,影响下游Smad/TGF-β信号通路,进而减少编码Ⅲ型和Ⅰ型胶原前体的COL3A1和COL1A1基因的转录,间接减少胶原的生物合成[50]。因此,TGF-β/SMAD信号受损可使胶原合成减少,导致真皮变薄。
3 小结
皮肤作为体表器官,其衰老得以最直观的感受。而皮肤衰老除了由遗传、年龄等因素导致的内源性衰老,还有主要由紫外线引起的光老化。两者虽然在临床和组织学方面存在较大差异,但其分子机制是相关联的。自然老化主要由于体内产生的过多ROS引起,光老化则是在此基础上由UVR进一步加剧ROS的产生,而ROS的产生造成DNA、蛋白质、脂质的损伤,引起细胞衰老。此外,氧化应激和细胞衰老又可通过激活多条信号通路引起ECM的降解,导致皮肤衰老。

