猪流行性腹泻病毒抑制干扰素λ的病毒蛋白筛选及验证
高杰,朱雪蛟,范宝超,宋诗莹,3,许信刚,李彬*
(1. 西北农林科技大学动物医学院,陕西 杨凌 712100;2. 江苏省农业科学院兽医研究所,江苏 南京 210014;3. 西藏农牧学院动物科学学院,西藏 林芝 860000)
猪流行性腹泻(porcine epidemic diarrhea,PED)最早可追溯到1971年,首次在英国被发现,随后流行于世界多个地区和国家[1],2010年在中国首次暴发,造成的仔猪死亡率可高达90%[2-3]。
PED是由猪流行性腹泻病毒(porcine epidemic diarrhea virus,PEDV)导致的急性、高传染性的病毒性肠道疾病,仔猪发病率高,死亡率高[4-5]。PEDV属冠状病毒科冠状病毒属,基因组为28 kb正链RNA,整个基因组至少包含了7个开放阅读框(open reading frame,ORF),按照5′-ORF1a/1b-S-ORF3-E-M-N-3′排序[6],其中包含了S、E、M、N 4种结构蛋白和16种非结构蛋白,ORF3编码了一种离子通道蛋白,被认为是与毒力相关的辅助蛋白[7-9],S蛋白对于PEDV至关重要,主要负责与细胞上的受体结合,介导病毒与细胞融合,被认为是影响致病性和组织嗜性的相关蛋白[10-12]。
干扰素(interferon,IFN)是应对病毒性感染先天性免疫中重要的组成部分,其3种类型中(Ⅰ、Ⅱ和Ⅲ型),Ⅲ型IFN-λ被发现是IL-10细胞因子超家族成员[13-14]。人类有4种IFN-λ,分别是IFN-λ1、IFN-λ2、IFN-λ3和IFN-λ4;猪主要有IFN-λ1和IFN-λ3,IFN-λ2和IFN-λ4尚未确定[15-16]。Ⅰ型和Ⅲ型IFN的诱导过程和作用机制相似[17-19],但由于特异性受体的表达高度受限,Ⅲ型IFN反应主要局限于上皮细胞[19]。肠上皮细胞在病毒感染后主要对Ⅲ型IFNs作出抗病毒防御反应,而肠道中的其他细胞类型依赖于I型IFN[20]。在抗PEDV感染效果上,IFN-λ1对PEDV感染的IPEC-J2细胞抗病毒活性高于猪IFN-α,且IFN-λ3较IFN-λ1有更好的抗病毒效果[21-22]。然而,病毒可以突变出多种逃逸IFN的方式,通过NSP1和N蛋白抑制IFN-λ水平[23-24]。但与之相关的报道尚不是很多。由于IPEC-J2细胞并非均质,其中只有少数对PEDV易感[23,25]。本实验室IPEC-J2细胞均为PEDV不易感细胞株。MARC-145为PEDV易感细胞,是常被用作研究PEDV的宿主细胞之一[26]。因此,试验中用MARC-145对PEDV感染过程中的分子机制进行进一步探索,对了解PEDV如何逃逸IFN-λ机制对PED的防治工作具有重要意义。
1 材料与方法
1.1 载体、菌株、病毒和细胞
大肠杆菌Trans5α感受态细胞购自北京Transgen公司;pGL3-Basic、pRL-TK质粒及PEDV结构与非结构蛋白真核表达重组质粒由本实验室构建并保存[27];猪小肠上皮细胞(IPEC-J2),非洲绿猴胚胎肾细胞(MARC-145),由江苏省农业科学院兽医研究所保存提供;PEDV分离株AH2012/12(登录号:KU646831.1)由江苏省农业科学院兽医研究所分离、扩增和保存[28]。
1.2 主要试剂耗材
胎牛血清购自Gibco公司;PEDV-N蛋白鼠单克隆抗体由本实验室保存;GAPDH小鼠单克隆抗体,购自Protein Tech公司;HRP 标记山羊抗鼠 IgG (H+L)购自Solarbio公司;细胞总RNA提取试剂盒FastPure Cell/TissueTotal RNA Isolation Kit V2,高保真酶Phanta Max MasterMix,逆转录酶HiScript Ⅱ 1st Strand cDNA Synthesis Kit和荧光定量试剂SYBR Green ChamQ SYBR qPCR Master Mix,均购自诺唯赞公司;F12/DMEM培养基,DMEM高糖培养基,脂质体转染试剂盒LipofectimineTM3000,限制性核酸内切酶SacⅠ、HindⅢ、XhoⅠ,购自Thermo Fisher公司;Poly(I:C)HMW购自InvivoGen公司;双荧光素酶报告基因检测系统Dual-Luciferase®Reporter Assay System购自Promega公司;T4 DNA连接酶购自ABclonal公司;质粒提取试剂盒Plasmid Mini Kit I,胶回收试剂盒Gel Extraction Kit,购自Omega公司;RIPA蛋白裂解液,全黑96孔细胞培养板,购自Beyotime公司。引物和质粒测序服务委托Sangon公司合成和提供。
1.3 引物设计与合成
在GenBank中查找pIFN-λ1(Gene ID:100217388)、pIFN-λ3(Gene ID:100310828)、PEDV AH2012/12的N基因(GenBank登录号:KU646831.1)和GAPDH 基因(GenBank登录号:XM_007967342.2),根据序列使用SnapGene设计定量检测引物。使用在线启动子预测软件Promoter-2.0(Promoter-2.0-Services-DTU Health Tech)分析预测pIFN-λ1和pIFN-λ3启动子区域序列,选取pIFN-λ1(-500/-1)和pIFN-λ3(-1500/-1)区域序列,使用SnapGene设计上下游含有酶切位点的重组引物。引物序列见表1。

表1 引物及序列
1.4 细胞培养及转染
MARC-145细胞使用10%常规胎牛血清的高糖DMEM培养基,IPEC-J2细胞使用10%常规胎牛血清的F12/DMEM培养基,在含5% CO2体积浓度的37 ℃恒温培养箱中培养。将生长状态良好且处于对数生长期的细胞接种于24孔板,待细胞生长至70%~90%融合时使用LipofectamineTM3000转染试剂依照说明书进行转染。
转录本水平筛选PEDV蛋白,MARC-145转染重组表达质粒12 h,同时设置空载体pLV转染孔做对照,再转染0.5 μg/mL Poly(I:C)12 h。启动活性水平筛选共转染pRL-TK 0.1 μg,启动子质粒1 μg和NSP5 1 μg,pLV空载为对照,12 h后转染0.5 μg/mL Poly(I:C)12 h。
1.5 PEDV感染MARC-145细胞
MARC-145细胞接种于24孔板长至单层(细胞数约105个),使用含有5 μg/mL胰酶浓度的高糖DMEM培养基稀释PEDV病毒原液,稀释至每孔加入200 μL病毒感染复数(MOI)=0.1,吸附90 min。吸附后用PBS清洗1遍细胞,每孔使用500 μL 5 μg/mL胰酶浓度的高糖DMEM培养基维持细胞生长。
1.6 重组质粒构建
使用细胞总RNA提取试剂盒FastPure Cell/TissueTotal RNA Isolation Kit V2中的gDNA去除柱吸附gDNA,洗涤液清洗后用洗脱液洗脱得到IPEC-J2细胞基因组DNA,以IPEC-J2细胞基因组DNA为模板扩增pIFN-λ1(-500/-1)和pIFN-λ3(-1500/-1)片段,PCR扩增体系及扩增程序依照高保真酶Phanta Max MasterMix说明书设置,1%琼脂糖凝胶电泳后依照胶回收试剂盒Gel Extraction Kit说明书纯化目的片段,经SacⅠ/HindⅢ、XhoⅠ/HindⅢ双酶切后使用T4 DNA连接酶连接到相同酶切处理且回收的线性pGL3-Basic载体上,构建得到荧光素酶报告基因载体pIFN-λ1-Luc、pIFN-λ3-Luc。转化大肠杆菌5α感受态细胞,涂布于氨苄固体培养基平板,37 ℃培养12 h,挑取单克隆菌落进行菌液PCR验证,验证正确的单克隆菌落进行扩大培养后提取重组质粒,经双酶切和测序验证重组质粒的正确性。
1.7 RNA提取和实时定量PCR(RT-qPCR)
去除细胞培养基,PBS清洗1遍,依照细胞总RNA提取试剂盒FastPure Cell/ TissueTotal RNA Isolation Kit V2说明书和逆转录酶HiScript Ⅱ 1st Strand cDNA Synthesis Kit说明书进行RNA提取和cDNA合成。使用荧光定量试剂SYBR Green ChamQ SYBR qPCR Master Mix检测细胞转录本pIFN-λ1、pIFN-λ3和PEDV-N相对水平。GAPDH基因作为内部参照。通过融解曲线分析确定特异性,靶基因的相对转录水平表示为相对于相应内参基因阈值周期(Ct值)的倍数变化,方法使用2-ΔΔCt法。
1.8 双荧光素酶报告基因检测
收取细胞样品时弃去上清液培养基,用PBS清洗1遍细胞,依照双荧光素酶报告基因检测试剂盒Dual-Luciferase®Reporter Assay System说明书加入150 μL裂解液,室温裂解20 min后将裂解液连同细胞收集在离心管中,12 000 r/min离心1 min,取上清液20 μL加入全黑96孔细胞培养板,依次加入萤火虫荧光素酶底物和海肾荧光素酶底物,每加入1种底物,使用酶联免疫分析仪读取荧光数值。
1.9 Western blot检测
蛋白样品的制备:弃掉细胞板中培养基,加RIPA裂解液,冰上裂解10 min,加蛋白上样缓冲液,混匀后金属浴煮沸10 min,SDS-PAGE分析并进行Western blot鉴定。用半干转膜法将蛋白转至硝酸纤维素膜上,5%脱脂奶粉封闭2 h,含0.05%吐温-20的磷酸盐缓冲液(PBST)洗膜3次,根据检测靶标选择对应抗体,4 ℃孵育过夜,PBST洗膜3次,室温孵育对应HRP二抗60 min,PBST洗涤3次,ECL曝光检测。
1.10 统计学分析
使用 GraphPad 8.0进行统计分析。对于每组单独的测定,至少评估3个独立的试验。结果表示为“平均值±标准差”。
2 结果与分析
2.1 pIFN-λ1和λ3启动子质粒构建及鉴定
使用细胞RNA提取试剂盒,裂解正常生长的IPEC-J2细胞,将基因组DNA吸附柱上的DNA洗脱作为模板进行PCR扩增,在500和1 500 bp左右各出现1条条带,与目的条带的大小一致(图1)。启动子区域序列扩增成功。将目的条带纯化回收,双酶切后连接在pGL3-Basic载体得到pIFN-λ1-Luc、pIFN-λ3-Luc,经菌液PCR、双酶切(图2)及测序验证重组质粒的正确性,结果表明重组质粒构建成功。

M. DNA 标准 DL2000;1. pIFN-λ1(-500/-1)扩增产物;2. pIFN-λ3(-1500/-1)扩增产物。图1 pIFN-λ1和pIFN-λ3启动子序列片段PCR结果
M. DNA标准DL2000;1. pIFN-λ1-Luc双酶切鉴定;2. pIFN-λ3-Luc双酶切鉴定。图2 pIFN-λ1-Luc和pIFN-λ3-Luc双酶切鉴定
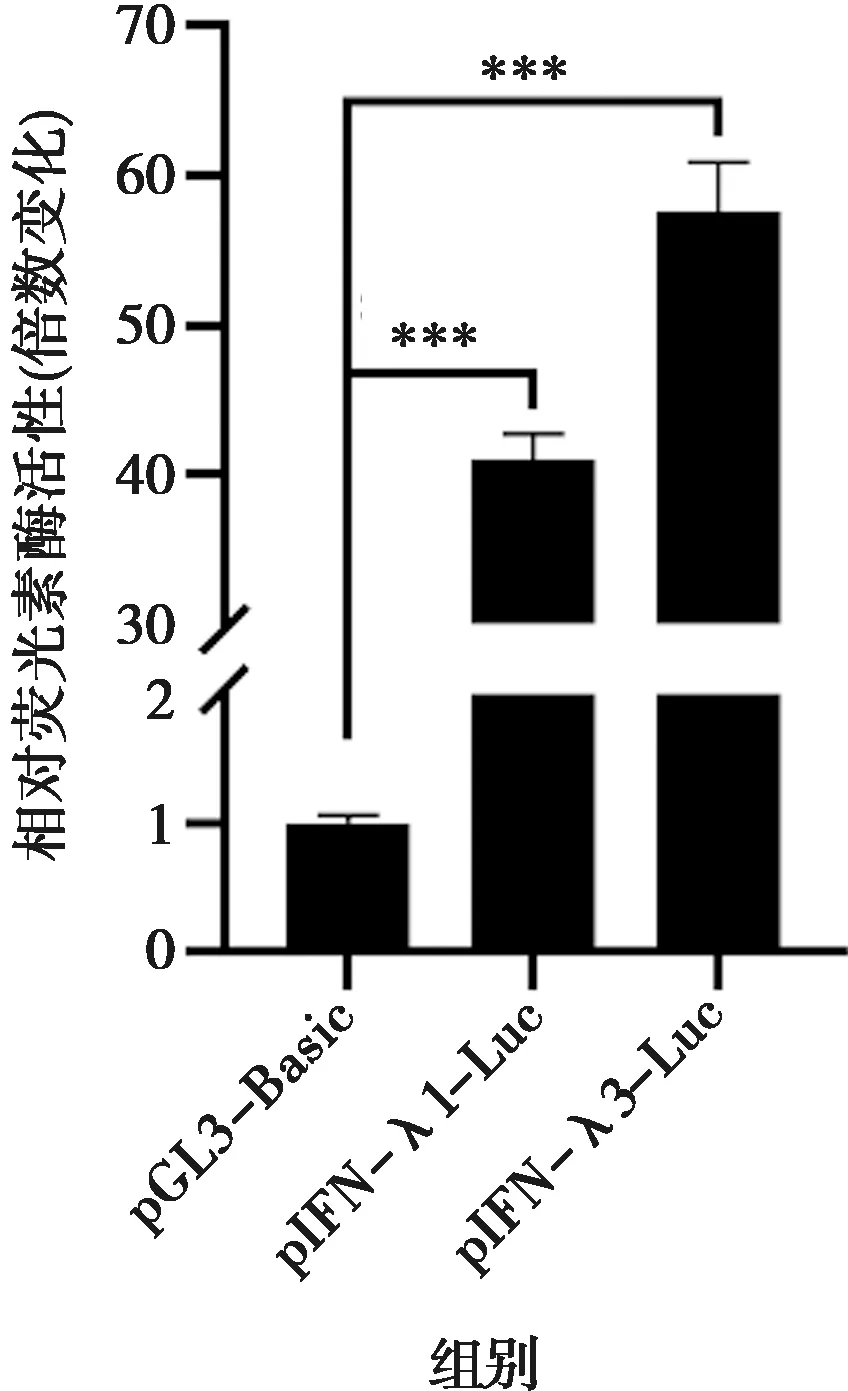
***表示P<0.001,下同。图3 pIFN-λ1和pIFN-λ3的启动子启动活性验证
2.2 pIFN-λ1-Luc和pIFN-λ3-Luc启动子活性的验证
IPEC-J2细胞接种24孔板长至70%以上融合,每孔共转染pRL-TK 0.1 μg和启动子质粒1 μg,12 h后再次转染0.5 μg/mL Poly(I:C)12 h,收取细胞样品进行双荧光素酶报告基因检测。结果与转染空载体的对照组相比,转染pIFN-λ1-Luc和pIFN-λ3-Luc的荧光数值极显著升高(P<0.001),证明pIFN-λ1和pIFN-λ3的启动子具有良好的启动活性。
2.3 PEDV感染对IFN-λ1和IFN-λ3转录水平的影响
MARC-145细胞接种24孔板,以MOI=0.1感染PEDV,以只转染0.5 μg/mL Poly(I:C)12 h的细胞为阳性对照,在感染后的0、4、8、12 h收取试验组细胞,用于实时荧光定量PCR和Western blot检测。结果显示,PEDV在MARC-145中可以复制(图4)。由图5可见,在感染PEDV 12 h引起IFN-λ1转录本水平显著降低,其余时间点均未引起IFN-λ1和IFN-λ3显著变化。
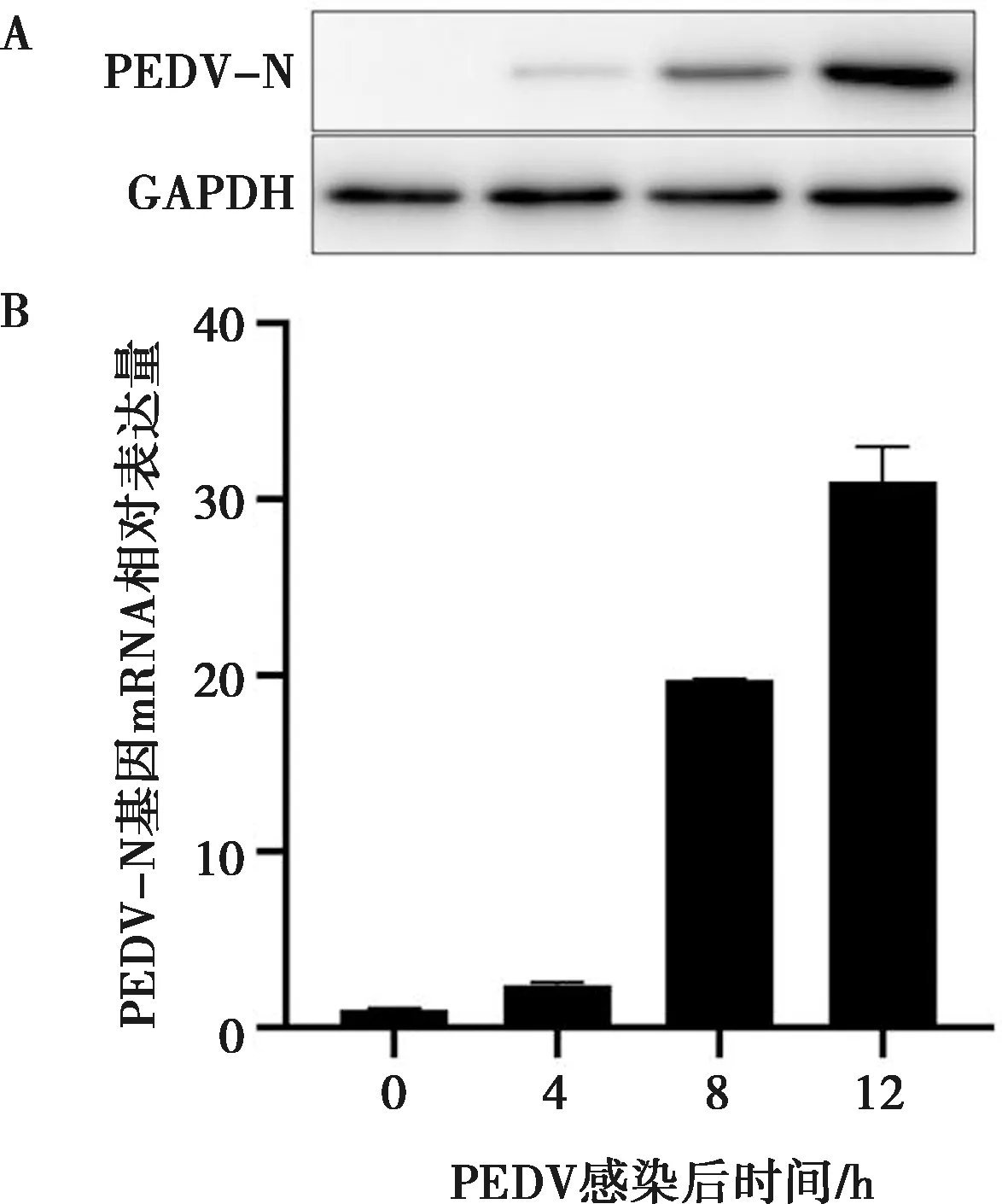
A. Western blot检测;B. 荧光定量PCR检测。图4 PEDV在MARC-145细胞上的增殖情况
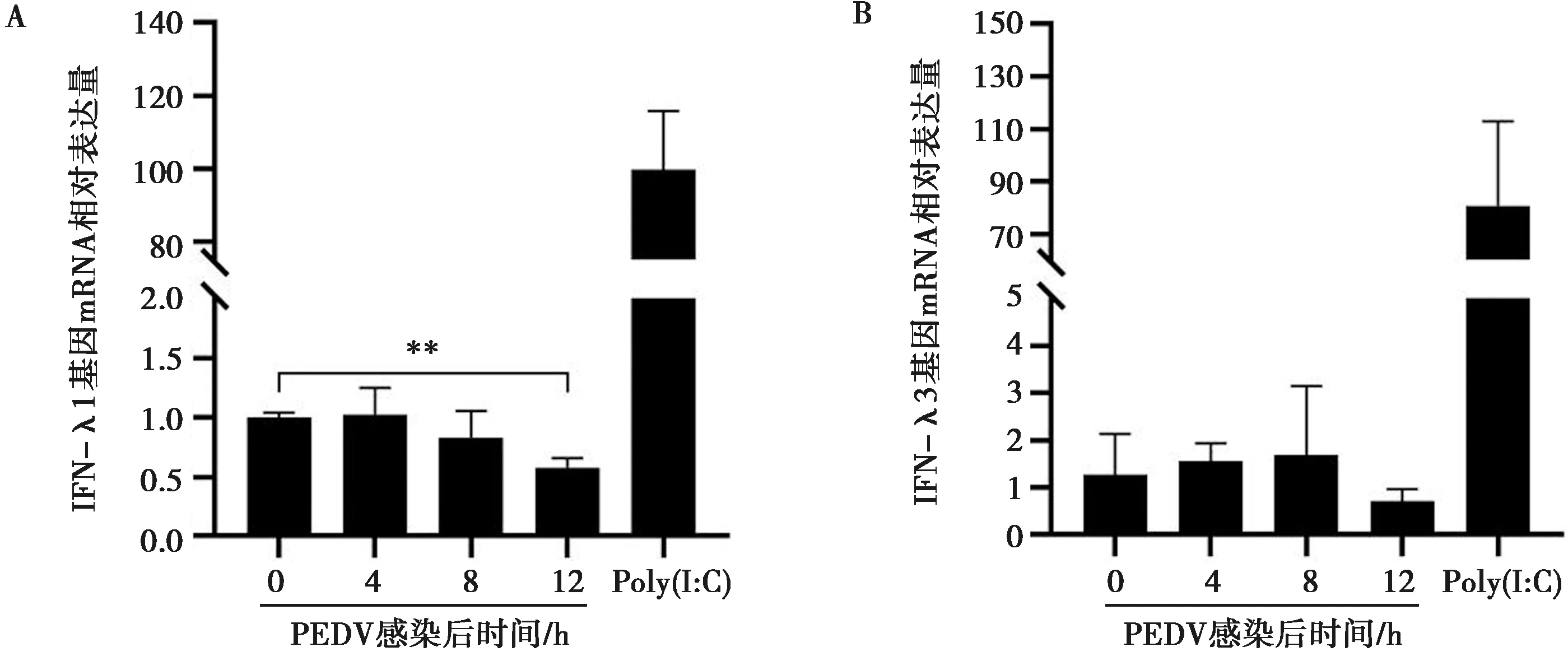
**表示P<0.01,下同;A. PEDV对IFN-λ1 mRNA的影响;B. PEDV对IFN-λ3 mRNA的影响。图5 细胞感染PEDV后IFN-λ转录水平的变化
细胞共转染pRL-TK和启动子萤火虫荧光质粒12 h,以MOI=0.1感染PEDV,以转染0.5 μg/mL Poly(I:C)12 h的细胞为阳性对照,感染后的0、4、12 h收取细胞样品进行双荧光素酶报告基因检测,结果发现,感染PEDV引起IFN-λ1和IFN-λ3启动活性显著升高(图6A、6B),但与阳性对照较高倍数升高相比,启动活性仍然较低。

*表示P<0.05,下同;A. PEDV对IFN-λ1启动水平的影响;B. PEDV对IFN-λ3启动水平的影响。图6 细胞感染PEDV后IFN-λ启动水平的变化
2.4 PEDV抑制Poly(I:C)诱导的IFN-λ1和IFN-λ3的升高
设置Mock组、Poly(I:C)组、PEDV组和PEDV+Poly(I:C)组。MARC-145细胞生长至单层感染PEDV,用基础培养基代替病毒液处理对照组,12 h后转染0.5 μg/mL Poly(I:C)12 h,结果表明感染PEDV组在转录本水平显著降低IFN-λ1和IFN-λ3(图7A、7B)。
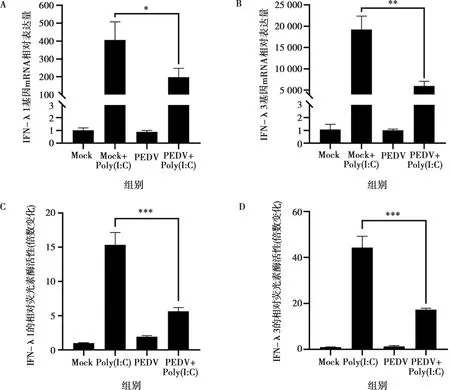
A. PEDV对Poly(I:C)处理的IFN-λ1 mRNA水平的影响;B. PEDV对Poly(I:C)处理的IFN-λ3 mRNA水平的影响;C. PEDV对Poly(I:C)处理的IFN-λ1启动水平的影响;D. PEDV对Poly(I:C)诱导的IFN-λ3启动水平的影响。图7 PEDV对Poly(I:C)处理的细胞的IFN-λ调控
为检测PEDV感染MARC-145细胞是否能引起Poly(I:C)激活的IFN-λ1和IFN-λ3启动活性变化,在细胞生长至70%融合时转染双荧光素酶报告基因质粒12 h,而后感染PEDV 12 h,再转染0.5 μg/mL Poly(I:C)处理细胞12 h,收取细胞进行双荧光素酶报告基因的检测。结果显示IFN-λ1的荧光素酶活性由阳性对照的15倍下降至6倍,IFN-λ3由40倍下降至不到20倍,表明PEDV抑制Poly(I:C)诱导的IFN-λ1和IFN-λ3升高(图7C、7D)。
2.5 筛选抑制IFN-λ1和IFN-λ3的PEDV蛋白
MARC-145细胞转染pLV-mCherry载体的PEDV蛋白重组质粒,在倒置荧光显微镜下观察到Cherry荧光(图8),表明所有重组质粒均正常表达。

A. NSP1;B. NSP2;C. NSP3;D. NSP4;E. NSP5;F. NSP6;G. NSP7;H. NSP8;I. NSP9;J. NSP10;K. NSP12;L. NSP13;M. NSP14;N. NSP15;O. E;P. M;Q. N;R. S;S. ORF3。图8 PEDV重组蛋白表达(100×)
MARC-145细胞转染PEDV重组表达质粒后再转染Poly(I:C)处理细胞,收取细胞样品检测转录本IFN-λ1和IFN-λ3的水平变化,结果显示NSP1、NSP5、NSP9和ORF3显著抑制IFN-λ1的表达(图9A),NSP1、NSP5、NSP8和ORF3显著抑制IFN-λ3的表达(图9C)。
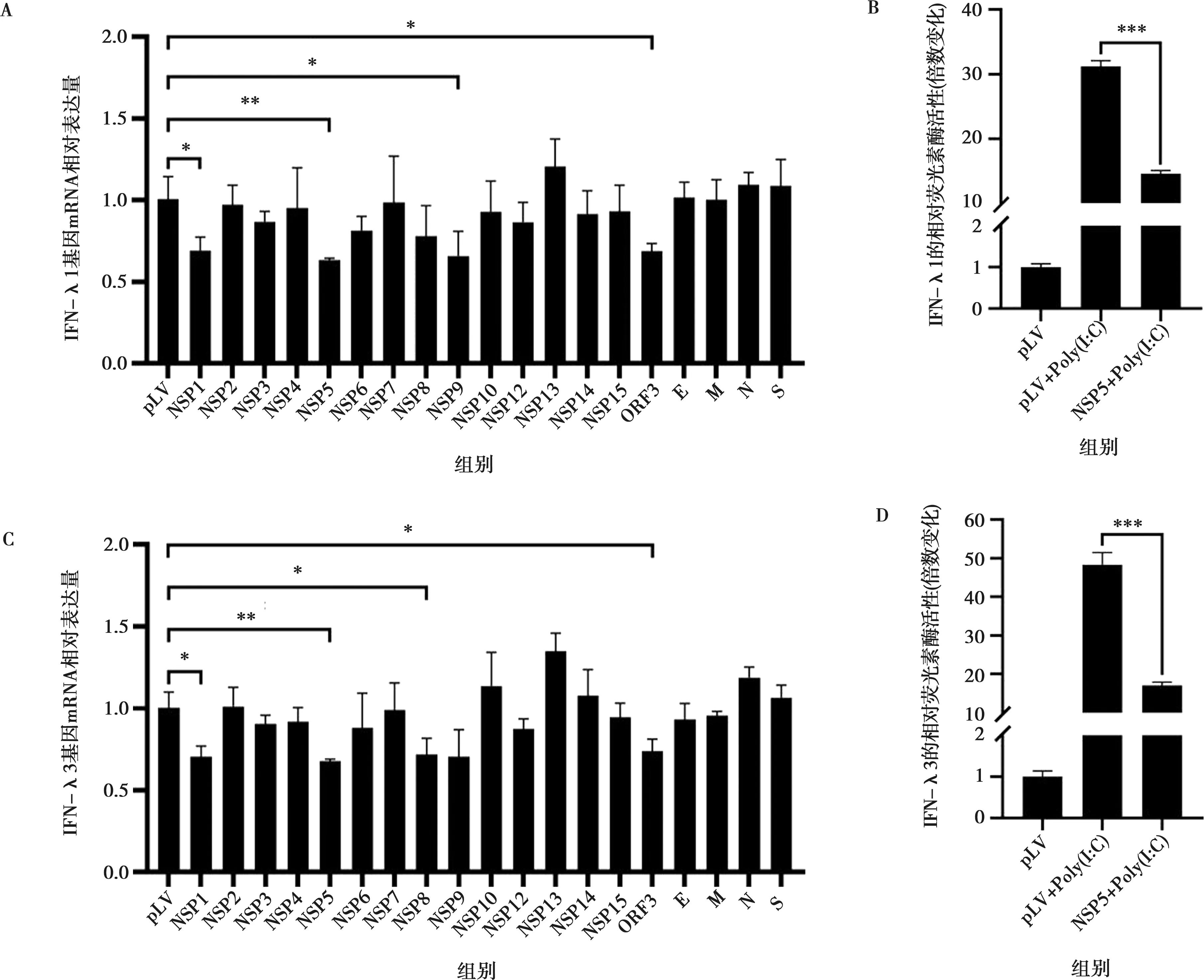
A.病毒蛋白对Poly(I:C)处理后IFN-λ1 mRNA水平的影响;B. 病毒蛋白对Poly(I:C)处理后IFN-λ3 mRNA水平的影响;C. NSP5对Poly(I:C)处理后IFN-λ1启动活性的影响;D. NSP5对Poly(I:C)处理后IFN-λ3启动活性的影响。图9 抑制IFN-λ1/3的PEDV蛋白筛选
为了进一步验证NSP5对IFN-λ1和IFN-λ3启动活性也具有抑制效果,利用双荧光素酶报告系统验证NSP5对IFN-λ1和IFN-λ3启动活性的作用。结果显示IFN-λ1和IFN-λ3的荧光素酶活性与阳性对照相比均下降至50%以下(图9B、9D),表明NSP5显著抑制了IFN-λ1和IFN-λ3的启动活性。
3 讨论
PEDV作为一种以粪口途径传播为主的病毒,其主要感染和增殖的部位是猪小肠上皮细胞[29]。因此,小肠黏膜是PEDV感染宿主所要突破的第一道防线。虽然Ⅰ型干扰素α和β已经是公认的重要抗病毒因子,但研究发现,其与Ⅲ型干扰素λ有明显的表达差异性,Ⅰ型干扰素α/β主要在肠道淋巴结中发挥抗病毒作用,而在肠道黏膜的表达水平远不及IFN-λ[30],且IFNL-λ已被证实具有良好的抵抗PEDV感染作用[21-22]。目前,Ⅰ型干扰素逃逸PEDV感染的机制已得到广泛研究,但有关PEDV逃逸IFN-λ的研究鲜有报道。现有文献报道,NSP1、NSP3、NSP5、NSP8、NSP14、NSP15、NSP16、ORF3、E、M和N均有可能参与了逃逸宿主IFN-λ1的过程,其中以NSP1、NSP14和ORF3抑制效果较为显著,NSP1阻断IRF1的核易位并减少过氧化物酶体的数量以抑制IRF1介导的Ⅲ型IFN[23];N蛋白通过阻断NF-κB的核易位干扰IFN-λ的产生[24]。但更多分子作用机制尚不明确,PEDV蛋白介导的IFN-λ免疫逃逸机制仍有巨大的探索空间。
试验中首先确定了PEDV感染MARC-145细胞未能引起IFN-λ1/3转录本水平的升高,启动活性有3至5倍升高,又将感染PEDV的细胞使用Poly(I:C)处理,证实了PEDV在转录本水平和启动活性水平都具有抑制IFN-λ1/3的能力,最后对不同PEDV蛋白进行筛选和验证,NSP1、NSP5、NSP8、NSP9和ORF3均有对IFN-λ的抑制效果,其中NSP5对IFN-λ的下调作用最为显著,且抑制IFN-λ3效果较抑制IFN-λ1更为明显。整个试验运用了荧光定量PCR和报告基因两种方法,试验结果相互佐证,检测IFN-λ转录本水平的变化,通过报告基因检测则有更加灵敏、重复结果稳定的优势。

