茅台镇8家酒企高温大曲的群落结构及其空间特征
马叶胜,余苗,王冕,曹润洁,何宏魁,马金同,叶方平
1.安徽瑞思威尔科技有限公司,安徽 亳州 236800;2.安徽古井贡酒股份有限公司,安徽 亳州 236800
0 引言
高温大曲一般是以小麦为原料制成,制曲过程中品温可达 65 ℃左右,主要用于生产酱香型白酒[1]。高温大曲具有丰富的微生物群落、酶系和白酒风味物质前体[1]。近年来,国内相关研究[2]表明,高温大曲品质主要受环境、气候和制曲工艺影响,可能导致其微生物组成、酶系及各种理化指标不同。高温大曲的主要微生物群落为真菌和细菌,同时含有少量古菌[2]。
已有研究表明,高温大曲群落结构存在地域性差异。例如,王晓丹等[3]对两种来自遵义市茅台镇和一种来自遵义市北郊十字铺的高温大曲细菌群落进行解析发现,3种高温大曲的细菌群落门水平以厚壁菌门为主,属水平以高温放线菌属(Thermoactinomyces)为主,且高温大曲细菌群落表现出了异质性。王颖等[4]对赤水河上游和赤水河中下游两个产区酒企的高温大曲进行微生物群落解析发现,赤水河上游产区高温大曲的蛋白酶活性普遍高于赤水河中下游产区,两个产区的高温大曲理化指标存在一定差异。侯强川等[5]对贵州遵义和湖北襄阳两个地区的高温大曲进行了研究,发现襄阳高温大曲与茅台高温大曲的细菌优势菌属组成较一致,主要是芽胞杆菌属、嗜热放线菌属、葡萄球菌属、Kroppenstedtia等,但不同优势菌属之间的相对丰度存在差异。此外,从高温大曲中共确定了259种挥发性成分,其中酯类和醇类最多,其次是吡嗪类、醛类、酮类、酸类、酚类、呋喃类、其他杂环类、内酯类、醚类、含硫类、芳香烃类、脂肪烃等[6-7]。目前,关于大尺度空间上高温大曲的理化性质、挥发性成分、微生物群落结构等的报道很多[3-5],但对酱香酒核心生产区茅台镇不同酒企小尺度空间内高温大曲的理化性质、挥发性成分、微生物群落结构的差异性报道较少。
基于此,本文拟采用高通量测序手段对茅台镇8家酒企高温大曲的差异性进行研究,系统解析其真菌和细菌群落结构,探究理化指标与高温大曲主要优势群落的相关性,结合高温大曲的主要挥发性成分,揭示茅台镇8家酒企高温大曲群落结构的空间特征,以期为优化高温大曲生产工艺提供参考。
1 材料与方法
1.1 材料与试剂
实验材料:高温大曲样品,取自贵州省遵义市仁怀市茅台镇8家酱香型白酒生产厂家,8家酒企均位于赤水河东,分别编号为H1—H8,H1在茅台镇中心北向1 km内、H2在茅台镇中心东北向1 km内、H3在茅台镇中心北向1~2 km内、H4在茅台镇中心东北向1~2 km内、H5在茅台镇中心北向5 km外、H6在茅台镇中心东北向5 km外、H7在茅台镇中心北向5~10 km内、H8在茅台镇中心东北向5~10 km内,高温大曲出房时间均为2019年10月,取样时间为2020年4月。采样方式为在曲库中采用五点取样法随机取样5块高温大曲,粉碎后混匀,作为该厂家代表样品。
实验试剂:NaOH、浓H2SO4、氯化钴、可溶性淀粉、无水乙酸钠、冰乙酸、酚酞,均为分析纯,国药集团化学试剂有限公司;重铬酸钾、铬黑T,均为分析纯,上海沪试化工有限公司;孟加拉红培养基、LB培养基,青海海博生物技术有限公司;薄荷醇(纯度99.5%),色谱纯,上海化科实验器材有限公司;Omega Stool DNA Kit试剂盒,美国MoBio公司。
1.2 主要仪器与设备
HerathermIMH400-S型生化培养箱、5906型超低温冷冻冰箱,美国ThermoFisher科技公司;ME204E型分析天平,梅特勒-托利多公司(上海);SX-700型蒸汽灭菌锅,日本TOMY公司;7890B型气相色谱-质谱联用仪,安捷伦科技有限公司;MiSeq型高通量二代测序仪,美国Illumina公司。
1.3 实验方法
1.3.1 理化性质测定样品水分、酸度、液化力、糖化力、发酵力的测定参照《酿酒大曲通用分析方法》(QB/T 4257—2011)[8],酸性蛋白酶活力的测定参照《蛋白酶制剂》(GB/T 23527—2009)[9]。
1.3.2 微生物数量测定本实验采用传统稀释平板涂布法测定酒曲中的可培养微生物数量。制备高温大曲10-5~10-1梯度稀释液,利用孟加拉红培养基计数酵母菌和霉菌;利用LB培养基计数细菌;将高温大曲梯度稀释液置于80 ℃水浴10 min后,涂布于LB培养基用于计数芽孢杆菌。
1.3.3 挥发性成分测定准确称取1.00 g固态发酵产物于20 mL顶空瓶中,加入20 μL薄荷醇溶液(100 mg/L);将上述顶空瓶在50~60 ℃孵化器中恒温40 min后,将顶空针插入顶空瓶中,吸取1000 μL挥发性气体,将顶空针插入气相色谱-质谱联用仪的气相色谱进样口,在230 ℃条件下进样、分析;顶空针为2.5 mL Spritze-HS。
色谱条件:进样口温度为230 ℃,载气为He,流速为1 mL/min,不分流进样;60 m×0.25 mm×0.25 μm DB-WAX 为一维柱,2 m×0.18 mm×0.18 μm Rtx-200 为二维柱,两根色谱柱通过毛细管柱连接器以串联方式连接;调制器设置为不工作。升温程序设置为一维柱温箱初始柱温40 ℃保持2 min,以2 ℃/min的速率升温至100 ℃,然后以4 ℃/min的速率升温至180 ℃,再以6 ℃/min的速率升温至230 ℃,保持15 min;二维柱温箱初始温度45 ℃,保持2 min,以2 ℃/min的速率升温至105 ℃,然后以4 ℃/min的速率升温至185 ℃,再以6 ℃/min的速率升温至235 ℃,保持15 min。
质谱条件:质谱检测器为飞行时间质谱,EI离子源温度为200 ℃,传输线温度为250 ℃;电离电压为70 eV,采用全扫描方式,质量采集范围为33~400 amu,采集频率为10张全谱图/s,检测器电压为1600 V。
1.3.4 基因组提取及高通量测序参照Omega Stool DNA Kit试剂盒说明书提取高温大曲样品基因组DNA后,采用 1%琼脂糖凝胶电泳和分光光度法进行质量和浓度检测,质检合格的样品采用干冰低温冷冻运输至南京奥维森基因科技有限公司进行高通量测序。ITS采用ITS3-ITS4通用引物,即5′-GCATCGATGAAGAACGCAG-3′,5′-TCCTCCGCTTAT
TGATATGC-3′;16S采用16S V3-V4通用引物,即338F(5′-ACTCCTACGGGAGGCAGCAG-3′)和806R(5′-GGACTACNNGGGTATCTAAT-3′)。
1.4 数据分析
根据Barcode序列,下机数据利用QIIME1(v1.8.0)[10]软件拆分,使用Pear(v0.9.6)[11]软件对数据进行过滤、拼接;利用Vsearch(v2.7.1)[12]软件去除长度小于120 bp的序列,并基于Unite数据库,采用uchime方法[13-14]比对去除嵌合体序列。使用Vsearch(v2.7.1)软件uparse算法对优质序列按照相似度大于97%的原则进行OTU(Operational Taxonomy Unit)聚类。使用BLAST算法,与Unite数据库和RDP数据库分别进行真菌和细菌比对,并对OTU进行注释。利用QIIME1(v1.8.0)软件进行Alpha多样性指数(Shannon指数、Chao1指数、Sobs指数等)分析。基于物种注释及平均相对丰度结果,通过R(v3.6.0)软件进行物种组成、热图分析[15-16],利用Canaco 5 进行冗余分析(RDA)。利用SPSS21.0统计软件进行实验数据单因素方差分析和差异显著性检验,以P<0.05为差异显著水平,标注各组差异性。原始数据上传至NCBI数据库。
2 结果与分析
2.1 高温大曲理化性质分析
不同酒企高温大曲的理化指标如图1所示。由图1可知,不同酒企高温大曲的水分为10.3%~13.7%,差异不大,这与吴树坤等[7]取自宜宾、泸州和遂宁地区的大曲水分为10%~14%的研究结果较一致。H8酒企高温大曲的水分最少,为10.3%,而其他酒企高温大曲的水分基本保持在12.0%左右。

图1 不同酒企高温大曲的理化指标Fig.1 Physicochemical indexes of high-temperature Daqu in different Baijiu companies
不同酒企高温大曲的酸度为0.7~1.9 mmol/(10 g),平均酸度为1.4 mmol/(10 g),其中H3酒企高温大曲的酸度最高,H1酒企高温大曲的酸度最低。有研究[17]发现,品质好的成品大曲的酸度为1.0 mmol/(10 g)左右,酸度过高表明有杂菌繁殖生长,酸度过低则表明有益微生物生长繁殖不良,即酸度过高或过低均不利于大曲生产。
不同酒企高温大曲的发酵力为8.3~195.7 g CO2/(100 g·72 h),其中H1(195.7 g CO2/(100 g·72 h))和H7(162.3 g CO2/(100 g·72 h))酒企高温大曲的发酵力明显强于其他酒企高温大曲(均低于26.0 g CO2/(100 g·72 h))。发酵力在一定程度上可反映该大曲的产酒能力及微生物的生长繁殖速度[7],特别是反映产酒酵母的活性,由此可知,H1酒企高温大曲的产酒酵母活性最高。
除H1酒企高温大曲的糖化力最高(201 mg C6H12O6/(g·h))外,其他酒企高温大曲的糖化力为36~78 mg C6H12O6/(g·h),其中H8酒企高温大曲的糖化力最低(36 mg C6H12O6/(g·h))。不同酒企高温大曲的液化力为0~0.27 g/(g·h),其中H3和H8两家酒企高温大曲的液化力均在检测限以下,H1酒企高温大曲的液化力最高(0.27 g/(g·h)),H2酒企高温大曲的液化力较低(0.05 g/(g·h)),H4、H5、H6和H7酒企高温大曲的液化力均在0.10 g/(g·h)左右。大曲的糖化力和液化力均受工艺控制参数的影响较大,且与产品风格密切相关[9]。有研究[18]发现,浓香型大曲一级曲的糖化力和液化力分别为723.2 mg C6H12O6/(g·h)和0.58 g/(g·h),远高于本研究所选样品,这可能与大曲类型有关。
不同酒企高温大曲的酸性蛋白酶活力为0.3~20.5 U/g,与其他报道中泸州大曲蛋白酶活力为9.27~19.36 U/g有部分差异[19],其中H1(19.2 U/g)和H2(0.3 U/g)两家酒企高温大曲的酸性蛋白酶活力差异较大,而H3(19.2 U/g)和H4(20.5 U/g)两家酒企高温大曲的酸性蛋白酶活力差异较小,H5、H6、H7和H8酒企高温大曲的酸性蛋白酶活力介于最高和最低之间。白酒发酵是在酸性环境下进行的,高酸性蛋白酶活力有利于充分分解蛋白质生成氨基酸,从而有利于形成大曲曲香等白酒风味物质[7,18-19]。
2.2 高温大曲微生物数量分析
不同酒企高温大曲的微生物数量情况如图2所示,其中,未显示微生物数量的酒企高温大曲表示该微生物未检出或其数量<103CFU/g。由图2可知,H2和H3两家酒企的细菌和芽孢杆菌数量均与其他酒企相差1~2个数量级。由图2a)和b)对比可知,不同酒企的细菌和芽孢杆菌在数量变化上有一定相似性,例如,H2—H7酒企高温大曲的细菌和芽孢杆菌数量均一直增加。除H1、H7和H8这3家酒企高温大曲中检测到酵母菌外,其他酒企高温大曲中酵母菌数量均低于103CFU/g。H6酒企高温大曲中霉菌数量最少(<103CFU/g),H1酒企高温大曲的酵母菌和霉菌数量均最多。

图2 不同酒企高温大曲的微生物数量情况Fig.2 Microbial amount of high-temperature Daqu in different Baijiu companies
2.3 高温大曲高通量测序结果分析
2.3.1Alpha多样性分析不同酒企高温大曲的微生物群落Alpha多样性指数见表1。由表1可知,就真菌而言,不同酒企高温大曲的Alpha多样性指数存在差异性。H1、H2和H3这3家酒企高温大曲的Chao1指数均较高,其中H3酒企高温大曲的Chao1指数最高(30),相应的Sobs指数也最高(28),但H6酒企高温大曲的Chao1指数和Sobs指数都仅为10;H1酒企高温大曲的Shannon指数最高(3.03),H7酒企高温大曲的Shannon指数最低(1.88),其他酒企高温大曲的Shannon指数为2.02~2.90。就细菌而言,H1酒企高温大曲的Shannon指数最高(4.41),H2酒企高温大曲的Chao1指数(124)和Sobs指数(123)均最高,而H5酒企高温大曲的Chao1指数和Sobs指数均最低,都为50。有研究[18]发现,优级曲真菌和细菌的Chao1指数和Shannon指数均高于一级曲,而本文中H1酒企高温大曲真菌和细菌的Shannon指数均较高,但H3酒企高温大曲真菌的Chao1指数最高,H2酒企高温大曲细菌的Chao1指数最高,无法判断H1酒企高温大曲品质是否优于其他酒企高温大曲,还需要多方面考量其他数据并进行深入研究。结合不同酒企的地理位置特征,距离茅台镇中心较近的3家酒企(H1、H2、H3)高温大曲细菌和真菌的Alpha多样性指数均较高。
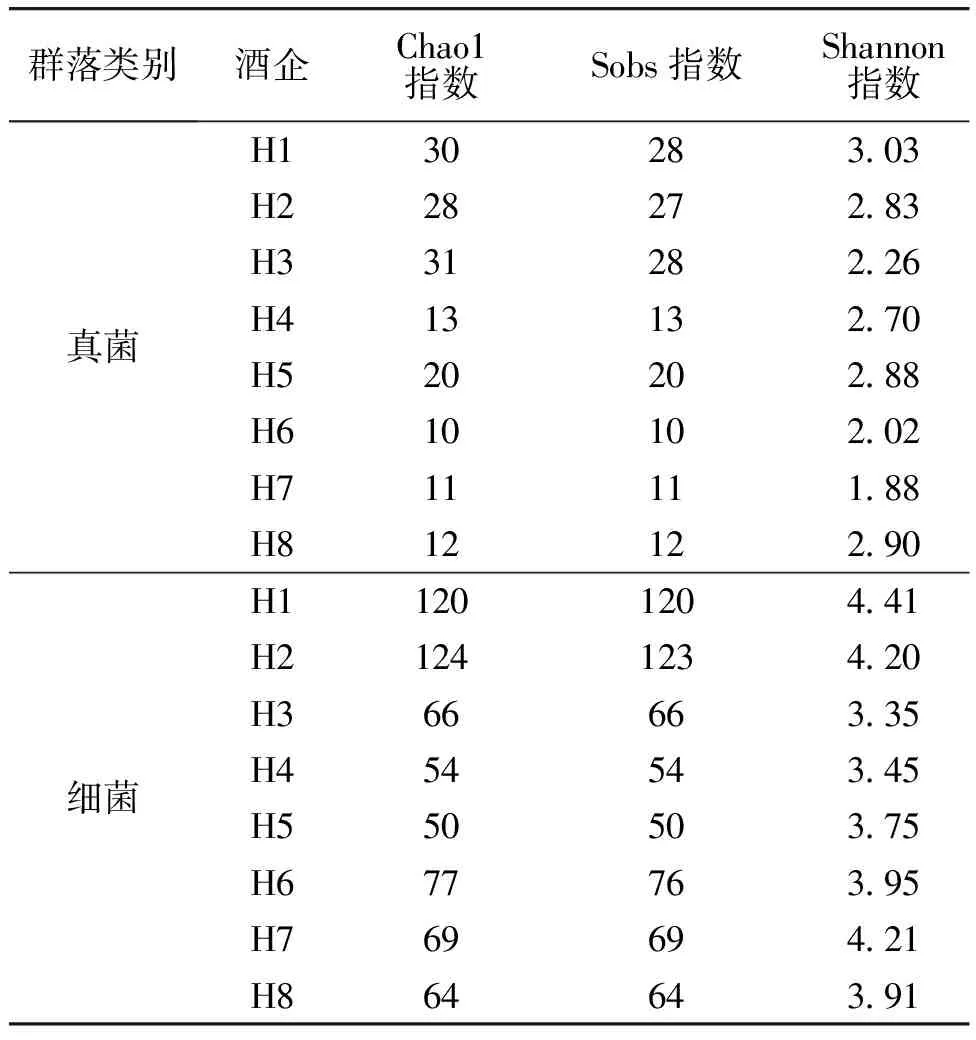
表1 不同酒企高温大曲的微生物群落Alpha多样性指数Table 1 Alpha diversity index of microbial community of high-temperature Daqu in different Baijiu companies
2.3.2 微生物群落结构组成分析基于门水平的不同酒企高温大曲真菌和细菌群落结构如图3所示。由图3a)可知,不同酒企高温大曲真菌群落共检出4个门,包括子囊菌门(Ascomycota,94.73%)、毛霉菌门(Mucoromycota,2.38%)、担子菌门(Basidiomycota,1.61%)及未进行分类的门(unidentified,1.29%)。不同酒企高温大曲的绝对优势菌门都是子囊菌门,且H6酒企高温大曲的子囊菌门平均相对丰度最高(99.44%),这与国内其他学者[20]研究中得到的高温大曲子囊菌门在大曲菌门中占绝对优势的结论一致。毛霉菌门在H2酒企高温大曲中的平均相对丰度最高(7.30%),担子菌门在H5酒企高温大曲中的平均相对丰度最高(11.26%),H4酒企高温大曲中未进行分类的门平均相对丰度最高(8.36%),这表明H4酒企高温大曲真菌群落结构复杂程度要高于其他酒企高温大曲。由图3b)可知,不同酒企高温大曲细菌群落共检出7个门:厚壁菌门(Firmicutes,95.71%)、放线菌门(Actinobacteriota,2.91%)、变形菌门(Proteobacteria,0.85%)、蓝藻门(Cyanobacteria,0.40%)、拟杆菌门(Bacteroidota,0.13%)、弯曲杆菌门(Campilobacterota,0.001%)和脱硫杆菌门(Desulfobacterota,0.001%),其中厚壁菌门和放线菌门为不同酒企高温大曲的绝对优势菌门,厚壁菌门在H7和H8酒企高温大曲中达到了99.92%和98.45%的平均相对丰度,这与其他学者[2,18,21-22]研究中大曲细菌门水平主要优势群落结构类似。除厚壁菌门和放线菌门外,变形菌门、蓝藻菌门等在不同酒企高温大曲中的平均相对丰度均<1.00%,但变形菌门在H1、H2、H3和H8酒企高温大曲中的平均相对丰度均>1.00%,这也表明不同酒企高温大曲微生物群落结构存在时空差异,H3酒企高温大曲厚壁菌门平均相对丰度虽最低(85.10%),但其放线菌门、变形菌门和蓝藻菌门的平均相对丰度均>1.00%,且其平均相对丰度>1.00%的菌门最多(4个)。H2酒企高温大曲检出菌门最多(7个),依据上述其Chao1指数最高可知,H2酒企高温大曲物种丰富度最高。
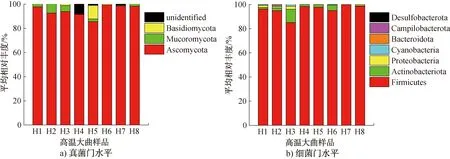
图3 基于门水平的不同酒企高温大曲真菌和细菌群落结构Fig.3 Community structure of high-temperature Daqu fungi and bacteria based on phylum level in different Baijiu companies
基于属水平的不同酒企高温大曲真菌和细菌群落结构如图4所示。由图4a)可知,不同酒企高温大曲相对优势真菌群落共17个,为16个可鉴定属和1个未分类属;绝对优势真菌群落(平均相对丰度>1.00%)共12个,为11个可鉴定属和1个未分类属,主要包括红曲霉菌属(Monascus,24.17%)、曲霉属(Aspergillus,23.15%)、嗜热真菌属(Thermomyces,11.67%)、丝衣霉属(Byssochlamys,7.90%)、嗜热子囊菌属(Thermoascus,7.85%)等,与朱治宇等[23]的研究结果较一致,这可能与本研究中样品也取自茅台镇有关。红曲霉菌属的平均相对丰度最高,但在H3酒企高温大曲中其平均相对丰度<1.00%,相应的曲霉菌属平均相对丰度达到60.74%,H7酒企高温大曲红曲霉菌属的平均相对丰度最高(61.67%),这表明不同酒企高温大曲微生物群落结构之间存在异质性。红曲霉菌属产淀粉酶、糖化酶等酶类,有利于催化各种底物分解为白酒中的香味物质[24],可提升白酒品质,广泛应用于酿酒行业。与白酒发酵相关的酵母菌中,毕赤酵母(Pichia)仅在H7和H8酒企高温大曲中的平均相对丰度较高,分别为11.67%和18.85%;覆膜酵母属(Saccharomycopsis)在H2酒企高温大曲中占有相对优势(7.30%);酵母属(Saccharomyces)不占绝对优势,仅在H4(2.43%)、H7(1.62%)和H8(1.56%)酒企高温大曲中的平均相对丰度>1.00%,在其他酒企高温大曲中的平均相对丰度<1.00%。酵母属是白酒酿造中三大主要功能微生物群落之一,其能促进淀粉等底物转化为酒精和白酒香味物质[25]。酵母属在各酒企高温大曲中平均相对丰度的区别,或许能从内在机制解读不同酒企白酒风味的特色。
由图4b)可知,相对优势细菌群落共15个,有14个可鉴定属和1个未分类属,绝对优势细菌群落(平均相对丰度>1.00%)共8个,主要包括Kroppenstedtia(38.17%)、海洋芽胞杆菌属(Oceanobacillus,20.71%)、芽孢杆菌属(Bacillus,16.95%)、嗜盐菌属(Virgibacillus,11.15%)、岩石芽胞杆菌属(Scopulibacillus,3.32%)、糖多孢菌属(Saccharopolyspora,1.86%)、魏斯氏菌属(Weissella,1.52%)和乳酸杆菌属(Lactobacillus,1.35%)。细菌优势菌属少于真菌优势菌属,而以往研究[26-27]结果中,细菌优势菌属要多于真菌优势菌属,但在主要优势菌属组成上差别不大。在样品聚类中,H1、H2、H3、H4和H5、H6、H7、H8分别聚为两大类,而高温大曲真菌群落聚类并未遵循此规律。Kroppenstedtia在细菌群落中的平均相对丰度达到38.17%,而在其他大曲相关研究[3,26,28]中,都以高温放线菌属为第一优势菌属,本研究中高温放线菌属仅在H2和H8酒企高温大曲中的平均相对丰度>1.00%,这表明各酒企高温大曲细菌群落存在异质性。海洋芽孢杆菌属是高温大曲中的第二大优势菌属,在H5、H6、H7和H8这4家酒企高温大曲中都占有较大优势,但在其他酒企高温大曲中的平均相对丰度均较小,这种微生物组成上的差异性或许是构成各酒企产酒风味差别的内在原因。

图4 基于属水平的不同酒企高温大曲真菌和细菌群落结构Fig.4 Community structure of high-temperature Daqu fungi and bacteria based on genus level in different Baijiu companies
2.3.3 微生物群落与理化性质的RDA分析高温大曲真菌和细菌群落RDA分析如图5所示,其中,蓝色斜体为菌属名,红色字体为理化指标。由图5a)可知,两个主成分总解释度为56.93%,主要集中在Axis1(33.29%),其中H2、H3和H8这3家酒企高温大曲分布于Axis1中心轴右侧,其余5家酒企高温大曲分布于Axis1中心轴左侧,其中发酵力、糖化力、液化力、酸性蛋白酶活力与47.06%的红曲霉菌属等优势真菌菌属呈正相关关系,即中心点和高温大曲真菌群落之间的连线与理化指标箭头的夹角为锐角,若为钝角则呈负相关关系。高温大曲水分、酸度与曲霉属、节担菌属(Wallemia)、根毛霉属(Rhizomucor)等呈正相关关系。尽管高温大曲的理化性质对其真菌群落分布有一定影响,但均不具有显著性(P>0.05)。
由图5b)可知,两个主成分总解释度为74.0%,主要集中在Axis1(46.5%),其中H1、H2和H3这3家酒企高温大曲分布于Axis1中心轴右侧,其余5家酒企高温大曲分布于Axis1中心轴左侧,且H4、H5、H6和H7这4家酒企高温大曲更集中分布于第三象限,说明其微生物群落结构更相似。水分、发酵力、糖化力、液化力、酸性蛋白酶活力与75.00%的高温大曲及53.33%的细菌菌属呈正相关关系。高温大曲中绝对优势细菌菌属(Kroppenstedtia)与所有理化指标均呈正相关关系(P>0.05),这或许表明了Kroppenstedtia是本研究高温大曲中的核心菌属,对微生物群落结构调控具有重要作用。RDA分析结果表明,本研究中高温大曲的理化性质对其微生物群落结构的影响不存在显著相关性,生产中对大曲微生物进行调控应主要从环境、气候或生产工艺方面考量。
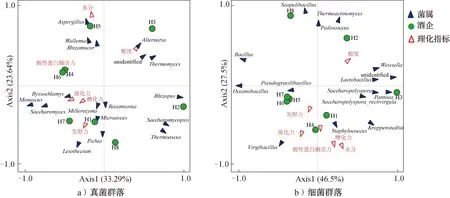
图5 高温大曲真菌和细菌群落RDA分析Fig.5 RDA analysis of fungi and bacteria communities in high temperature Daqu
2.4 高温大曲挥发性成分分析
研究[23]表明,大曲风味物质是白酒中挥发性成分的重要来源之一,探究不同大曲中的特征风味物质有助于定向把握白酒中的挥发性成分。采用固相微萃取方法测定了茅台镇8家酒企高温大曲的挥发性成分,选取每个样品中含量Top10的挥发性成分为主要香味成分,共得到12种挥发性成分,其中酸类3种,醇类2种,酯类1种,吡嗪类4种,苯环芳烃类2种。不同酒企高温大曲挥发性成分的主成分分析(PCA)如图6所示。由图6可知,两个主成分总解释度为78.18%,主要集中在Axis1(62.34%),H1、H4和H7这3家酒企高温大曲分布于Axis1轴右侧,贡献了58.33%的主要挥发性成分,H1和H7两家酒企高温大曲与吡嗪类Q1(川芎嗪)、Q2(2,3,5-三甲基吡嗪)、Q3(2,3-二甲基吡嗪)呈正相关关系,吡嗪类物质被认为是酱香型白酒的特征香味成分,且是白酒的健康因子[29]。H2、H3、H5、H6和H8这5家酒企高温大曲分布于Axis1中心轴左侧,主要检测到醇类C1(β-苯乙醇)、C2(2,3-丁二醇)和酯类Z1(乙酸乙酯)与这5家酒企高温大曲呈正相关关系,这表明不同酒企高温大曲在产香功能上也存在差异。
3 结论
本文对茅台镇8家酒企高温大曲的理化指标与微生物群落结构进行了比较分析,并结合数理算法分析了高温大曲微生物与理化指标之间的关系,以及挥发性成分与高温大曲之间的聚类效果。理化分析结果表明,距离茅台镇中心位置最近的H1酒企高温大曲的发酵力、糖化力和液化力最高,酸度最低;而距离茅台镇中心位置最远的H8酒企高温大曲的水分和发酵力最低;酸性蛋白酶活力是H2酒企高温大曲最低而H4酒企高温大曲最高,这8家酒企高温大曲理化指标存在一定的差异。高温大曲Alpha多样性从一定程度上反映了物种丰度和物种多样性,茅台镇8家酒企真菌和细菌Alpha多样性存在一定的差异,例如H1酒企高温大曲真菌和细菌的Shannon指数最高,H3酒企高温大曲真菌的Chao1指数最高,H2酒企高温大曲细菌的Chao1指数最高,整体上来看,真菌和细菌群落的Chao1指数和Sobs指数随着距离茅台镇中心位置从近到远而由大变小,距离茅台镇中心位置较近的3家酒企(H1、H2、H3)高温大曲具有更丰富的物种多样性。在微生物丰度上,高温大曲细菌数量较多而真菌数量较少,这可能与高温大曲的发酵方式有关。微生物群落结构分析表明,门水平上,茅台镇8家酒企高温大曲真菌的核心优势菌门是子囊菌门、毛霉菌门和担子菌门,细菌的核心优势菌门是厚壁菌门和放线菌门;属水平上,真菌的核心优势菌属是红曲霉菌属、曲霉属、嗜热真菌属、丝衣霉属和嗜热子囊菌属,细菌的核心优势菌属是Kroppenstedtia、海洋芽胞杆菌属、芽孢杆菌属、嗜盐菌属、岩石芽胞杆菌属、糖多孢菌属、魏斯氏菌属和乳酸杆菌属。 RDA 分析发现,高温大曲的理化指标虽与其微生物群落之间存在一定的相关性,但均不具有显著性(P>0.05),说明在茅台镇小尺度范围内,高温大曲的理化性质与微生物存在异质性,但不具备显著差异。
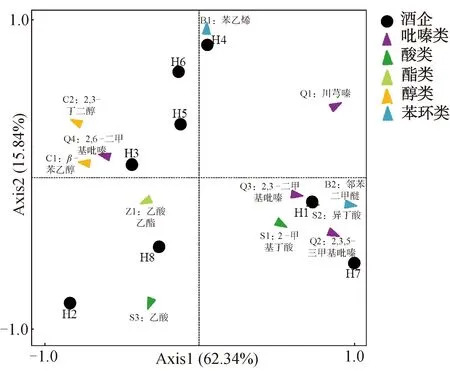
图6 不同酒企高温大曲挥发性成分的主成分分析Fig.6 PCA analysis of volatile compounds of high-temperature Daqu in different Baijiu companies
本研究对茅台镇8家酒企的高温大曲进行了研究分析,这些酒企的地理位置虽相对较近,但高温大曲微生物群落结构却表现出明显的差异性。本研究结果不仅有助于更深入地了解茅台镇高温大曲的理化性质和微生物群落结构,还进一步证实了在小尺度范围内高温大曲的理化性质与微生物群落结构存在异质性,这对深入探索不同酒企大曲品质差异具有重要的理论和实践价值。高温大曲在微生物群落结构、理化指标、挥发性成分等方面表现出的差异性可能受多种因素(原材料、生产工艺、环境因素等)的影响,因此,深入研究和解析这些差异有助于更好地优化高温大曲的制作工艺及提升白酒的风味与品质。

