基因组重排选育优良发酵性能的高浓酿造啤酒酵母
张亚萌,王金晶*,钮成拓,郑飞云,刘春凤,李崎
1(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)2(江南大学 生物工程学院,酿酒科学与工程研究室,江苏 无锡,214122)
高浓酿造是一种在啤酒生产中广泛应用的酿造技术,具有提高产量、节约成本等优点[1]。酵母在高浓酿造期间面临多重环境压力,主要包括高浓麦汁的渗透胁迫和发酵后期的乙醇胁迫。与常浓酿造相比,高浓酿造存在发酵周期长,发酵度低,麦芽三糖发酵不完全的问题[2],另外残留的麦芽三糖也会影响啤酒风味。麦汁浓度越高,对糖化工艺、酵母菌株、发酵技术的要求也越严格,因此,在实际生产中,高浓酿造的原麦汁浓度受到限制。目前,可以通过调整酿造条件来提高酵母活性,比如适当提高发酵温度[3]、外源添加氨基酸[1]、增加溶氧[4]、提高接种量[5]等,但发酵工艺的调整往往会影响风味物质的产生[4],因此发酵性能优良的高浓酿造啤酒酵母的选育至关重要。
高浓酿造啤酒酵母的选育主要从2个角度出发:一是提高酵母耐受性,高浓酿造的环境胁迫会比常浓更加明显,不少研究通过适应性进化的方法,将酵母在高渗透压[6]、高麦芽糖(或麦芽三糖)[7]或高乙醇[8]培养基中连续培养30代甚至更久,从而获得发酵能力提高的菌株;二是抗葡萄糖阻遏效应啤酒酵母的选育,麦汁中主要的糖类包括麦芽糖、麦芽三糖和葡萄糖,葡萄糖的分解代谢产物会抑制麦芽糖及麦芽三糖利用相关基因的转录,因此会出现酵母优先利用葡萄糖的现象,即葡萄糖阻遏效应[9]。郭立芸[10]通过定向进化获得了抗葡萄糖阻遏效应的啤酒酵母菌株,该菌株在18 °P麦汁发酵过程中发酵更快;然而,啤酒酵母的发酵性能本身是一个复杂性状,受环境因素的影响很大,很难通过一个指标的提升对应到发酵性能上,这给选育工作带来了一定挑战。
基因组重排(genome shuffling)由DNA shuffling发展而来,将重排范围从特定的基因扩大到整个基因组,无需了解菌株的基因调控机制,是一种基于表型筛选的定向育种技术[11]。该方法将传统诱变与原生质体相结合,先借助诱变手段获得大量突变,再通过多轮次多亲本的原生质体融合将正向突变不断富集,以达到选育目的。相比传统诱变,基因组重排的育种效率更高,在微生物育种工作中应用广泛,包括提高代谢物产量[12]、提高底物利用率[13]、增强菌株耐受性[11]等。该技术也成功应用到了酵母选育中,ZHENG等[12]对酿酒酵母308进行了紫外诱变和两轮原生质体融合得到了重排菌株YZ2,该菌株在含0.5%乙酸的发酵培养基中能够生产更多乙醇,产量比308提高了21.6%。YIN等[14]通过紫外线和NTG组合诱变获得突变株,对突变株进行了两轮原生质体融合,成功将酿酒酵母的谷胱甘肽产量提高到了原来的3.3倍。
本研究通过基因组重排技术结合表型筛选选育了一株发酵性能提升的拉格啤酒酵母,该方法为后续啤酒酵母选育工作提供了理论基础。
1 材料与方法
1.1 材料
1.1.1 菌株
拉格啤酒酵母菌株(Saccharomycespastorianus)G03,由企业赠送,为中国某啤酒厂使用的工业酵母。
1.1.2 主要试剂及仪器
葡萄糖、麦芽糖、蛋白胨、酵母提取物、琼脂粉、EDTA-2Na、CaCl2、蔗糖、PEG-6000、无水乙醇、NaCl,国药集团化学试剂有限公司;蜗牛酶、β-巯基乙醇,索莱宝生物科技有限公司;麦芽糖标准品、麦芽三糖标准品,上海阿拉丁生化科技股份有限公司。
恒温摇床、恒温培养箱,上海博迅公司;无菌超净工作台,苏净集团安泰公司;ARTP诱变系统,思清源生物科技有限公司;全自动啤酒分析仪,安东帕(上海)商贸有限公司;台式冷冻离心机,德国艾本德公司;高效液相色谱仪,日本日立公司。
1.1.3 培养基及溶液配制
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose, YPD)培养基(g/L):葡萄糖20,蛋白胨20,酵母提取物10;固体培养基添加20 g/L琼脂粉。
麦芽糖培养基(g/L):麦芽糖20,蛋白胨20,酵母提取物10;固体培养基添加20 g/L琼脂粉。
再生培养基(g/L):葡萄糖20,蛋白胨20,酵母提取物10,蔗糖170,琼脂粉20。
再生软琼脂培养基(g/L):葡萄糖20,蛋白胨20,酵母提取物10,蔗糖170,琼脂粉7。
麦汁培养基:麦汁制备参考文献[15],以1∶3(g∶mL)的料液比进行糖化,制备24 °P麦汁,24 °P麦汁主要糖组分为138 g/L麦芽糖,32 g/L麦芽三糖,23 g/L葡萄糖;33 °P麦汁由24 °P麦汁添加麦芽糖糖浆制得;12 °P麦汁由24 °P麦汁加水稀释制得,酵母活化及扩大培养使用12 °P麦汁进行。
0.2% β-巯基乙醇溶液:在PBS溶液中加入β-巯基乙醇,配制体积分数0.2%的β-巯基乙醇溶液。
助融剂(g/L):PEG-6000 300,CaCl21.11。
高渗缓冲液(g/L):蔗糖205.38,用PBS溶解。
10 g/L蜗牛酶液:在高渗缓冲液中加入蜗牛酶配制10 g/L蜗牛酶液,0.22 μm微孔滤膜过滤除菌,4 ℃保存。
4-硝基苯基-α-D-吡喃葡萄糖苷(4-nitrophenyl-α-D-glucopyranoside,pNPG)溶液(g/L):pNPG 1.506,用PBS溶解。
1.2 实验方法
1.2.1 基因组重排
1.2.1.1 常压室温等离子体诱变(atmospheric and room temperature plasma, ARTP)
将G03接种至YPD培养基活化,转接至100 mL YPD培养基。取对数期的菌液进行,涂布在麦芽糖平板上,具体操作流程参考张明芳等[16]的方法。
鱼腥草中的挥发油成分能对动物细胞中白细胞的吞噬作用进行强化,提升动物血清解毒的作用,进而增强动物的免疫力,这在动物肺炎、动物器官性疾病防治中的应用较多,效果也比较显著。
1.2.1.2 突变株筛选
一级筛选:挑取突变株菌落及G03至YPD培养基,28 ℃摇床培养24 h。调整OD600为1.0,以5%(体积分数)的接种量接种至带有杜氏小管的20 g/L麦芽糖培养基中,28 ℃静置培养,记录8 h后的产气情况。
二级筛选:将初筛菌株及G03接种至YPD培养基,28 ℃摇床培养24 h。调整OD600为1.0,以1%(体积分数)的接种量接种至96深孔板中,培养基为6%(体积分数)乙醇培养基和35%(体积分数)麦芽糖培养基,28 ℃摇床培养24 h,测定OD600。
三级筛选:将二级筛选得到的菌株进行啤酒发酵实验,测定发酵结束后的酒精度及真正发酵度。
1.2.1.3 原生质体融合
参考文献[17]和[18]中的方法,酵母菌株活化后,转接到100 mL YPD培养基,培养到对数期。调整OD600为1.0,吸取2 mL菌液,无菌水洗涤2次,分别加入1 mL EDTA溶液和1 mL β-巯基乙醇溶液,30 ℃水浴10 min,PBS溶液洗涤2次,加入2 mL蜗牛酶溶液,32 ℃水浴60 min,高渗缓冲液洗涤2次。
将各菌株的原生质体悬液(108个/mL)等体积混合,分别进行紫外灭活(超净台紫外灯15 cm处,照射5 min)和热灭活(60 ℃水浴4 min),各取1 mL不同灭活方式的原生质体悬液混合,重悬于2 mL助融剂,28 ℃水浴20 min,高渗缓冲液洗涤2次,稀释适当倍数后接种至再生培养基,28 ℃培养2~4 d。
1.2.1.4 融合菌株筛选
参考1.2.1.2节中突变株的筛选方法。一级筛选中产气实验所用培养基为高麦芽糖培养基,于11 ℃静置培养,记录44 h时产气情况;二级筛选中压力培养基为7%(体积分数)乙醇培养基,28 ℃摇床培养48 h,测定OD600;三级筛选同突变株的三级筛选。
1.2.2 菌株的遗传稳定性分析
将重排菌株活化后转接至24 °P麦汁中,于11 ℃静置培养,记为1代,并在24 °P麦汁中传代45次,保藏15、30、45代菌株,并进行啤酒发酵实验,检测其发酵指标,分析菌株的遗传稳定性。
1.2.3 啤酒发酵实验
将菌株接种至麦汁培养基活化,之后转接至200 mL麦汁培养基28 ℃培养2 d。收集酵母细胞,以106CFU/(mL·°P)的接种量接种至含有150 mL高浓麦汁的锥形瓶中,于11 ℃或18 ℃静置发酵,每组3个平行。锥形瓶链接发酵栓,并用无菌水液封,模拟啤酒发酵过程。每24 h称取锥形瓶质量,计算每日CO2失重,当失重<0.1 g/100 mL时,可认为发酵结束。
1.2.4 发酵参数测定
1.2.4.1 酒精度及发酵度测定
取50 mL发酵样品,过滤除气,使用啤酒分析仪Anton Pear 4500M检测啤酒的酒精度及真正发酵度。
1.2.4.2 风味物质含量的测定
发酵结束后将酒液过滤,以3-庚酮为内标,利用气相的方法测定啤酒中几种主要风味物质的含量[19]。
1.2.4.3 主要糖含量的测定
利用高效液相色谱法测定发酵结束后的麦芽糖及麦芽三糖含量。发酵液离心取上清液,添加无水乙醇至终体积分数为70%,8 000 r/min离心3 min,上清液用于高效液相色谱分析。流动相为纯水,流速0.3 mL/min,采用示差折光检测器,进样量10 μL,色谱柱Wares Sugar-pak1TM6.5 mm(ID)×300 mm Column,柱温85 ℃。
1.2.5 α-葡萄糖苷转运活性的测定
α-葡萄糖苷转运活性测定方法参考文献[2]并稍作修改,反应体系:36 μL菌液+144 μL 5 mmol/L pNPG溶液,30 ℃水浴反应90 min。离心取120 μL上清液,加入80 μL 1 mol/L的Na2CO3测定OD400值。
1.2.6 基因表达量的测定
利用RT-qPCR测定α-葡萄糖苷转运基因的相对表达量,具体操作参考文献[19]。
2 结果与分析
2.1 亲本文库的构建
首先绘制ARTP处理时G03的致死率曲线(图1),当诱变时间为40 s时,致死率为89.9%,40 s之后,菌株死亡率均接近100%。为了获得较高突变率,选择ARTP诱变时间为40 s。选择生长较好的99个突变菌在2%(质量分数)麦芽糖培养基中培养,观察菌株产气情况。杜氏小管实验能根据产气情况判断菌株的起酵速度及发酵能力,以G03为对照,筛选可以快速发酵麦芽糖的菌株。如表1所示,G03产气量为“+++”,共有34株突变株产气速度比G03快。
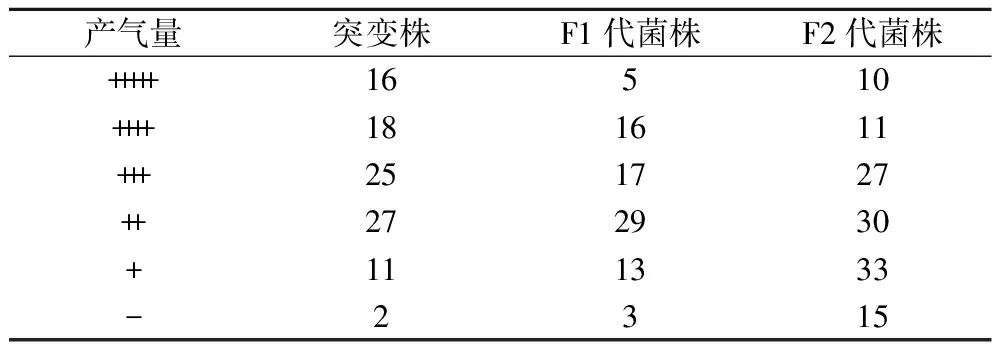
表1 不同筛选阶段的菌株的产气量分布(菌株个数)Table 1 Gas production distribution (number of strains) at different screening stages

图1 常压室温等离子体(ARTP)诱变G03致死曲线Fig.1 The ARTP fatality curve of G03
酵母的抗逆能力与高浓酿造时的发酵性能有很大联系,耐乙醇能力强的菌株中细胞膜相关基因的数量更多,基因的表达也更强,而且还和不饱和脂肪酸合成途径及氨基酸代谢途径有关,从而改变了菌株的发酵性能[20]。将这些菌株分别接种至高麦芽糖培养基和乙醇培养基,进行耐受性分析,结果如表2所示,选定麦芽糖质量分数为35%,乙醇体积分数为6%为筛选条件,此时G03生长受到抑制。突变株在上述2种压力培养基中的生长情况如图2所示。其中,33株突变株抗渗透压能力优于G03,22株突变株抗酒精能力优于G03,选择OD600在高糖培养基中提高5%、在乙醇培养基中提高3%的14株突变株进行24 °P麦汁发酵实验。
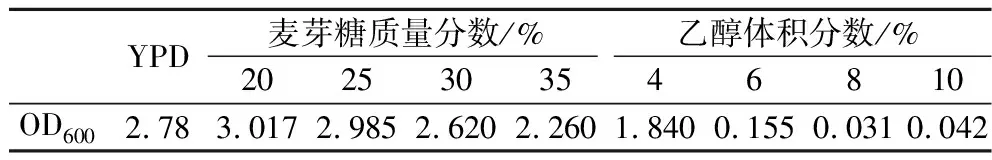
表2 G03在不同压力下的生长情况Table 2 The growth of G03 under different stresses
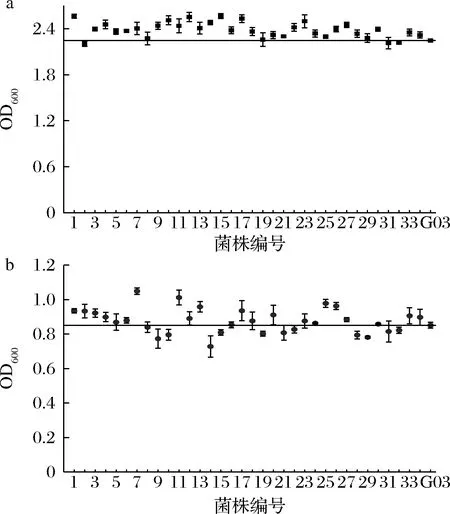
a-35%麦芽糖培养基;b-6%乙醇培养基
跟踪发酵过程中的失重以及发酵结束后酒精度、发酵度结果(表3)发现,有6株突变株发酵能力提高。G-40及G-41发酵结束用时11 d,比G03提前1 d结束发酵。其他菌株发酵周期与G03相同,但酒精度及发酵度均有所提高,其中G-33的酒精度和真正发酵度,分别比G03提高了2.9%和2.5%。经过ARTP诱变,菌株的发酵能力提升很有限,因此需要通过后续的重排来进一步提升菌株发酵性能。
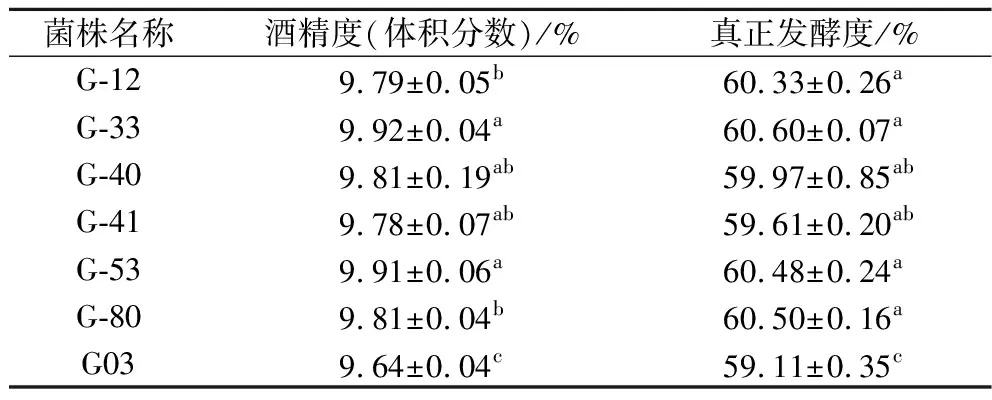
表3 G03及突变株在24 °P麦汁发酵时的酒精度及真正发酵度Table 3 Alcohol content and real attenuation of G03 and mutant strains in 24 °P wort fermentation
2.2 第一轮重排
以上述6株发酵能力改善的突变株为第一轮重排的亲本,共获得了83个F1代菌株。前期研究中发现,在麦芽糖培养基中产气速度快的菌株在高麦芽糖培养基中的生长情况也较好,因此将重排后的菌株在24%的高麦芽糖培养基中培养观察产气情况,并在11 ℃下进行模拟拉格啤酒发酵实验。
选择真正发酵度及酒精度最高的G-33和发酵周期缩短1 d的G-40为对照菌株,对F1代菌株进行筛选。2个对照菌株中,G-33和G-40的产气量分别为“+++”、“++”,G-33产气速度快,G-40的乙醇耐受性好。结果发现,F1代菌株中有21个菌株产气速度较G-33快(表1),对这21株菌进行乙醇耐受性筛选,发现有10个菌株的乙醇耐受能力高于G-40(图3)。进一步将这10株菌进行24 °P麦汁发酵,结果如表4所示,F1-9和F1-77的发酵能力较好,其中F1-9的酒精度比G-33提高了3.4%,真正发酵度提高了1.9%;与亲本菌株G03相比,分别提高了5.9%和4.9%。

表4 第一轮融合菌株(F1)在24 °P麦汁发酵时的酒精度及真正发酵度Table 4 Alcohol content and real attenuation of the first generation fusants (F1) in 24 °P wort fermentation
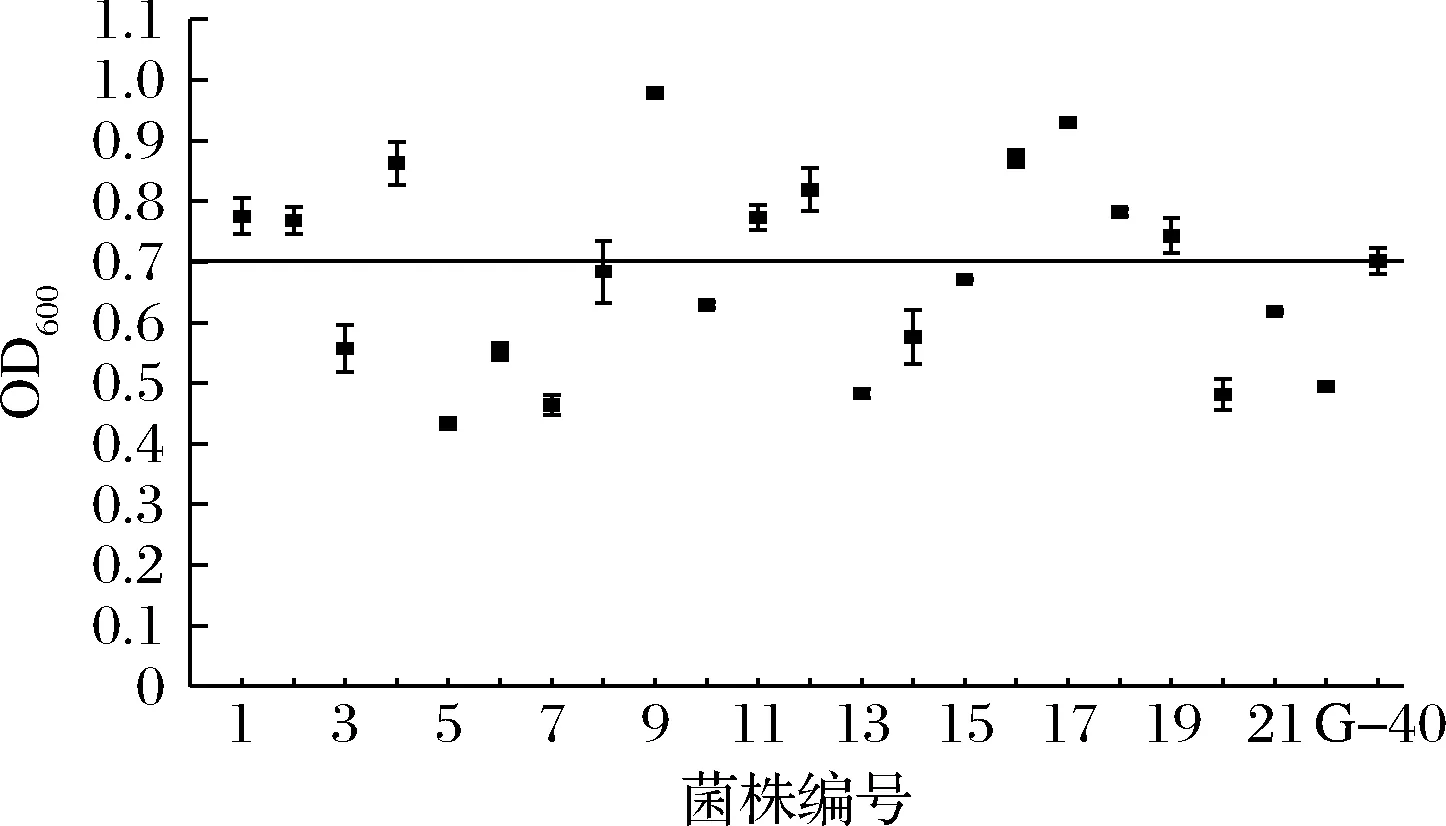
图3 第一轮融合菌株(F1)在7%乙醇培养基中的生长情况Fig.3 Growth of the first generation fusants (F1) in 7% ethanol medium
2.3 第二轮重排
在基因组重排过程中,为了提高遗传多样性,可以将之前轮次中表现优异的菌株继续用于后续重排[21],因此,诱变获得的G-33、G-40与F1-9、F1-77共同参与第二轮原生质体融合。融合后共获得了126个F2代菌株,第二轮筛选进一步将麦芽糖培养基浓度提高至26%。结果发现,F1-9的产气量为“+++”,共有21个F2代菌株产气速度较F1-9快(表1)。进一步进行乙醇耐受性实验,有8个F2代菌株的乙醇耐受能力比F1-9好(图4)。24 °P麦汁发酵实验结果表明,F2-123的发酵能力有较高的提升(表5),比F1-9提前1 d结束发酵,酒精度和真正发酵度比F1-9分别提高了2.2%和1.3%,比亲本菌株G03提高了8.2%和6.4%。可以看到,基因组重排过程中,菌株在每一次筛选后都有一定程度的改善,多亲本多轮次的原生质体融合实现了不同菌株中的有益遗传特性的组合[11],因此F2-123相比G03发酵性能有了明显提高。
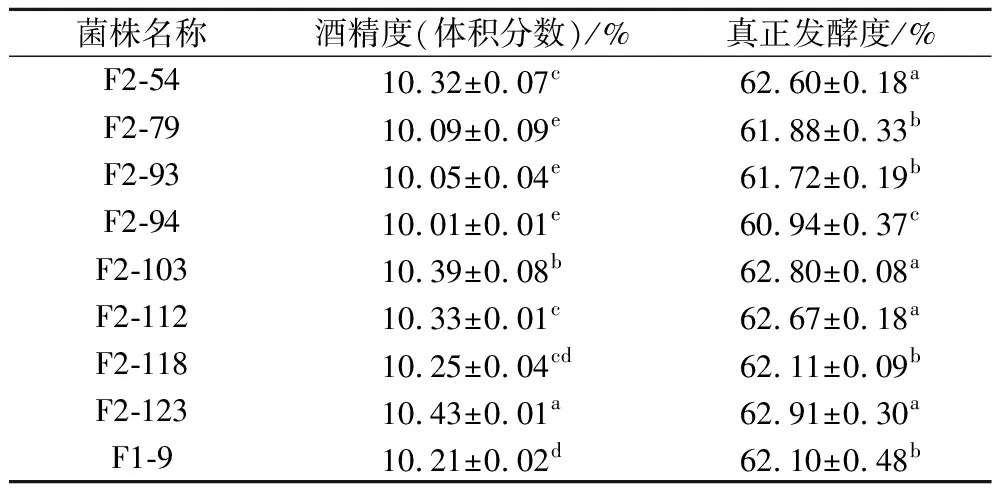
表5 第二轮原生质体融合菌株(F2)在24 °P麦汁发酵时的酒精度及真正发酵度
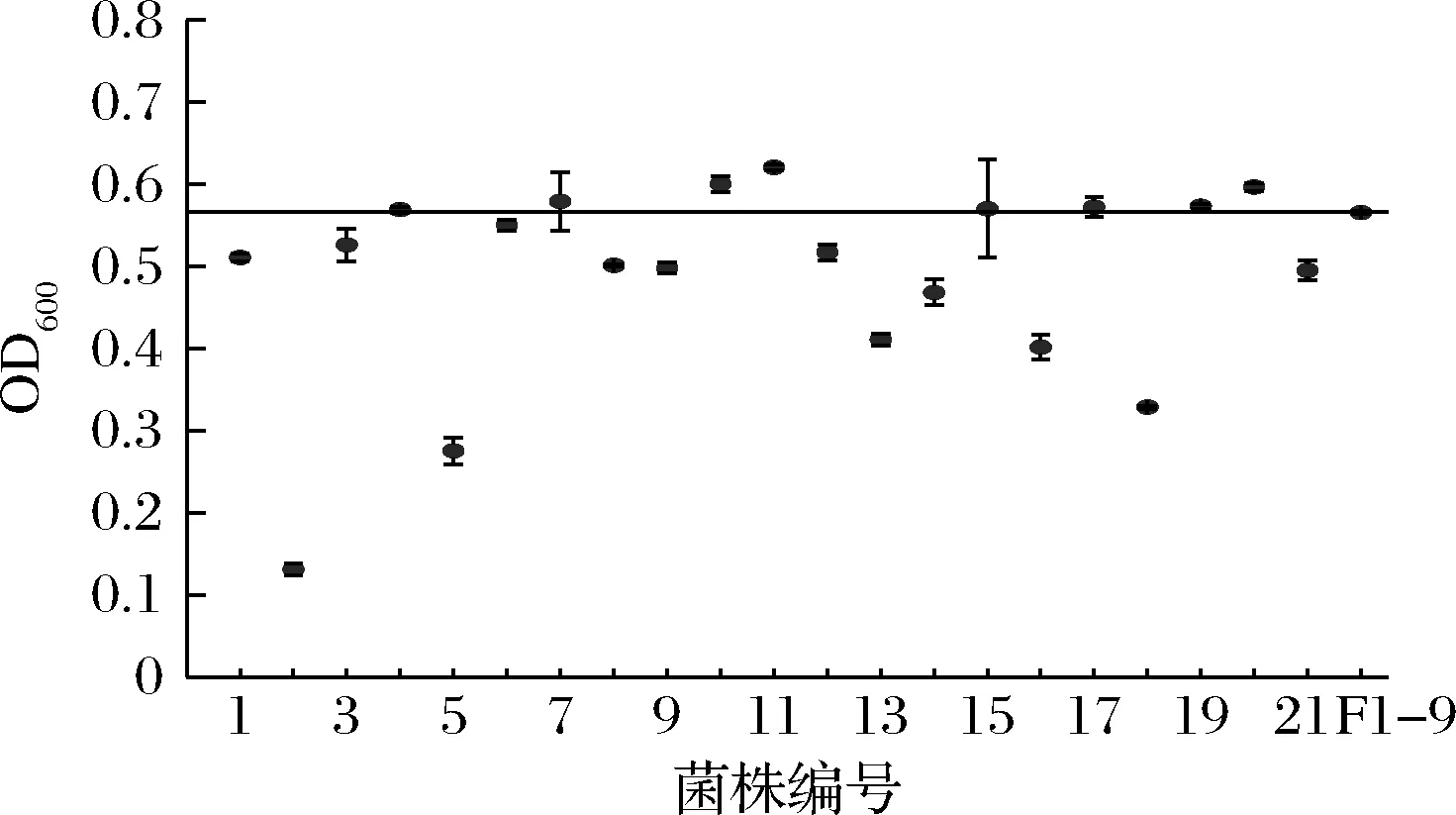
图4 第二轮融合菌株(F2)在7%乙醇培养基中的生长情况Fig.4 Growth of the second generation fusants (F2) in 7% ethanol medium
2.4 基因组重排菌株的发酵性能评价
2.4.1 24 °P麦汁啤酒发酵
分析了不同基因组重排阶段的菌株在24 °P麦汁中的发酵情况(表6),与G03相比,F2-123、F1-9、F1-77和G-33的发酵液中残余麦芽糖及麦芽三糖含量均不同程度降低,它们的酒精度及发酵度均有所提高。其中F2-123比G03提前1 d结束发酵,并且麦芽糖利用率从85.4%提高到92.2%,麦芽三糖利用率从72.8%提高到78.9%;酒精度提高了8.9%,真正发酵度提高了6.5%。贺秀丽等[22]将酵母在乙醇环境中驯化,得到的菌株在22 °P,14 ℃下发酵周期缩短了42 h,酒精度比原始菌株提高了2.0%。YU等[23]利用EMS诱变提高了酵母的发酵性能,虽然该菌株在24 °P,12 ℃中发酵周期缩短了6 d,但依然长达22 d,酒精产量仅提高了1.5%。HUUSKONEN等[7]获得的菌株在24 °P发酵中酒精度比原始菌株提高了2.3%~6.1%。在一些研究中,高浓酿造菌株多被应用到15 °P麦汁发酵[6,8,21]。本研究的菌株在较高浓度麦汁的低温发酵中表现优异,并且在发酵周期缩短1 d的情况下酒精度提高了8.9%,由此可见,菌株得到了明显改善。
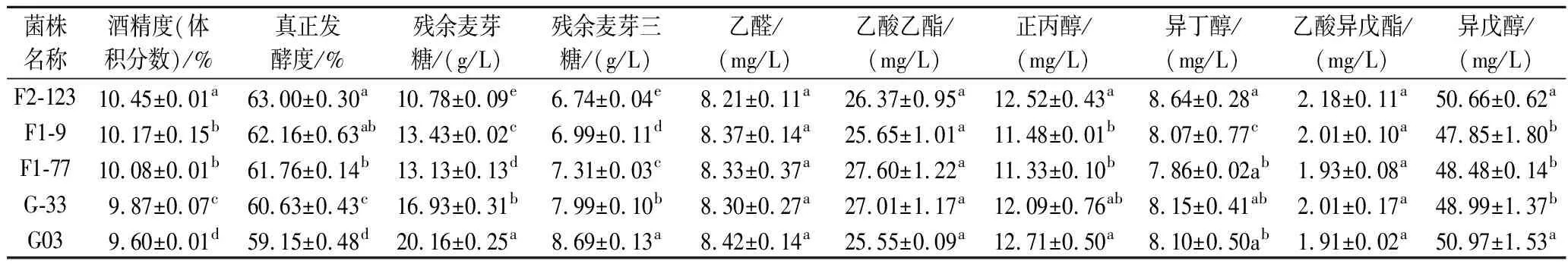
表6 基因组重排菌株24 °P麦汁发酵情况Table 6 The fermentation performance of different strains obtained from genome shuffling in 24 °P wort
啤酒的风味成分是啤酒的一个重要质量指标,因此我们还比较了用不同菌株发酵的啤酒中几种主要的醇酯含量(表6)。与G03相比,其他菌株的风味物质含量没有大幅度的变化,基本保持了原有的醇酯比,这也表明基因组重排的育种方式在提高菌株发酵能力的情况下较好地保持了菌株原有的风味特性。
2.4.2 33 °P啤酒发酵实验
为了进一步评价F2-123在更高浓度的麦汁中发酵的潜能,进行了33 °P(18 ℃)超高浓麦汁发酵,发酵情况如表7所示。F2-123在33 °P麦汁中发酵周期为10 d,G03为11 d,且发酵结束时的酒精度及发酵度分别比G03提高了9.2%和8.9%,同样,与24 °P发酵类似,2株菌的风味特性无明显差异。由此可见,F2-123在超高浓麦汁发酵时依然能够缩短发酵周期,并且提高发酵度,具有一定的应用潜力。
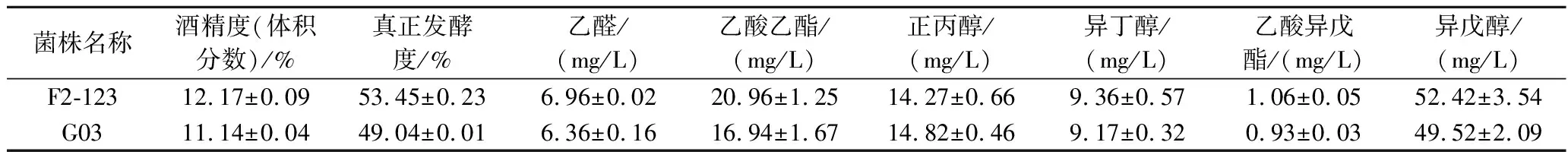
表7 F2-123和G03的33 °P麦汁发酵情况Table 7 The fermentation performance of F2-123 and G03 in 33 °P wort
2.5 基因组重排菌株的遗传稳定性评价
本研究以ARTP诱变为基础构建突变子文库进行基因组重排,获得了发酵能力提升的F2-123菌株,进一步将该菌株在24 °P麦汁中传代培养,共转接45次,并将第15代、30代和45代菌株用于24 °P麦汁发酵,结果如表8所示。F2-123在传代过程中发酵性能较稳定,和G03比,发酵周期缩短了1 d;F2-123发酵液酒精度稳定在10.3%~10.4%,比G03提高了7.5%左右;真正发酵度稳定在62%~63%,比G03提高了6.0%左右。同时测定了啤酒中主要的几种风味成分,不同代数之间,主要风味物质的含量无较大差异。由此可以说明,F2-123在长期传代过程中能够稳定地复制分裂,具有较高的遗传稳定性。

表8 F2-123在24 °P麦汁中传代发酵情况Table 8 Serial fermentation performance of F2-123 in 24 °P wort
2.6 基因组重排菌株的糖转运活性分析
酵母利用麦芽糖和麦芽三糖的第一步是将糖分子转运到胞内,该过程需借助α-葡萄糖苷转运蛋白,这也是酵母利用这2种糖的限速步骤[2]。菌株的α-葡萄糖苷转运活性测定结果(图5)表明,相比G03,F2-123在整个发酵过程中均显示更高的转运活性,比G03提高了34.2%~194.5%。对应的,F2-123的α-葡萄糖苷转运蛋白编码基因MALx1、MTY1、SeAGT1的表达量均比G03高。一方面,高转运活性使酵母细胞更快地利用麦芽糖及麦芽三糖,同时缓解前期的渗透压力,另一方面,菌株耐受能力的提高保证了细胞的活力,研究发现这有助于α-葡萄糖苷转运相关基因的表达[6],从而提高菌株发酵能力。
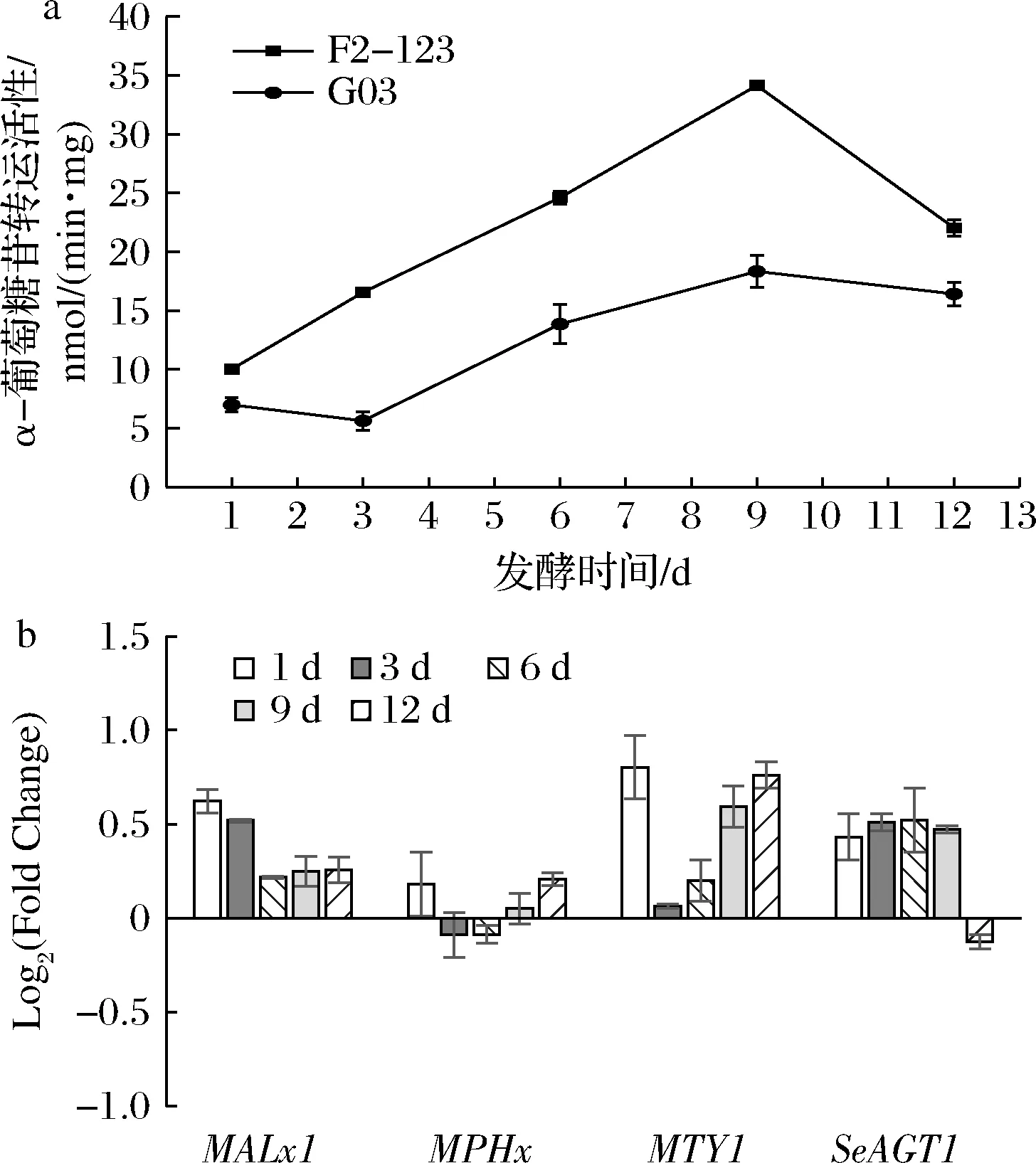
a-α-葡萄糖苷转运活性;b-α-葡萄糖苷转运基因相对表达量
3 结论
高浓酿造技术是啤酒工业中常用的酿造技术手段,除工艺调整外,发酵性能优良的啤酒酵母对提高高浓酿造效率,提升啤酒品质有重要的意义。在啤酒酵母选育工作中,许多研究通过提高酵母耐受性以获得高浓酿造发酵能力提高的菌株,诱变及适应性进化是常用的育种手段。然而酵母的发酵性能受到多项因素的影响,仅通过一轮诱变很难达到育种目的,往往需要经历长期的筛选,育种时间长。正如本研究中,酵母经过ARTP诱变后即使耐受酒精及高麦芽糖胁迫的能力增强,但发酵性能提升并不明显。然而在后续的2轮重排中将所有具有正向突变的菌株借助原生质体融合进行基因重组,经过筛选获得了较理想的菌株。这种方式扩大了遗传多样性,加速了菌株进化,育种效率大大提高。
最终,以拉格啤酒酵母G03为出发菌株,利用基因组重排技术成功选育了1株在高浓酿造(24 °P,11 ℃)下发酵速度及发酵度均提高的酵母F2-123。F2-123的发酵周期为11 d,比G03缩短了1 d,酒精度和真正发酵度分别比G03提高了8.9%和6.5%,且菌株的风味特性没有受到明显影响。F2-123在24 °P麦汁中传代发酵性能稳定,具有一定的实际应用潜力。

