基于抗原蛋白评价的豆粕菌酶协同发酵研究
荀冉,卢艳波,杨小雁,马忠玛,李国辉,赵运英*,邓禹*
1(江南大学 粮食发酵与食品生物制造国家工程研究中心,江苏 无锡,214122)2(江南大学 生物工程学院,江苏 无锡,214122)3(山东省油脂油料精深加工技术重点实验室 山东渤海实业集团有限公司,山东 滨州,256500)
随着畜牧业的飞速发展,饲用大豆需求量不断攀升。但豆粕中存在致敏蛋白和多种抗营养因子,会影响营养物质的消化和吸收,在一定程度上限制了其在饲料加工生产中的应用[1]。在已知的38种大豆过敏原蛋白中,由α(58~77 kDa)、α′(58~83 kDa)和β(42~53 kDa)3个亚基组成的β-伴大豆球蛋白是免疫原性最强的大豆蛋白[2],约占大豆种子全蛋白含量的30%,会引起幼龄动物(如猪和牛等)产生过敏反应[3]。
在豆粕饲料加工生产中,通过有效的加工来降低或消除大豆蛋白的抗原性至关重要。在这其中,β-伴大豆球蛋白中β亚基热稳定性和酶耐受性最强,不易在加工过程中完全去除[4]。研究表明,现如今已开发了多种加工方法和技术,例如热处理、酶水解、发酵和糖化等,但热处理时过度加热会降低赖氨酸和其他必需氨基酸的消化性,其他常规处理也难以有效除去抗原蛋白。微生物发酵可以去除抗营养因子和致敏蛋白,而不破坏豆粕的营养成分[5]。同时,酶水解也是改变大豆蛋白结构和构象,降低其致敏性,改善其生化功能的有效方法。酶水解可以破坏蛋白质肽链,产生分子质量较低的肽或氨基酸,改变过敏原的线性和空间表位,从而降低蛋白质的抗原性[6]。枯草芽胞杆菌是一种常见的重要发酵剂,可产生各类酶,如碱性蛋白酶、淀粉酶等,利用枯草芽胞杆菌制备发酵豆粕,可将豆粕中的蛋白质水解成氨基酸和肽类等物质,显著降低致敏蛋白和抗营养因子[7-8]。
如何准确、快速地检测豆粕中抗原蛋白的含量目前仍然是个难题。这对于评价豆粕产品的功效和营养价值具有重要的意义,也是确定最佳豆粕发酵工艺的重要基础。目前常见的蛋白检测方法包括SDS-PAGE、酶联免疫吸附测定(enzyme linked immunosorbent assay, ELISA)、HPLC法等。现有的β-伴大豆球蛋白的检测技术的主要开发思路以抗原免疫反应为主,朱婷伟等[9]采用自制的兔抗β-伴大豆球蛋白多克隆抗体建立了间接竞争ELISA检测方法,YOU等[10]基于单克隆抗体6G4建立了竞争性ELISA检测方法,检出限为2.0 ng/mL。这些方法虽然在特异性、灵敏性方面各有优势,但均对分析条件有比较高的要求,抗体血清的制备比较复杂,且实验室差异无法保证重复性,很难实际应用于豆粕样品的快速检测[11]。近年来,灵敏度高、操作简单等优点使适配体传感器在分析方法中得到了广泛的发展和应用[12]。因此,本实验室筛选能够与β-伴大豆球蛋白β亚基特异性结合的核酸适配体,选用纳米金作为比色探针,构建了纳米金适配体比色传感器,实现了β亚基的快速检测,为发酵豆粕过程评价抗原蛋白含量奠定基础[13-15]。该传感器在灵敏度和检测效率方面具有优异的性能,β亚基的检测范围为7~58 nmol/L,检测限为2.58 nmol/L。其与ELISA检测β-伴大豆球蛋白的回收率相似,并且省去制备血清的繁琐步骤。
本研究旨在使用纳米金适配体生物传感器评估豆粕发酵过程中的抗原蛋白含量,以β-伴大豆球蛋白的降解率为指标,通过单因素试验优化枯草芽胞杆菌等多种菌株、发酵方式、发酵酶等关键发酵条件,最终获得豆粕发酵的最佳工艺参数,并结合SDS-PAGE方法对比验证传感器检测结果的正确性。
1 材料与方法
1.1 材料
1.1.1 菌株
枯草芽胞杆菌CCTCC10071、枯草芽胞杆菌CCTCC20522、副干酪乳杆菌DY2(CCTCC2017303)、植物乳杆菌DY6(CCTCC2017138),中国典型培养物保藏中心;酿酒酵母BY4741、植物乳杆菌DY1、干酪乳杆菌DY13,实验室保藏。
1.1.2 材料和设备
乙酸钠、K2HPO4、MgSO4·7H2O、MnSO4·4H2O、胰蛋白胨、酵母浸出粉、牛肉膏、吐温-80、柠檬酸三铵、葡萄糖、氯金酸、柠檬酸钠、NaCl、HCl、冰醋酸、三羟甲基氨基甲烷、十二烷基磺酸钠(SDS)、Na2SO3、碱性蛋白酶,国药集团化学试剂有限公司;SDS-PAGE凝胶制备试剂盒,生工生物工程(上海)股份有限公司;豆粕,益海嘉里投资有限公司;适配体的序列为AACACGACCACGCTGTGACGGACACAGGTTGGCAG-CGTCGTG(5′-3′),安升达生物技术有限公司。
SynergyH1多功能检测仪,美国BioTek有限公司;ST 16R高速冷冻离心机,美国赛默飞世尔科技公司;LF-Min-i4小型垂直电泳槽,美国Bio-Rad公司;1260氨基酸专用HPLC仪,美国Agilent公司。
1.1.3 培养基
枯草芽胞杆菌培养基(g/L):牛肉膏10.0,蛋白胨10.0,葡萄糖10.0,NaCl 5.0,pH 7.0,1×105Pa 灭菌30 min。
YPD培养基(g/L):酵母浸出粉10.0,蛋白胨20.0,葡萄糖20.0,1×105Pa灭菌30 min。
MRS培养基(g/L):胰蛋白胨10.0,牛肉膏8.0,酵母浸出粉4.0,葡萄糖20.0,K2HPO42.0,柠檬酸三铵2.0,乙酸钠5.0,MgSO4·7H2O 0.58,MnSO4·4H2O 0.25,吐温-80 1 mL,pH 6.3~6.5,1×105Pa灭菌30 min。
1.2 实验方法
1.2.1 发酵菌株的选择
将实验室保藏菌种按照体积分数1%接种量接种到合适的培养基,在适宜培养温度下活化24 h,按照同样的方式活化2~3代,继续于培养基中培养,得到发酵菌的菌液。
将豆粕与质量分数分别为50%的水、3%的糖及5%的所列发酵菌株对数期的菌液混合均匀后置于无菌处理的自封袋中,同时以不添加菌液组为空白对照,30 ℃培养箱中发酵120 h。70 ℃烘干、粉碎,测定样品中β-伴大豆球蛋白降解率。
1.2.2 发酵方式的优化
选取优化获得最佳菌株,将其按照体积分数为1%的接种量接种到培养基中,30 ℃活化24 h,按照同样的方式活化2~3代,继续培养得到发酵菌液。
将豆粕与质量分数分别为50%的水、3%的糖及5%的菌液以及碱性蛋白酶(200 U/g)混合均匀后置于无菌处理的自封袋中,分别做不添加菌液或蛋白酶的发酵组,30 ℃培养箱中发酵60 h。70 ℃烘干、粉碎,测定样品中β-伴大豆球蛋白降解率。
1.2.3 蛋白酶添加量的优化
控制水、糖蜜及菌液的添加量不变,分别添加25、50、100、200、400 U/g的蛋白酶37 ℃发酵60 h,70 ℃下烘干、粉碎,测定样品中β-伴大豆球蛋白降解率。
1.2.4 菌液接种量的优化
控制豆粕中的水、糖蜜及碱性蛋白酶的添加量不变,分别接种质量分数为2%、5%、7%、10%、20%、30%的菌液,30 ℃发酵60 h,70 ℃烘干、粉碎,测定样品中β-伴大豆球蛋白降解率。
1.2.5 固态发酵时间的优化
将豆粕与质量分数分别为50%的水、3%的糖及7%的菌液以及碱性蛋白酶(200 U/g)混合均匀后置于无菌处理的自封袋中,30 ℃培养箱中发酵12、24、36、48、60、72、84 h。70 ℃烘干、粉碎,测定样品中β-伴大豆球蛋白降解率。
1.2.6 纳米金适配体传感器检测β-伴大豆球蛋白降解率
纳米金胶体溶液是根据经典的柠檬酸还原法合成的[12]。需先将氯金酸(100 mL,0.1 g/L)的水溶液加热沸腾2 min,搅拌速度为250 r/min,再快速加入柠檬酸钠溶液(3.5 mL,10 g/L),沸水浴15 min,最后使反应液冷却至室温即可,于4 ℃下避光保存。
将100 μL纳米金溶液与20 μL 0.5 μmol/L适配体混合后孵育20 min,随后加入20 μL 0.3 mol/L NaCl反应5 min,再加入20 μL合适的稀释倍数的豆粕样品上清液并反应25 min,使用SynergyH1多功能检测仪在600和520 nm处测量吸光度,以已完全发酵降解蛋白的豆粕测定值为分母,根据吸光值A600/A520变化程度计算得到β-伴大豆球蛋白降解率。
1.2.7 SDS-PAGE验证
将1.0 g豆粕样品溶于15 mL裂解蛋白溶液(0.03 mol/L Tris-HCl,15 g/L SDS,0.1 mol/L Na2SO3),反应2 h,12 000 r/min离心7 min后取上清液。采用10%聚丙烯酰胺分离凝胶进行电泳。在电泳前,将上清液与样品加载缓冲液(5×)在水浴下加热10 min。转移到每个孔中的蛋白质分散体的量约为10 μL,用考马斯亮蓝R-250染色显示蛋白条带。
1.2.8 氨基酸含量检测
称取1.0 g豆粕于具塞试管中,加入质量分数为5%的三氯乙酸定容至25 mL,常温超声波处理20 min后静置2 h,用双层滤纸过滤。取1 mL澄清滤液,15 000 r/min离心30 min,上清液用0.22 μm水膜再次过滤,使用HPLC仪检测。
1.2.9 有机酸含量检测
取1.0 g豆粕于50 mL离心管中,加入10 mL去离子水,漩涡振荡15 min,10 000 r/min离心5 min,取上清液,经0.22 μm滤膜过滤后,进行液相检测。分析柱用有机酸柱(Aninex Hpx-87H ion exchange column)柱温50 ℃,流动相5 mmol/L H2SO4溶液,流速0.6 mL/min,进样量10 μL,标样及样品每个跑27 min。根据出峰时间和峰面积计算样品中各种有机酸的含量。
2 结果与分析
2.1 发酵菌株的选择
微生物发酵能有效消除豆粕抗营养因子,并通过产生蛋白水解酶将豆粕中的大分子蛋白降解为易吸收的小分子蛋白,提高营养价值[16]。常见的豆粕发酵所用菌种包括枯草芽胞杆菌[7]、植物乳杆菌[17]、酿酒酵母[5]等。比较不同菌株固态发酵降解豆粕β-伴大豆球蛋白β亚基的效果,如图1-a所示,固态发酵豆粕120 h后,枯草芽胞杆菌20522发酵豆粕的蛋白降解率可达41.08%,其次是枯草芽胞杆菌10071,为34.86%。整体来看枯草芽胞杆菌在降解致敏蛋白方面的效果优于酿酒酵母、植物乳杆菌等。图1-b的SDS-PAGE结果显示,2组枯草芽胞杆菌发酵豆粕的β亚基条带相对更浅,降解程度更高,而α亚基也部分降解。通过图1-c目的蛋白条带灰度的归一化分析来看,枯草芽胞杆菌,尤其是20522菌株,目的蛋白占比最低,说明其含量低、降解度更高,这与传感器的检测结果相似。近年来国内外对于不同菌种发酵豆粕的研究显示,不同菌种降解抗原蛋白的效果与其最适生长环境和分泌的蛋白酶有关,枯草芽胞杆菌往往在固态发酵条件下占据优势[16]。YIN等[8]研究发现从枯草芽胞杆菌中分离的碱性蛋白酶可使β-伴大豆球蛋白抗原性有效降低。枯草芽胞杆菌的碱性蛋白酶被归类为丝氨酸肽酶,其水解位点是疏水氨基酸的碳末端,可通过破坏抗原蛋白的空间结构和表位构象,使其降低或失去与特异性抗体结合的能力[18]。因此,选择枯草芽胞杆菌20522作为最佳发酵菌。
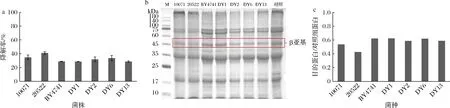
a-β-伴大豆球蛋白降解率;b-SDS-PAGE谱图;c-SDS-PAGE蛋白条带灰度分析
2.2 发酵方式优化
菌发酵、酶发酵和菌酶协同发酵是常见的豆粕固态发酵方法。除了微生物发酵,添加外源酶也可以促进大豆蛋白活性等抗营养因子的降解。众所周知,酶解不仅破坏蛋白质的一级结构,而且对破坏其高级结构具有显著作用。根据COSCUETA等[19]的报道,酶水解脱脂大豆粉蛋白会降低其致敏性,最适合用于此的酶是碱性蛋白酶。但单纯通过酶水解生产的小肽具有明显苦味,生产成本高,限制了其开发利用[20]。
如图2-a所示,菌酶协同组发酵豆粕的β-伴大豆球蛋白β亚基的降解程度最高,可达51.35%,其次是酶发酵,降解率为45.61%。而菌降解蛋白在固态发酵过程中效果一般,表明蛋白酶是影响发酵过程中蛋白降解的主要因素。从图2-b的SDS-PAGE验证结果可以看出,菌发酵的豆粕蛋白条带比较完整,酶发酵和菌酶协同发酵豆粕的蛋白条带大部分已经降解。图2-c灰度分析结果显示,蛋白含量从小到大依次是菌酶协同发酵(0.38)<酶发酵(0.43)<菌发酵(0.86),这与纳米金适配体传感器检测结果的趋势基本吻合。据研究报道,菌酶协同发酵可以利用微生物分泌的酶系与外加酶共同作用处理豆粕,同时添加的蛋白酶大大提高了发酵培养基的整体蛋白酶活性,促进了发酵微生物的生长、酶的分泌和糖的代谢,提高了发酵效率和质量[21-22],这与本实验结果一致。
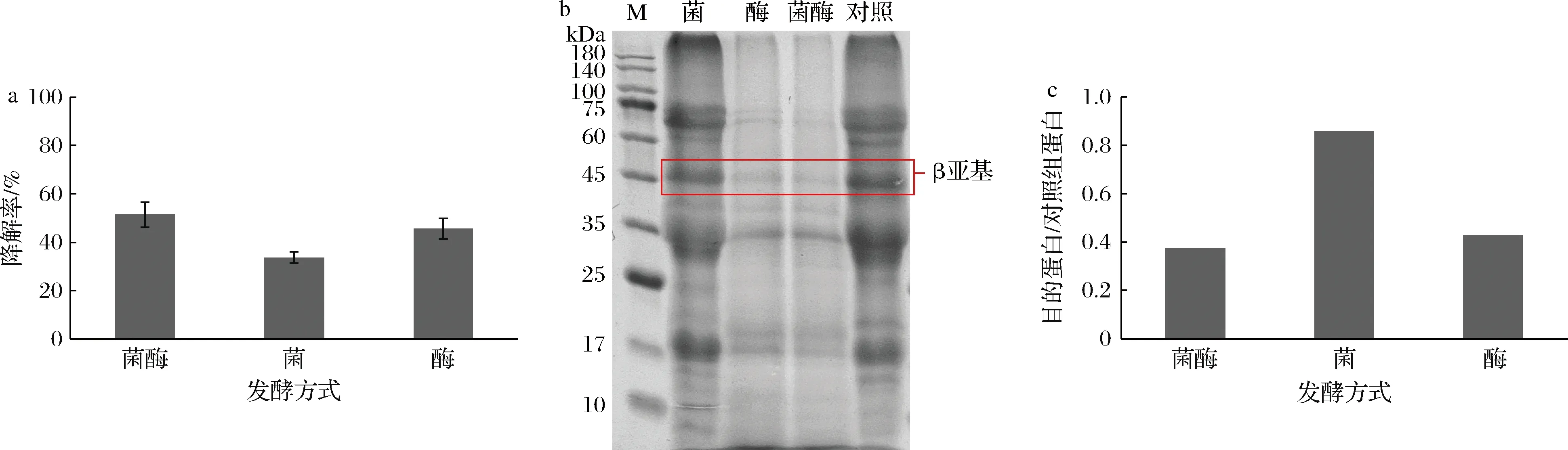
a-β-伴大豆球蛋白降解率;b-SDS-PAGE谱图;c-SDS-PAGE蛋白条带灰度分析
2.3 酶添加量优化
HENG等[21]发现,发酵过程中蛋白酶的活性主要受微生物分泌蛋白酶的量、pH值、微生物分泌的酶对蛋白酶的降解以及某些酶抑制成分等因素的影响。在菌酶协同发酵工艺条件下,图3-a中随着碱性蛋白酶酶量的增加,β-伴大豆球蛋白β亚基的降解率呈上升趋势。其中,50~200 U/g添加量间的降解效率提升最为明显,在此区间内酶解底物是过量的,加酶量越多,酶解反应产物就越多。此后随着酶添加量增加,降解程度变化较小,说明酶解底物反应趋于饱和,添加过多蛋白酶并没有较好的降解效果,还会造成蛋白酶的浪费[21]。经过60 h发酵,200 U/g酶添加量组豆粕β-伴大豆球蛋白降解率可达61.94%。SDS-PAGE验证结果显示(图3-b),随着酶量的增加,β-伴大豆球蛋白β亚基条带逐渐变浅,当酶量≥100 U/g时效果更为明显。因此,选择200 U/g作为碱性蛋白酶的最佳添加量。
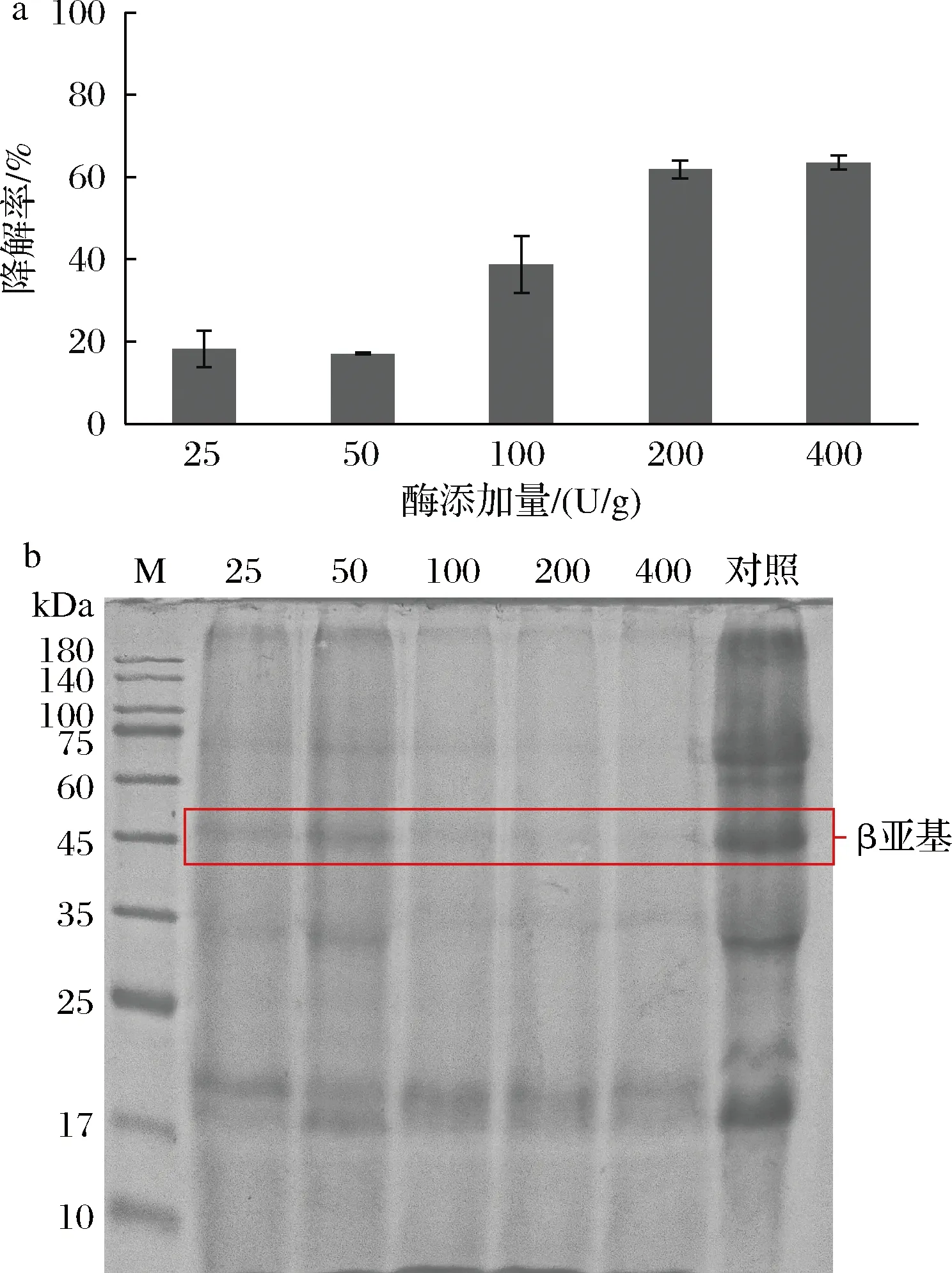
a-β-伴大豆球蛋白降解率;b-SDS-PAGE图谱
2.4 菌液接种量优化
由图4-a可知,随着枯草芽胞杆菌20522接种量的增加,发酵豆粕的β-伴大豆球蛋白降解率呈现先增加后下降的趋势。当枯草芽胞杆菌接种的质量分数为7%时,降解率最高达到62.78%;当枯草芽胞杆菌接种的质量分数大于10%时,发酵豆粕的β-伴大豆球蛋白降解率反而呈现下降的趋势。在类似的枯草芽胞杆菌和中性蛋白酶协同发酵豆粕的研究中,也存在随着菌液接种量的增加,发酵豆粕肽含量先增加随后下降的现象,这可能是因为小肽含量先随发酵降解蛋白而增加,随后又被分解成更小的片段而导致出现下降[23]。常见的豆粕发酵工艺中添加枯草芽胞杆菌菌液接种量大多在5%~15%[24-25]。因此,选择7%作为枯草芽胞杆菌20522最佳接种量(质量分数)。此外,在β-伴大豆球蛋白降解程度较高时,SDS-PAGE图谱难以观察出组间差异,而纳米金适配体传感器的检测结果则能够清晰、灵敏的反映出各实验组豆粕的β-伴大豆球蛋白降解率。
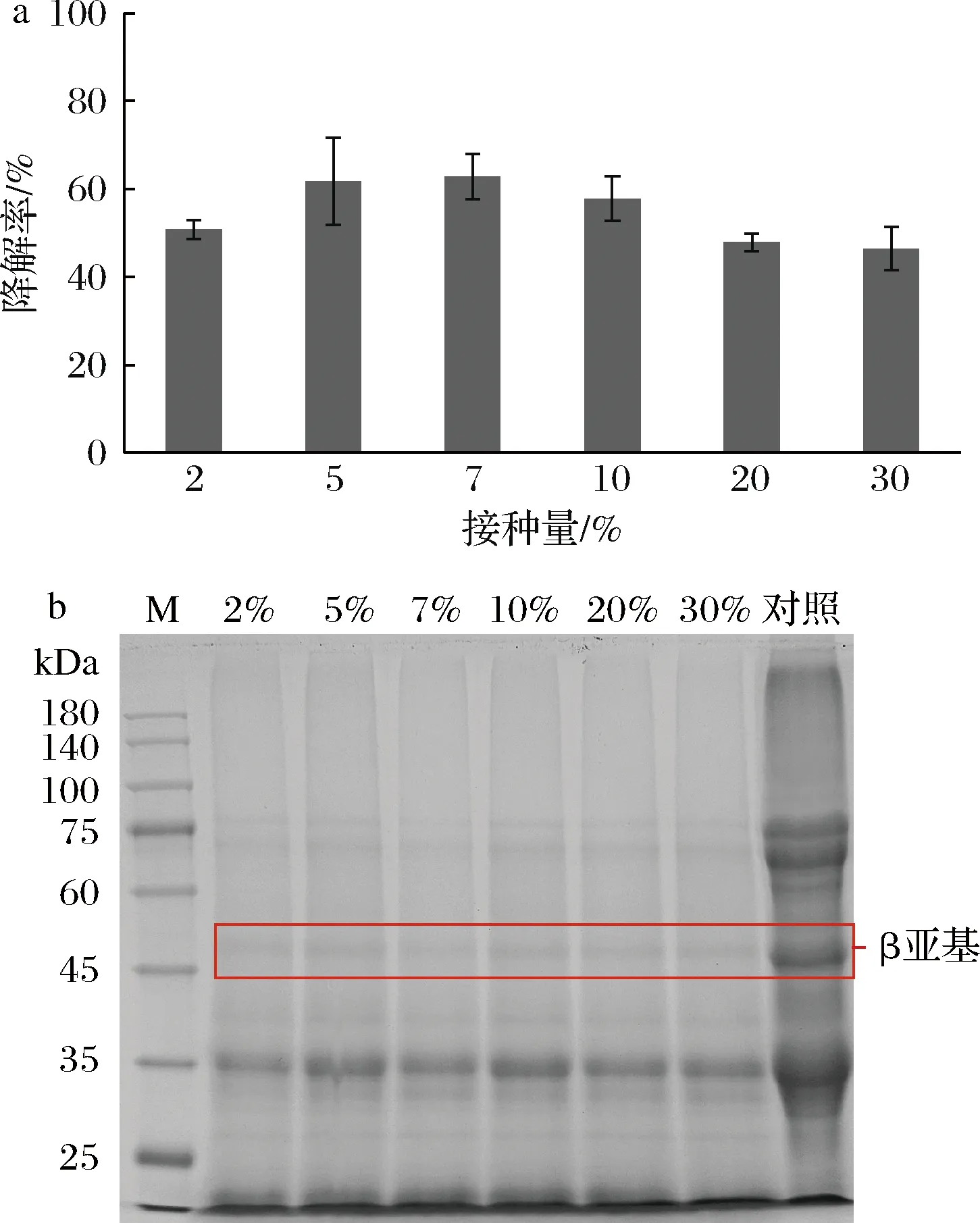
a-β-伴大豆球蛋白降解率;b-SDS-PAGE图谱
2.5 固态发酵时间优化
发酵过程包括微生物的生长、代谢和物质的降解。这一过程需要一定的时间,但过度延长发酵时间可能会导致有害细菌污染和发酵成本增加等问题[21]。如图5所示,在碱性蛋白酶加酶量200 U/g、枯草芽胞杆菌20522菌液接种量(质量分数)7%、料水比2∶1(g∶mL)、糖蜜质量分数3%、发酵温度30 ℃的条件下,发酵48 ~60 h,蛋白降解率有明显提升。随着发酵时间的增加降解率趋于平稳,在最佳发酵时间72 h时达到最高值75.27%。根据菌酶协同发酵的相关研究,在发酵开始时,添加的蛋白酶和发酵菌株分泌的蛋白酶协同降解蛋白质。随着发酵过程的进行,营养物质和pH逐渐降低,发酵微生物生长缓慢,蛋白酶活性逐渐丧失,因此蛋白降解效率减慢[21, 26]。另一方面,抗原性下降的程度取决于抗原位点的破坏程度。YIN等[8]发现β-伴大豆球蛋白的抗原性在酶解后期略有增加而不是降低,是由于蛋白酶进一步水解肽暴露了一些线性或隐性表位,或者抗原活性低的肽继续水解成高活性的小片段。因此,菌酶协同发酵是降低致敏性的有效方法。
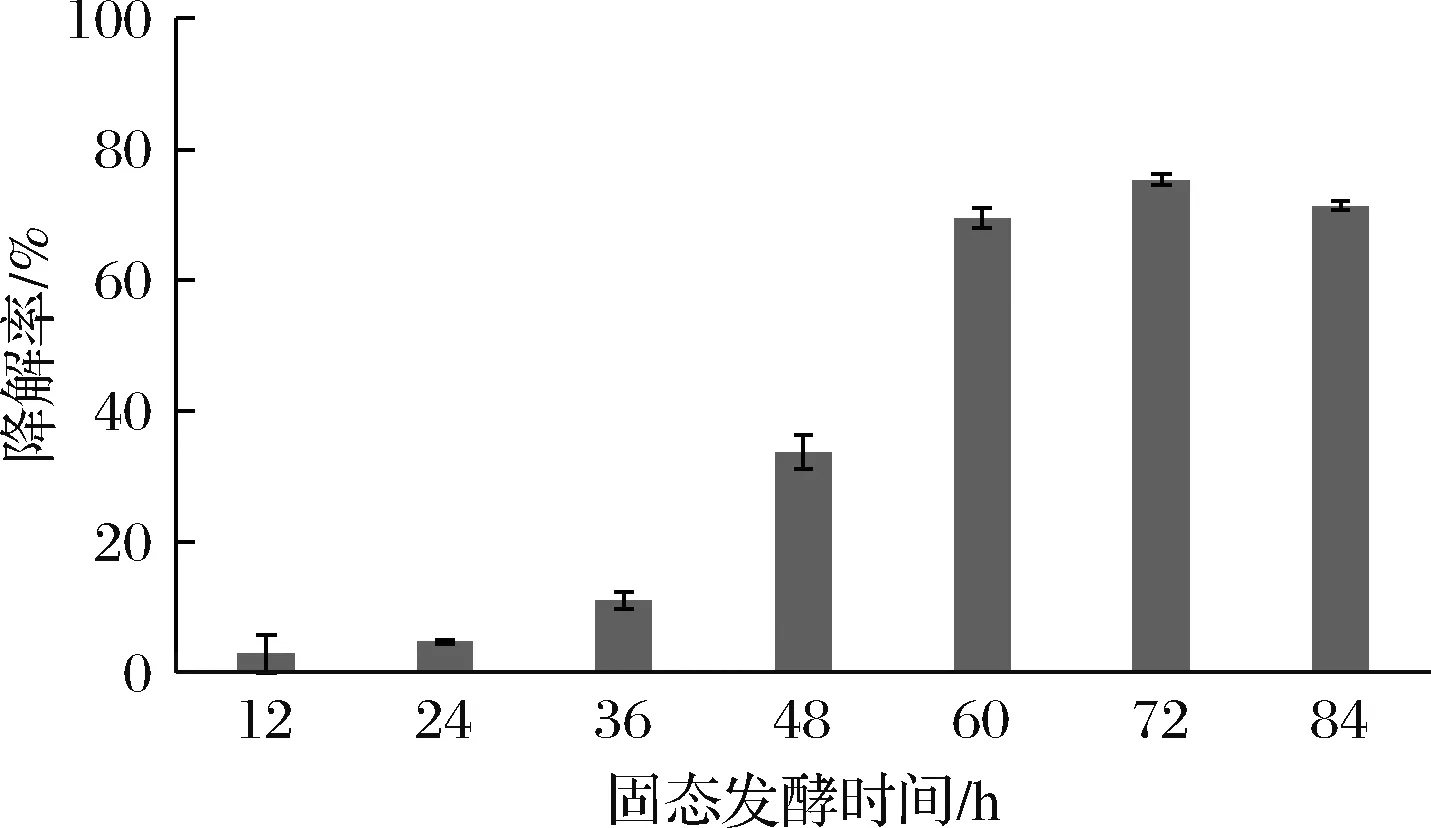
图5 不同发酵时间对豆粕β-伴大豆球蛋白降解率的影响Fig.5 Effect of different fermentation time on degradation of β-conglycinin in soybean meal
2.6 豆粕发酵前后指标分析
2.6.1 游离氨基酸含量
如图6所示,经过200 U/g碱性蛋白酶和7%质量分数的枯草芽胞杆菌协同发酵72 h,豆粕总游离氨基酸的质量分数为3.50%,提高了3.96倍。其中必需氨基酸关乎饲料蛋白质品质优劣,其含量为原来的9.25倍,整体增长幅度较非必需氨基酸更为明显,能有效地提高饲料蛋白质的利用率。在发酵豆粕的必需氨基酸中,赖氨酸(Lys)含量最高(0.37%),其次是亮氨酸(Leu)、酪氨酸(Tyr)、缬氨酸(Val)、苯丙氨酸(Phe)、组氨酸(His)等,色氨酸(Trp)和半胱氨酸(Cys)含量最低。大部分氨基酸含量经过发酵后均升高,尤其是Lys和蛋氨酸(Met)的含量分别为原来的17.27倍和7.73倍。Lys和Met是猪、鸡饲料中最重要的2个限制性氨基酸,对家禽等的生长发育及其他所有氨基酸的消化吸收均有关键影响[27-28]。同时,据NISHIWAKI等[29]报道,当肽段中疏水性氨基酸含量高时,肽的苦味相当强烈,而本研究中蛋白所含的疏水性氨基酸,如Val、Leu、Phe、异亮氨酸(Ile)等,在蛋白降解时从肽段中被释放,从而消除了豆粕的苦味。另一方面,β-伴大豆球蛋白含有大量的谷氨酸(Glu),豆粕发酵后游离Glu的含量显著提高2.55倍。这也证实了β-伴大豆球蛋白在菌酶协同发酵中确实发生了明显的降解。YANG等[30]发现枯草芽胞杆菌对氨基酸含量的提升相较于其他微生物中具有优势。以上结果表明,本研究的最优发酵工艺对蛋白质的降解效果显著,氨基酸含量趋于营养均衡,显著提高了豆粕的营养价值。
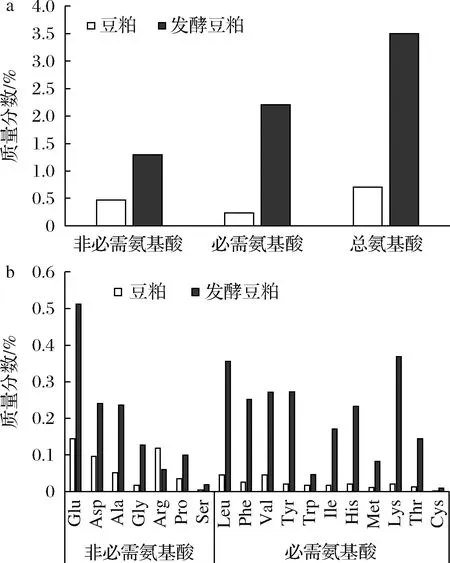
a-必需氨基酸、非必需氨基酸和总氨基酸含量;b-18种常见氨基酸含量
2.6.2 有机酸含量
有机酸作为畜禽的饲料添加剂,可直接参与机体代谢并提高营养物质消化率,如柠檬酸、苹果酸、乳酸等部分有机酸可直接参与机体能量、结构和酶促反应。另一方面,有机酸还可以调节肠道菌群,抑制有害细菌的生长,延长发酵后豆粕的保质期。微生物发酵是产生有机酸的有效途径,HENG等[21]研究发现发酵中添加的蛋白酶能有效地促进糖代谢,分泌更多的有机酸,引起的pH值下降并防止腐败和病原微生物增殖。如图7所示,经过菌酶协同发酵处理后的发酵豆粕中各有机酸含量均有所提高。根据毛银等[31]的研究,不同发酵工艺的豆粕有机酸含量有较大的差别,以乳酸、乙酸和柠檬酸这3种有机酸为主。枯草芽胞杆菌和碱性蛋白酶协同发酵豆粕中含量最高的是柠檬酸,由原来的2.68%提高到5.54%。乳酸也是衡量豆粕质量的重要指标之一,其具有维持动物肠道菌群平衡,减少腹泻,促进钙质的吸收等功能,豆粕经过发酵后乳酸含量达到1.62%,提高了17.72倍。乙酸含量达到1.01%,其作为抗微生物剂、酸度调节剂和酸味剂,提高了饲料的适口性。除此之外,发酵还产生了丙酸和苹果酸,含有多种有机酸的豆粕可以有效的抑制肠道内腐败菌生长,提高机体的免疫力。
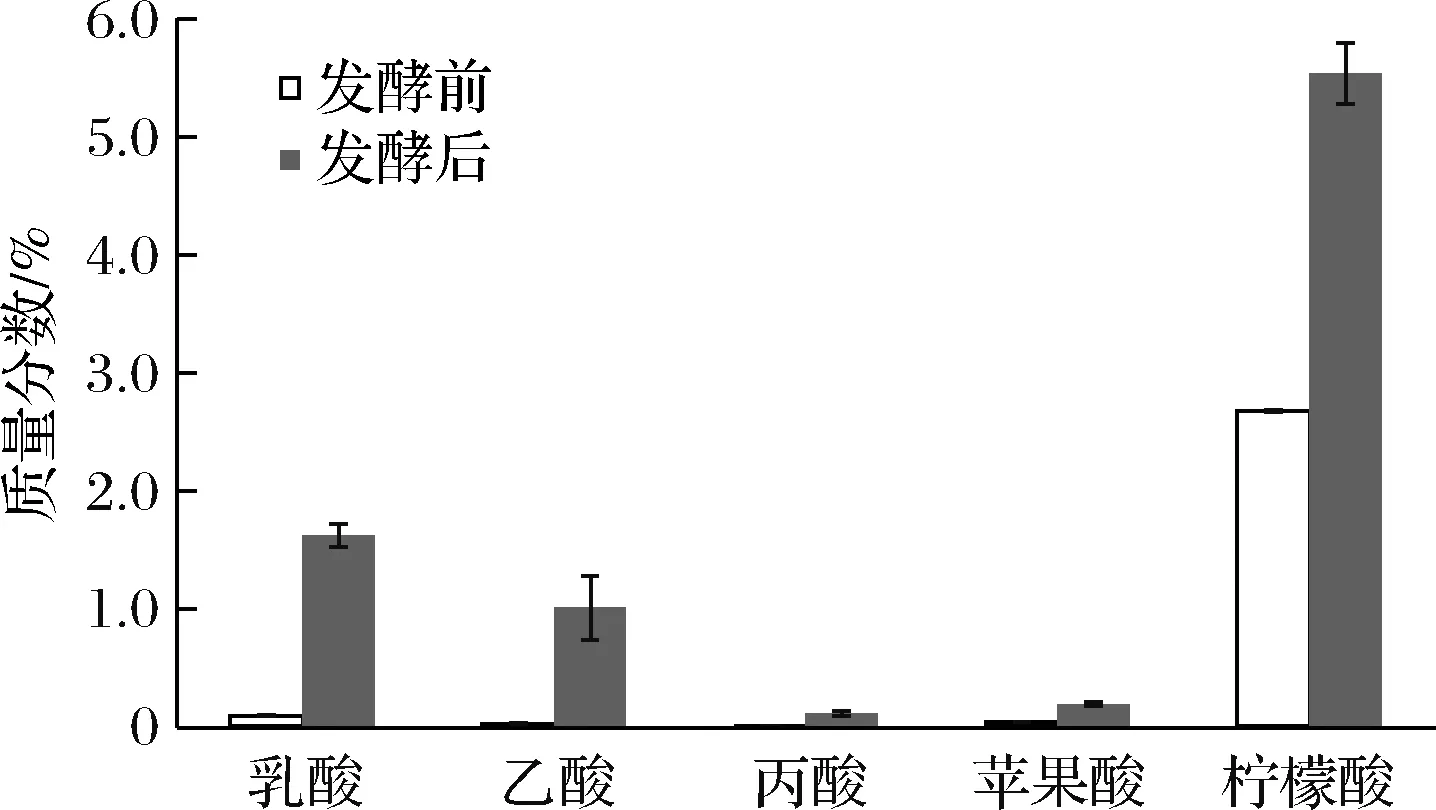
图7 豆粕发酵对有机酸含量的影响Fig.7 Effect of fermentation on organic acid content in soybean meal
3 结论
本研究利用新型纳米金适配体传感器从抗原蛋白降解的角度评价豆粕发酵过程。通过测定β-伴大豆球蛋白降解率,指导优化枯草芽胞杆菌20522/碱性蛋白酶菌酶协同发酵工艺,最终确定了最适发酵条件为:碱性蛋白酶加酶量200 U/g、枯草芽胞杆菌20522菌液接种量(质量分数)7%、料水比2∶1(g∶mL)、糖蜜质量分数3%、发酵温度30 ℃,发酵时间72 h。该菌酶协同工艺在发酵豆粕降解致敏蛋白方面效果良好,β-伴大豆球蛋白降解率可达75.27%,此外氨基酸含量提高3.96倍,乳酸、柠檬酸、乙酸等有机酸的含量也有所上升,发酵豆粕的营养价值和适口性得以显著改善。同时,本研究验证了纳米金适配体传感器在评价豆粕抗原蛋白降解方面具有良好的特异性、稳定性和适用性,为其在饲料行业的开发应用提供理论参考及实践指导。

