基于水-甲醇体系的ONPG 法测定调制乳粉中乳糖酶活力研究
马跃龙,张益萍,褚佳玥
(上海市质量监督检验技术研究院,国家市场监管重点实验室(乳及乳制品检测与监控技术),上海 200233)
0 引 言
乳制品营养丰富,含有高质量的蛋白质、乳糖、多种维生素及矿物质[1-2]。据统计,我国2021 年奶类消费量达到了42.3 kg/人的水平[3]。乳糖是适合人体的碳水化合物,占母乳的7.2%,占牛奶的4.7 %。我国婴儿配方食品、较大婴儿配方食品的国家标准中规定,乳糖含量需达到碳水化合物总量的90%以上。β-半乳糖苷酶(乳糖酶),主要功能为促进乳糖水解生成葡萄糖和半乳糖[4-5]。当人体缺乏乳糖酶时,消化乳糖的功能会受限,较严重时会出现乳糖不耐症[5-7]。乳糖酶缺乏有3种类型:遗传型、继发型、成人型,其中成人型最为普遍[9],大多数人在断奶后会逐渐停止产生乳糖酶[5]。乳糖酶缺乏发病率因地区人种而异,亚洲、非洲地区高于欧美国家[8]。
应对乳糖酶缺乏可以采取两种方式:食用无乳糖乳制品[9-10]或将外源性乳糖酶随乳制品一起摄入。乳制品去除乳糖存在几个弊端:可能导致其他营养成分被破坏[10]、影响婴幼儿钙质吸收[11]、价格通常较高。因酸性乳糖酶更适合于人体,通常被选作外源性乳糖酶来源[1]。孟祥辉[12]的研究结果显示,补充外源性乳糖酶的方法治疗乳糖不耐症的效果显著。王丽[13]等研究发现,乳糖酶能够显著改善乳糖不耐受症状,使患儿获得较好的体重增长。石壮[14]研究结论认为,补充外源性乳糖酶的方式,各项临床症状均优于食用无乳糖奶粉,并且显著改善患者体内的微量元素水平。
随着添加乳糖酶的食品越来越多,其中以调制乳粉最为流行,厂家争相将乳糖酶活力标注于产品标签作为卖点,但是,未检索到食品中乳糖酶活力的测定方法。文献报道关于乳糖酶的检测方法大多为荧光探针法[15-21],也有纳米颗粒探针法[22]、化学发光法探针法[23]、电化学法[24]、拉曼散射法[25]、磁共振法[26]等,主要用于探测人体或动植物组织中微量乳糖酶活力,检出限较低,但线性范围具有一定局限性,仪器成本较高。有报道基于水相的分光光度法和双酶法测定乳糖酶制剂活力[27-28]。其中何云山等[27]指出,双酶法测定乳糖酶制剂中的乳糖酶活力的精密度较差。Sylwia Chojnowska 等[29]使用4-硝基苯酚作为底物,利用分光光度法测定溶血血清中的乳糖酶活力,指出血红蛋白对测定结果有一定影响。
分光光度法因经济、便捷被实验室所青睐。本研究针对适用于人体的酸性乳糖酶进行研究,开发了基于水-甲醇体系的分光光度法测定调制乳粉中乳糖酶活力测定方法,并对开发的方法进行了方法学验证。相较于水体系,提高了反应的灵敏度,可以排除调制乳粉中杂质的干扰,为调制乳粉中乳糖酶活力的准确标注及产品质量监管提供方法依据。
1 材料与方法
1.1 仪器与试剂
3900H 型UV-Vis 紫外分光光度计,日本Hitachi公司;S220-K 型pH 计、XPE204 型分析电子天平,瑞士梅特勒-托利多公司;Eppendorf Centrifuge 5804 高速离心机,德国Eppendorf 公司;Lauda Proline RP845型超级恒温器,德国Lauda 公司;涡旋震荡器,德国Heidolph 公司;Milli-Q 超纯水系统,美国Millipore公司。
邻硝基苯-β-D-半乳糖苷(分析纯),上海普誉;邻硝基苯酚(ONP)(纯度≥99 %),美国Sigma-Aldrich公司;乳糖酶(来源于米曲霉,酶活力1.2×106U/g),中诺生物科技发展江苏有限公司;甲醇、无水乙醇、乙酸、氢氧化钠、碳酸钠(分析纯),国药集团化学试剂有限公司。
1.2 ONPG 法测定乳糖酶活力机理
邻硝基苯-β-D-半乳糖苷(ONPG)由邻硝基苯酚和半乳糖缩合而成,分子结构与乳糖类似,不同之处为用邻硝基苯酚的基团取代葡萄糖基团。采用ONPG 作为底物,在乳糖酶的作用下,水解生成邻硝基苯酚(ONP)和半乳糖,加入碳酸钠将反应体系溶液变为碱性,终止反应。ONP 在碱性条件下显色,具有特征吸收波长,通过分光光度法测定其吸光度,标准曲线外标法测定邻硝基苯酚含量,计算β-D-半乳糖苷酶的酶活力。乳糖酶水解乳糖及ONPG 机理如图1所示。
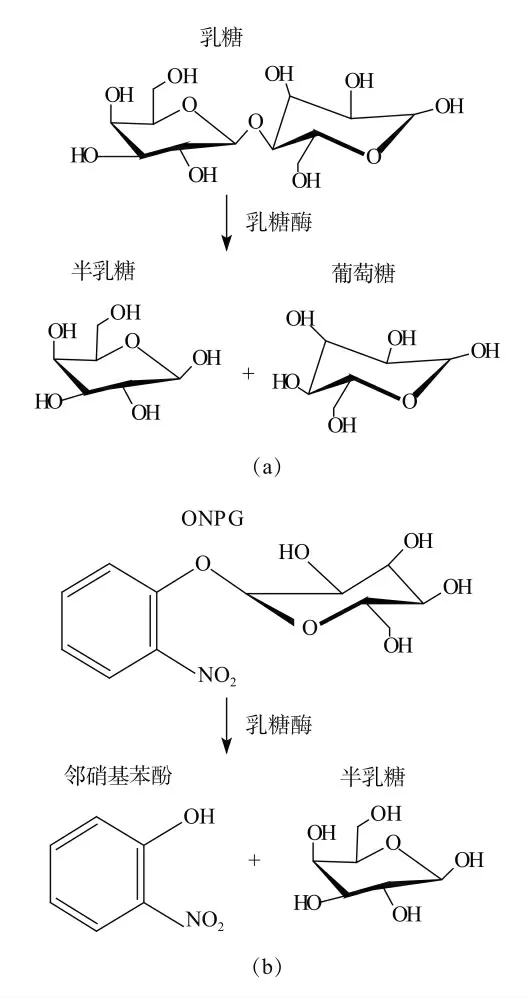
图1 乳糖酶水解乳糖及ONPG 机理示意图
1.3 实验步骤
1.3.1 试剂的配制
1.3.1.1 缓冲液的配制
吸取11.5 mL 冰乙酸,加水至100 mL。称取4 g氢氧化钠,溶于25 mL 水中。将50 mL 冰乙酸溶液与11.5 mL 氢氧化钠溶液混合,加水至约900 mL。用冰乙酸溶液或氢氧化钠溶液调节pH 至4.50±0.02,然后用水定容至1 L。
1.3.1.2 ONPG 底物溶液的配制
称取0.370 g ONPG,加入pH=4.50 的缓冲液约50 mL,充分搅拌溶解,继续用缓冲液定容至100 mL。该溶液用前配制,在4 h 内使用完毕,过时需重新配制。
1.3.2 ONP 标准曲线的配制
称取0.139 g ONP,加入10 mL 无水乙醇,充分溶解后,转移至500 mL 容量瓶,并用水定容,其浓度为2 mmol/L,作为储备液。取适量储备液,补加水至7.5 mL,加入1 g/100 mL 碳酸钠溶液2.5 mL,加甲醇定容至25 mL,配成0.005、0.01、0.02、0.04、0.08、0.12、0.15 mmol/L标准系列溶液。
1.3.3 测试步骤
称取1 g 样品,用缓冲液溶解并定容至50 mL,过滤,稀释。将稀释液与ONPG 溶液分别放入37 ℃水浴中恒温10 min,于0 时刻,吸取0.5 mL 稀释液及2 mL ONPG 溶液迅速充分混合于25 mL 容量瓶中,置于37 ℃水浴中,计时。至反应结束时刻,迅速加入2.5 mL碳酸钠溶液,混匀,终止反应。加入5 mL 水,用甲醇定容,8 000 r/min 离心5 min 去除沉淀。用1 cm 比色皿测定其吸光度,根据标准曲线定量。
1.3.4 计算方法
根据由标准曲线查得的测试液中ONP 含量,按式(1)计算样品中乳糖酶活力。式中C 为测试液中ONP 的含量(mmol/L);f 为样品溶液稀释倍数;W 为样品质量(g),t 为反应时间(min)。
2 结果与分析
2.1 测定条件的确定
2.1.1 测定波长的选择
在文献报道的采用ONPG 分光光度法测定乳糖酶制剂的酶活方法中,测量波长均选择为420 nm[28-29]。为确定最优的测量波长,分别配制浓度为0.12 mmol/L的ONP 的水溶液和水-甲醇(V∶V=2∶3)溶液进行波长扫描,扫描范围400~430 nm,结果如图2 所示。从图2 中可以看出,与文献报道不同,ONP 水溶液的最大吸收峰出现在415 nm 处,而本研究提出使用的水-甲醇体系的最大吸收峰出现在416 nm 处,两者均与文献报道的420 nm 有所区别[27-28]。此外,对比ONP 水溶液及水-甲醇体系溶液波长扫描曲线,可以看出,在相同的ONP 浓度,相同的碳酸钠含量的条件下,水-甲醇体系的吸光度响应值,显著高于水体系。这意味着,在相同的条件下,水-甲醇体系可以获得更低的检出限,在灵敏度方面具有显著的优势。
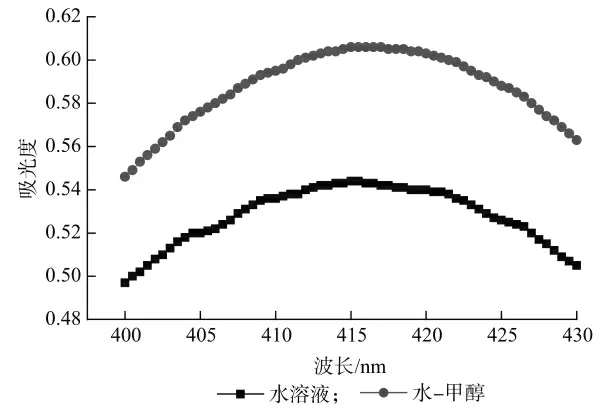
图2 ONP 水溶液及水-甲醇溶液波长扫描图谱(CONP=0.12 mmol/L)
2.1.2 碳酸钠溶液浓度的选择
ONPG 法测定乳糖酶活力,在结束时加入碳酸钠,将反应体系变为强碱性,具有两个功能:终止反应和使ONP 显色。ONP 的显色受pH 值影响,酸性条件下不显色,中性至碱性条件下显色,吸光系数与pH 值有关。为确定最优的碳酸钠添加量,本研究考察了碳酸钠添加量对ONP 吸光度的影响。在25 mL容量瓶中,加入1.9 mL 2 mmol/L 的ONP 溶液,补加5.6 mL 水,加入2.5 mL 碳酸钠溶液(浓度分别为0.01~10 g/100 mL),用甲醇定容至25 mL,于416 nm测定吸光度。进行5 平行试验,测定结果如图3 所示。由结果分析,水-甲醇体系中,ONPG 在416 nm 下的吸光度总体随着碳酸钠浓度的升高而升高,在0.01~0.02 g/100 mL 之间吸光度迅速升高,随后趋于平缓。碳酸钠浓度高于2 g/100 mL 以上,有一个小幅度上升的趋势,浓度进一步升高,吸光度有所下降,且偏差显著升高。这是因为在添加碳酸钠的浓度在较低的范围变化时,给整体溶液带来的pH 值变化较明显,随着浓度升高,pH 变化趋于平缓,从而吸光度变化也随之减小。当碳酸钠浓度达到5 g/100 mL 时,溶液出现了较明显的浑浊现象,至10 g/100 mL 时,出现较多的沉淀,这是碳酸钠溶液在水-甲醇中的溶解度下降引起的。
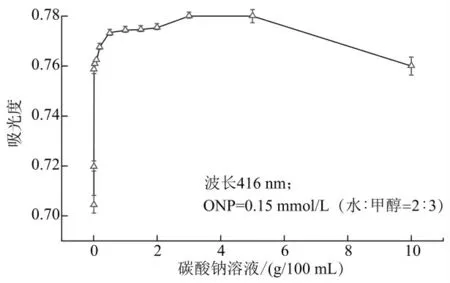
图3 添加不同浓度碳酸钠溶液的ONP 的水-甲醇溶液吸光度(n=5)
碳酸钠溶液通过改变反应体系的pH 值使反应终止,同时使ONP 显色。选择碳酸钠浓度变化对吸光度影响较小的浓度范围,不仅可以避免碳酸钠浓度偏差对测试结果的影响,更加提高了该反应体系对样品本身酸碱度及缓冲液的适应能力。由图中可以看出,在碳酸钠溶液0.5~2 g/100 mL 区间,吸光度变化对碳酸钠溶液的变化不敏感,本研究最终选择碳酸钠溶液的浓度为1 g/100 mL。
2.1.3 杂质的去除
调制乳粉产品的水溶液呈较稳定的悬浊液状态,且不可通过过滤、离心等物理方法使其澄清,这一特性是乳粉研发者所追求的高溶解性的品质要求,却给分光光度法的应用带来困难。在进行吸光度测试前,需要消除悬浮物对吸光度的影响。因乳糖酶本身即为大分子蛋白质,如在酶反应前进行杂质的去除,可能引起乳糖酶同时析出,导致测量结果偏低。因此本研究选择反应结束后去除杂质的办法。
因ONPG 方法测定乳糖酶活力的特殊性,反应测试目标产物ONP 需要在碱性条件下显色,故相当多的杂质去除方法如三氯乙酸沉淀法、盐酸沉淀法、乙酸锌-亚铁氰化钾共沉淀法受到限制。本研究曾尝试使用乙酸锌-亚铁氰化钾共沉淀法去除杂质,然后使用盐酸调节pH 至与碳酸钠溶液等效的强碱性pH 值,虽然可以实现溶液的澄清,但加标回收率急剧下降,且测试结果极不稳定。这可能因为亚铁氰化钾和乙酸锌在共沉淀去除其他杂质的同时,也将部分ONP 一同去除,导致溶液中ONP 浓度呈现出无规律的下降。
本研究使用水-甲醇体系,首先使底物ONPG 与样品中的乳糖酶在水溶液中进行反应,加入碳酸钠溶液使反应终止后,加入甲醇,混合后经离心去除杂质。经过实验证实,当水相与甲醇比例为2∶3 时,可以很好地解决杂质干扰的去除问题,同时可以提高ONP 的响应。典型水体系和水-甲醇体系对同一产品的测试结果溶液对比如图4 所示。

图4 水体系及水-甲醇体系最终比色溶液状态对比
2.1.4 反应时间的选择
考察反应时间对ONPG 法测定乳糖酶活力测定结果的影响。选取2 款含乳糖酶的乳粉进行测定,测定时间分别选取5、10、15、20、25、30、40 min,进行7平行试验,检测结果见表1。由表1 可以看出,反应时间为5~20 min 时,检测结果较稳定;反应时间为20~40 min 时,检测结果有升高的趋势,这可能是因底物ONPG 在反应条件下自行分解引起吸光度上升导致的。当反应时间为5 min 时,RSD 显著偏高,这是由于测定的操作过程消耗时间的差别引起的,当反应时间延长至10 min 时,RSD 显著降低。
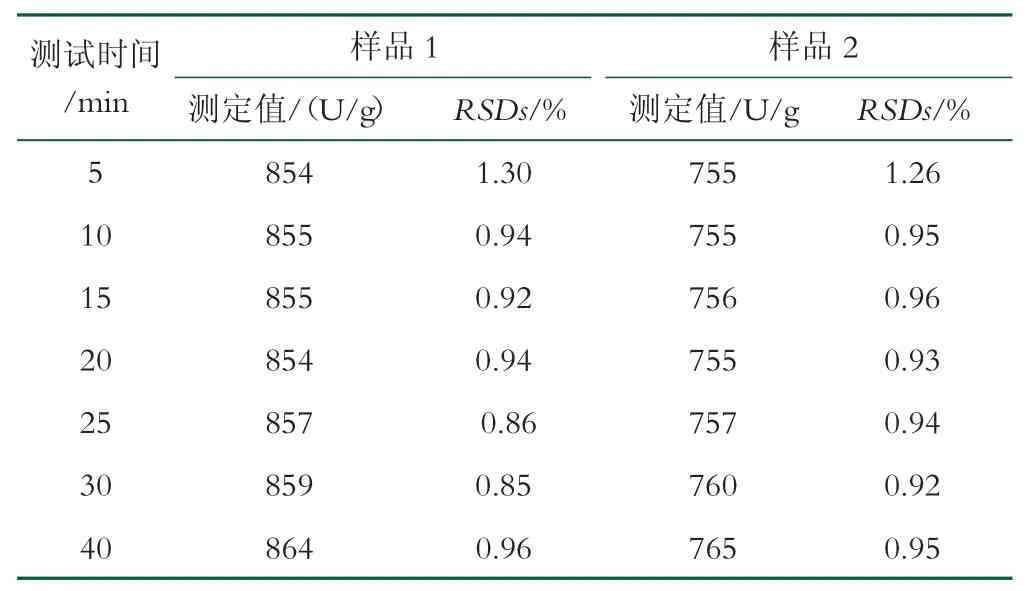
表1 不同反应时间调制乳粉中乳糖酶活力测定结果(n=7)
适当增加反应时间,不仅可以减小实验的相对偏差,还可以一定程度提高方法的响应,降低检出限。ONPG 配制成水溶液后,较容易分解,需在4 h 内使用完毕,因此反应时间不宜过长。综合考虑方法的精密度、检出限、检测效率等因素,本研究将反应时间确定为15 min。
2.1.5 显色液稳定性的确认
本研究使用的水-甲醇反应体系,按照2.1.2 的研究结果,选取的碳酸钠浓度为1 g/100 mL,减小了碳酸钠浓度偏差对反应结果精密度的影响。但需考察添加碳酸钠后对反应终止效果和显色液稳定性的评估。选取3 款添加乳糖酶的调制乳粉进行测试,在反应结束并去除杂质后,计时、比色。每隔5 min 进行一次吸光度测试,见表2。由结果可以看出,加入2.5 mL 1 g/100 mL 的碳酸钠溶液,可以确保反应终止,且显色液稳定性良好。因此,对于反应终止后的最终显色液,吸光度测试时间可以不做严格规定,30 min 内比色可以保证检测结果的稳定性。
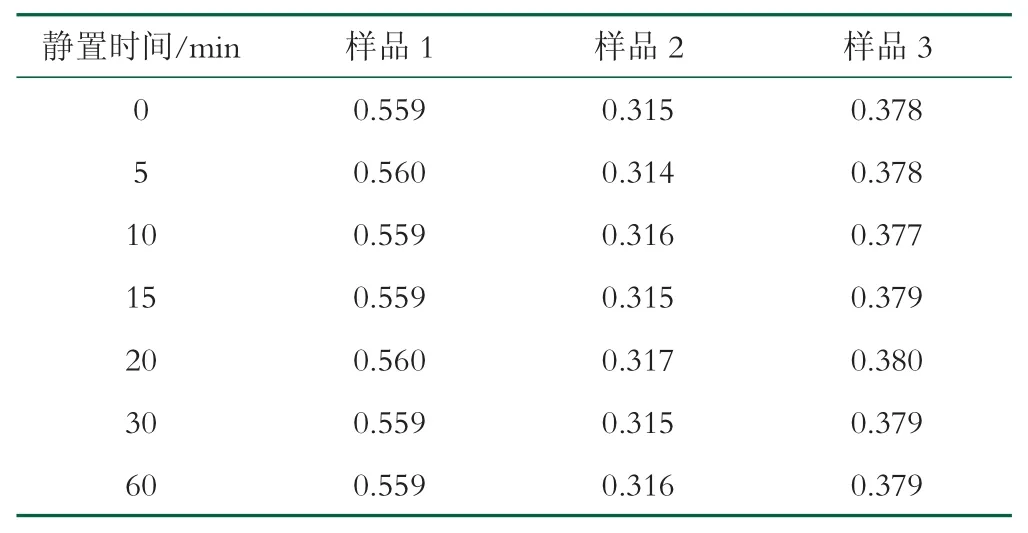
表2 显色液吸光度随时间变化
2.2 方法学参数
2.2.1 方法的线性
按照本方法进行测定,配制0.005~0.150 mmol/L的ONP 水-甲醇溶液,测定其吸光度,以浓度为横坐标X,吸光度为纵坐标Y,进行线性回归分析,得线性回归方程Y=5.1141X+0.0004,R2=0.9997。
2.2.2 方法的检出限、定量限
分光光度测定方法,以0.010 对应的目标物含量为检出限,以3.3 倍的检出限作为定量限。将吸光度0.010 带入线性回归方程,并按式(1)计算酶活力,得本方法检出限为0.32 U/g,定量限为1.0 U/g。
2.2.3 方法的精密度、回收率
选取3 款经测试无乳糖酶活力的调制乳粉产品,分别进行3 个水平的加标回收率测定(n=7)。根据检测结果计算回收率(Recoveries)及相对标准偏差(Relative standard deviations,RSDs),如表3。本方法加标回收率95.0%~98.8%,相对标准偏差0.78%~0.98%。
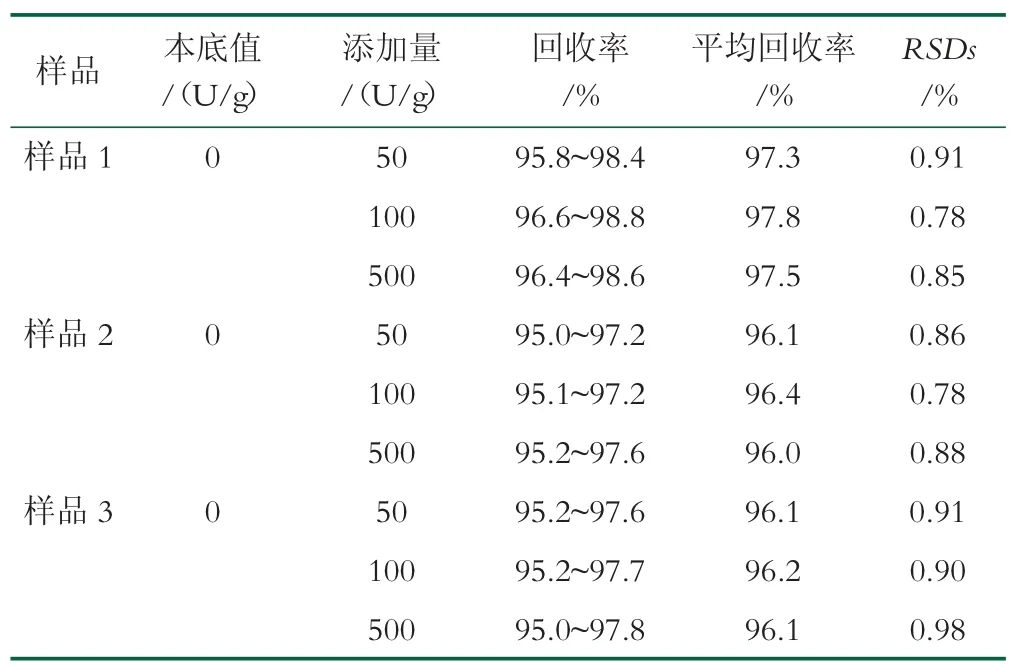
表3 方法的精密度和回收率(n=7)
2.3 实际样品检测
按照本研究制定的测定方法,对市场销售的9 款含乳糖酶的调制乳粉中乳糖酶活力进行测定,每个产品重复测定7 次,测定结果见表4。

表4 实际样品测定(n=7)
3 结 论
在我国,因乳糖酶缺乏原因导致乳制品消化受限的人群基数较大。从营养健康的角度,人们越来越倾向于采用补充外源性乳糖酶的方式来应对这一问题,含乳糖酶的调制乳粉,是一种十分便捷的补充方式。本研究在水体系中ONPG 法测定乳糖酶的方法基础上,开发了适用于含乳糖酶调制乳粉中乳糖酶活力的测试方法。采用水-甲醇体系,不仅可以消除乳粉中多种杂质的影响,而且提高了吸光度响应。在0.005~0.150 mmol/L 范围内,线性相关系数0.9997,线性良好,定量限为1.0 U/g,加标回收率在95.0%~98.8%,相对标准偏差0.78%~0.98%,可以作为常规实验室测定调制乳粉中乳糖酶活力的经济、可靠的测定方法。

