热处理对羊乳和骆驼乳中美拉德反应产物和挥发性风味物质的影响
郭银萍,赵晓璇,姚萍,逄晓阳,王筠钠,李红娟,谢宁,于景华,吕加平,张书文
(1.天津科技大学食品科学与工程学院,天津 300457;2.中国农业科学院农产品加工研究所,北京 100193)
0 引 言
牛乳的营养价值丰富,含有人体生长所需求的基本营养物质,是我国消费者的主要饮用乳品[1-2]。随着生活水平及健康意识的提高,消费者也越来越重视乳制品的品质,普通牛乳已经不能满足消费者的需求,市场上相继出现了羊乳和骆驼乳等特色乳制品[3]。羊乳的平均脂肪粒径比牛乳小,更容易消化吸收,并且比牛乳的致敏性低[4]。而骆驼乳含有人体膳食所需的必需氨基酸,β-酪蛋白比例高,并含有多种功能性蛋白质(如免疫球蛋白、溶菌酶和乳铁蛋白)[5]。
乳制品经过热处理虽然可以杀死或控制微生物,但也可以诱导产生美拉德反应[6]。美拉德反应又分为初始阶段、中期阶段和高级阶段,5-羟甲基糠醛(5-Hydroxymethylfurfural,5-HMF)和糠氨酸(Furosine,FRS)是乳中评估热处理是否加工过度的标志性产物[7],其对人体健康有潜在危害[8-9]。除此之外,美拉德反应也会产生不同于原料乳的风味物质。因此,本研究以羊乳和骆驼乳为研究对象, 研究了热处理过程中美拉德产物的变化规律。同时通过电子舌、电子鼻和固相微萃取-气相色谱-质谱联用仪(Solid phase microextraction-gas chromatography-mass spectrometry,SPMEGC-MS)和顶空气相离子迁移谱(Headspace-gas chromatography-ion mobility spectrometry,HS-GC-IMS)对不同热处理的羊乳和骆驼乳中挥发性风味物质进行测定,为羊乳和骆驼乳的生产加工提供理论依据。
1 材料与方法
1.1 材料
1.1.1 样品的收集
鲜山羊乳是来自山东省潍坊市奶山羊养殖场;鲜骆驼乳样品采自内蒙古阿拉善。将采集后鲜乳随机分成3 组。以不处理的鲜羊乳和鲜骆驼乳为对照,对鲜羊乳和鲜骆驼乳分别通过UHT 杀菌机来制备巴氏杀菌(75 ℃、15 s)、超巴氏杀菌(120 ℃、15 s),以及超高温瞬时灭菌 ( ultra-high temperature instantaneous sterilization,UHT)(羊乳:137 ℃、4 s ,骆驼乳:135 ℃、5 s)样品。每个温度的波动范围为±2 ℃。样品收集后,在-80 ℃下储存30 d,完成各指标的测定。
1.1.2 仪器与设备
PEN3.5 型电子鼻仪器,德国Airsense 公司;AsrreeII/LS16 电子舌仪器,法国Alpha MOS 公司;7890A-7000B SPME-GC-MS 联用仪,美国Agilent 公司;1260 超高效液相色谱、HSS T3 色谱柱(100 mm×4.6 mm,2.5 μm)、C18色谱柱(250 mm×4.6 mm,5 μm),美国Waters 公司;HS-GC-IMS,德国Dortmund 公司;UHT 杀菌机,日本Powerpoint International 公司。
1.2 方法
1.2.1 糠氨酸含量的测定
糠氨酸含量的测定是依据国际标准ISO 13875并作部分改进[10]。吸取2.00 mL 样品于耐热密封管中,再吸取6.00 mL 的盐酸溶液(10.6 mol/L),混匀后在110 ℃下加热水解18 h。取出样品冷却后过滤,将1 mL滤液与5.00 mL 6 g/L 的乙酸铵溶液混匀后过0.22 μm水相滤膜,经超高效液相色谱仪进行测定。以含0.1%三氟乙酸的去离子水为流动相A,甲醇为流动相B,流速为0.5 mL/min,检测波长为280 nm。对于标准曲线的构建,分析了已知量为25、12.5、6.25、1.25 和0.625 μg/mL 的标准FRS 样品。所有样品一式三份的分析。
1.2.2 5 -羟甲基糠醛含量的测定
5-羟甲基糠醛含量的测定是参照NY/T 1332-2007 并作部分改进[10]。将10 mL 样品与5 mL 0.15 mol/L草酸溶液混匀,90 ℃水浴加热30 min,冷却至室温后再加入10 mL 甲醇并摇匀,再分别加入3 mL 乙酸锌和亚铁氰化钾,摇匀静置15 min,再在4 ℃下以6 000 r/min的速度离心10 min,将上清液经两次过滤后用甲醇定容至50 mL。经0.45 μm 水相滤膜过滤后,经超高效液相色谱仪进行测定。甲醇为流动相A,去离子水为流动相B,流速为0.8 mL/min,检测波长为284 nm,洗脱条件为15%:85%甲醇和水。所有样品都进行了一式三份的分析。
1.2.3 电子鼻测定风味
电子鼻风味的测定是参照依胜男等[2]的方法并作部分改进。在电子鼻专用瓶中加入2 mL 的羊乳和骆驼乳样品并在室温条件下平衡30 min,在电子鼻设备上测定各样品间气味的差异。电子鼻设备设置:流速为300 mL/min,载气是空气,顶空60 s,延滞180 s。样品是选取48~50 s 较平稳的一个阶段进行信息的采集。每个样品重复4 次,选取其中3 个较好的作为平行。
1.2.4 电子舌测定风味
电子舌风味的测定是参照宋慧敏等[12]的方法并作部分改进。将1 mL 样品用去离子水稀释100 倍,过0.45 μm 水滤膜后,放在电子舌专用烧杯中进行样品的测定。每个样品测定7 次,选取后3 次作为平行。所有样品一式三份的分析。
1.2.5 挥发性风味物质的测定
羊乳的测定方法(SPME-GC-MS)[13]。在专用瓶中加取2 mL 样品,密封。分析在Agilent 7890B 仪器上进行,带有5977A 质量选择检测器(7890A-7000B,Agilent Technologies, 美国)。以氦气为载气,恒流1.5 mL/min。固相微萃取气相色谱-质谱仪程序从初始温度35 ℃保温5 min,以5 ℃/min 升温至140 ℃,保持2 min,再以10 ℃/min 的速度升温到250 ℃保持3 min。进样条件为:直接毛细管界面温度280 ℃,离子源温度230 ℃,四极温度150 ℃,进样器温度250 ℃,两次进样1 μL,脉冲无分流(172.4 kPa 空气,0.5 min)。所有样品进行3 次重复实验。
骆驼乳的测定方法(HS-GC-IMS)[14]。将2 mL 样品置于20 mL 顶空样品瓶中,然后将样品在500 r/min和80 °C 下孵育20 min。之后,注入500 μL 的顶空体积,注射针温度为85 °C。 采用装有色谱柱MXT-5(0.1 μm,15 m×0.53 mm)的气相色谱仪在60 °C 下分离,氮气(纯度≥99.999%)为载气,初始载气流速设定为2 mL/min。在0~2 min 内维持在2 mL/min,载气速度在2~10 min 内从2 mL/min 线性增加到10 mL/min。载气速度在10~20 min 内从10 mL/min 线性增加到100 mL/min。最后,载气速度在20~30 min 内从100 mL/min 线性增加到150 mL/min。漂移气体流速设置为150 mL/min。柱温设定为60 °C,一式三份进行GC-IMS 分析。
1.3 数据处理
使用SPSS Statistics 22 进行显著性分析;使用Origin2018 软件进行绘制柱状图和雷达图;GC-MS和GC-IMS 的数据采用TBtools 软件进行热图的绘制。主成分分析(principal component analysis,PCA)使用Win Muster 软件进行数据的处理。每个样品重复3 次。
2 结果与分析
2.1 不同温度和时间处理骆驼乳和羊乳样品中FRS 含量的变化规律
FRS 含量与美拉德反应程度密切相关,是美拉德反应初级阶段的产物,美拉德反应与加热的温度和时间有密切的关系,加热温度越高或加热时间越长,美拉德反应的程度会越剧烈,形成的美拉德产物中FRS 含量会越高[2]。FRS 的生成速率受蛋白含量的影响较大,因此,FRS 含量的表示单位应以蛋白为基础(mg/100 g 蛋白质)[13]。Mehta 等[16]测得鲜牛乳和巴氏杀菌牛乳几乎不含任何的FRS,其值<10 mg/100 g 蛋白质,只有高巴氏杀菌样品显示含量约为30 mg/100 g蛋白质,而在本实验中鲜羊乳和鲜骆驼乳中的FRS 含量3.69 和6.89 mg/100 g。Mendoza 等[18]测得巴氏山羊乳(35.8 mg/100 g 蛋白质)和鲜羊乳(6.8 mg/100 g 蛋白质)以及UHT 处理过的山羊乳(154.3 mg/100 g 蛋白质)中的FRS。由图1 中可以看出,巴氏羊乳、超巴氏羊乳和UHT 羊乳中FRS 含量分别为10.55、67.54 和130.22 mg/100 g 蛋白质,而巴氏骆驼乳、超巴氏骆驼乳和UHT 骆驼乳中FRS 含量分别为9.14、33.44 和52.25 mg/100 g 蛋白质。鲜羊乳中FRS 的含量低于鲜骆驼乳FRS 的含量;但是经过热处理后,热处理羊乳样品中FRS 含量明显高于热处理骆驼乳样品。UHT羊乳和UHT 骆驼乳中FRS 含量分别是鲜乳的35 倍和8 倍,出现上述现象的原因可能是由于较高温度的处理,使乳中糖类和蛋白质的结构发生改变,加快了美拉德反应的进程,从而增加FRS 的含量[17]。除了在热处理过程中,FRS 含量随热处理强度的增大而增加外,在贮藏过程中,随贮藏时间延长和温度升高,FRS 含量也持续增加[18]。
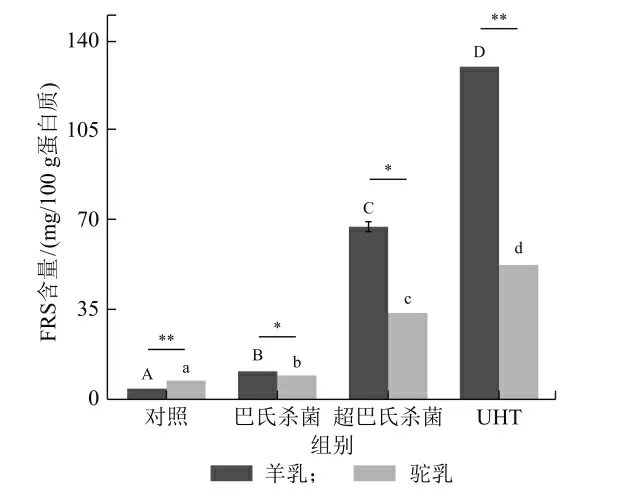
图1 不同热处理羊乳和骆驼乳中FRS 含量的变化
2.2 不同温度和时间处理骆驼乳和羊乳样品中5-HMF含量的变化规律
在酸性环境下,乳糖与蛋白质反应产生的化合物会水解形成5-HMF,而且乳糖分解成葡萄糖和半乳糖,会加速5-HMF 的形成[19]。Haghani-Haghighi 等[20]在鲜牛乳和巴氏杀菌牛乳中检测不到5-HMF,而Morales 等[21]在巴氏杀菌牛乳中发现5-HMF 为2.49 μmol/L,在UHT 牛乳中,乳糖含量为120 和250 mg/L 时,5-HMF 含量为5.6 和8.7 μmol/L。而本实验中,在鲜羊乳和鲜骆驼乳中未检测到5-HMF。如图2 所示,巴氏羊乳、超巴氏羊乳和UHT 羊乳中5-HMF 含量分别为0.32、0.67 和1.31 mg/100 g 蛋白质,而巴氏骆驼乳、超巴氏骆驼乳和UHT 骆驼乳中5-HMF 含量分别为0、0.96 和1.79 mg/100 g 蛋白质。巴氏羊乳中5-HMF 的含量高于巴氏骆驼乳中5-HMF 的含量,但是经过超巴氏和UHT 热处理后的羊乳样品中5-HMF含量明显低于热处理骆驼乳样品。生驼乳和巴氏杀菌驼乳中未检测到5-HMF,而在超巴氏杀菌驼乳和UHT 驼乳中检测到5-HMF,可能是由于5-HMF 可以通过赖氨酸和乳糖之间的美拉德反应产生,但是也可以在没有赖氨酸的情况下,通过温度的升高(>100 ℃)导致乳糖的异构化和降解产生[22]。
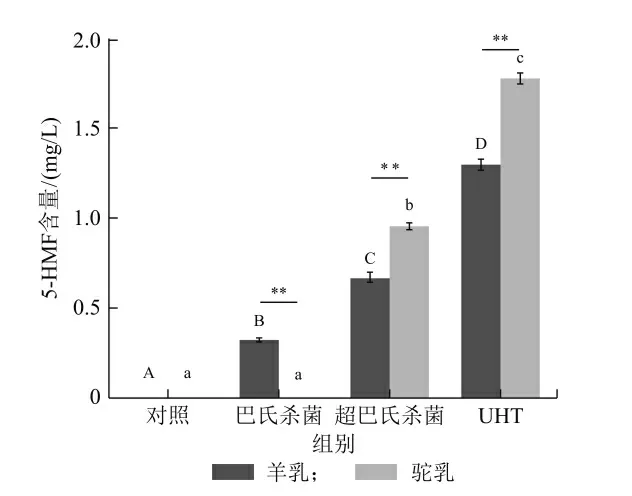
图2 不同热处理羊乳和骆驼乳中5-HMF 含量的变化
5-HMF 含量与FRS 含量增长趋势可反映美拉德反应中占主要进程的特定反应阶段。高萌[19]同样发现,随热处理温度增高和时间增长,巴氏杀菌牛乳和UHT 牛乳中5-HMF 含量均发生了明显变化,热处理温度越高和热处理时间越长,导致牛乳中5-HMF含量越高。在本实验中发现鲜羊乳和鲜骆驼乳进行UHT 处理时,美拉德反应第1、第2 阶段的同时剧烈进行,进而导致FRS 和5-HMF 的含量均激增。
2.3 不同处理乳样品中电子鼻的结果分析
由图3 可知,图(a)和图(b)第一主成分和第二主成分的总贡献率分别为98.61%和98.80%,几乎包含了大部分的样本信息,可有效地表达各样品间的差异性。图3 中的椭圆代表每个样品的整体信息特征,图形的距离代表样品之间气味的差异;表格中黑色数值代表有显著性差异,绿色数值代表有极显著性差异。从图3(a)中可以看出巴氏杀菌羊乳与超巴氏杀菌羊乳气味较类似,与UHT 乳、鲜羊乳样品气味差异较大,这可能是由于鲜乳的UHT 处理会导致乳中蛋白质、碳水化合物、脂类以及其他化合物的挥发性化合物的形成[23]。在图3(b)中可以看出,不同热处理的骆驼乳样品间有显著差异,其中巴氏杀菌骆驼乳与超巴氏杀菌骆驼乳气味较类似,与UHT 骆驼乳样品气味差异较大,可能是由于高温处理使乳中形成了大量的酮类物质,进而造成风味的显著差异,而温度的高低和时间长短对新物质形成及其含量的大小起了至关重要的作用,所以,在PCA 图中可观察到样品风味存在明显差异。在图3 中,随着热处理程度的增加,羊乳和骆驼乳样品的PCA 图呈逆时针方向旋转,由此可推测其他热处理羊乳和骆驼乳样品的PCA 图,为电子鼻数据提供理论依据[24]。

图3 不同热处理样品电子鼻PCA 图
2.4 不同处理乳样品中电子舌的结果分析
乳中因为含有丰富的乳糖、蛋白质、脂肪以及一些无机盐如钠盐和钙盐等,在加热过程中蛋白质之间互相作用,蛋白质分解为肽段和氨基酸,与乳糖发生美拉德反应,与无机盐发生螯合作用等都会对乳的滋味产生很大的影响[25]。在本实验中,电子舌配备的5 个传感器可以分别对酸、咸、鲜、甜和苦这5 种滋味作出评价,但是由于甜和苦这两种滋味的呈味物质较为复杂,因此仪器不能进行具体评价。如图4 所示,利用电子舌传感器对不同处理条件下骆驼乳和羊乳中酸、咸和鲜味的味感值进行测定,其中UHT 羊乳的鲜味最大和咸的味感值最小,超巴氏羊乳的酸味和咸味的味感值最大;鲜骆驼乳的酸味和鲜味的味感值最大且咸味最小,巴氏骆驼乳和UHT 骆驼乳的味感值较接近。从图4(a)中可以看出,与鲜羊乳相比,超巴氏羊乳与UHT 羊乳的味感值变化较为明显。而从图4(b)可以看出,与鲜骆驼乳相比,巴氏骆驼乳、超巴氏骆驼乳和UHT 骆驼乳中酸味和鲜味的味感值变化较为明显,导致滋味发生改变的可能原因是在加热过程中蛋白质与乳糖发生美拉德反应,对鲜乳的滋味产生较大改变,此外,热处理后脂肪的水解会影响鲜乳的酸味,钠盐和钙盐会在咸味方面发挥一定作用[26]。电子舌检测时获取的信息是来自于乳制品中的所有物质(包括挥发性,半挥发性和难挥发性物质等);虽然电子鼻的操作过程较电子舌更为简便,操作时间更短,但是电子鼻检测时获取的样品信息主要来自于奶制品中挥发性和半挥发性物质,因此电子舌较电子鼻能更完整获取样品信息,得到更精确的结果。为了达到尽可能在短时间内将样品精确的区分的目的,可以将电子鼻和电子舌的结合以此来解决问题。
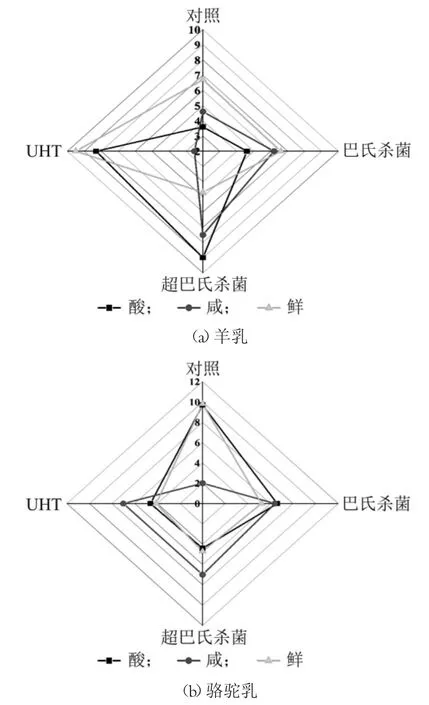
图4 不同热处理样品电子舌雷达图
2.5 不同温度和时间处理骆驼乳和羊乳样品中挥发性风味物质的变化规律
结果见图5。

图5 不同热处理样品挥发性风味物质热图
由图5 可见,通过GC-MS 和GC-IMS 分别检测不同热处理条件下骆驼乳和羊乳中挥发性风味物质并结合聚类分析和归一化处理得到的热图。从图5(a)可以看出,与鲜羊乳相比,经过热处理后的样品中挥发性风味物质在组成和含量上发生了较大变化,尤其是UHT 羊乳。随着热处理强度的增加,酸类(壬酸、癸酸和辛酸等)和酯类物质(乙酸己酯和异戊酸异戊酯)的含量减少,酮类(2-壬酮和2-甲基-3-辛酮)和醇类物质(糠醇、异辛醇和正己醇)的含量增加。有文献报道,羊乳中辛酸、壬酸和癸酸等酸类物质可以产生膻味[27],而在本实验中经热处理的羊乳中该类物质相对含量减少,说明热处理在一定程度上可以降低羊乳的膻味。在巴氏杀菌羊乳和超巴氏杀菌羊乳样品中,挥发性化合物的类型相似,但由于加热强度不同,风味物质的相对含量也不同,与电子鼻的结果一致。从图5(b)可以看出,在鲜骆驼乳样品中检测到苯乙醛、丁醛、3-甲基丁醛、2-甲基丁醛、3-羟基-2-丁酮和异戊醇,驼乳中的醛类和酮类在加热前后变化很大。在羊乳样品中检测出酸类物质和烷类物质,而骆驼乳样品中并未检测到。醛类、酮类和有机酸是美拉德反应的主要产物[23]。
乳中风味的形成除了自身形成的风味外,在加工阶段中原料乳的一些酶发生了酶促反应,从而形成了独特的风味。在热处理过程中,乳中风味变化的关键与美拉德反应、脂质降解过程中乳脂蛋白、乳清蛋白和乳脂小球膜中其他蛋白质的热变性有关[28]。随着科技的发展与检测技术的提升,SPME-GC-MS 的检测方法为样品中风味物质的分离和鉴别提供了很大的帮助,可以较大程度地分离和鉴别乳中挥发性风味物质。何静等[22]利用GC-MS 技术鉴定出醇类、醛类、酮类、酯类是骆驼乳中主要风味物质,不同的加热方式处理的骆驼乳主要的挥发性成分差异显著,尤其UHT处理后驼乳中的烷烃类化合物较多。依胜男等[2]运用SPME-GC-MS 技术鉴定不同热处理牛乳中挥发性风味物质,发现热处理强度越大,风味物质种类增加越多,其中醛类、酮类和酯类相对含量增加明显,部分酸类相对含量明显减少。
3 结 论
本研究对不同热处理的羊乳和骆驼乳中美拉德产物和挥发性风味物质进行比较,证实了热处理会使羊乳和骆驼乳中美拉德产物含量增加,也会使挥发性风味物质发生变化。其中鲜羊乳、巴氏杀菌羊乳、超巴氏杀菌羊乳和UHT 羊乳中FRS 的含量随着热处理强度的增加逐渐增加,分别是驼乳的0、1.15、2.02 和2.49 倍;鲜驼乳、巴氏杀菌驼乳、超巴氏杀菌驼乳和UHT 驼乳中5-HMF 的含量随着热处理强度的增加逐渐增加,分别是羊乳的0、0、1.43 和1.37 倍。电子鼻和电子舌测定的羊乳和骆驼乳中气味和滋味差异显著,但是气味和滋味之间也存在一定的相关性。通过GC-MS 和GC-IMS 测定不同热处理条件下羊乳和骆驼乳中挥发性风味物质, 其中UHT 羊乳中风味物质与其他羊乳样品间差异极其显著,而鲜驼乳中风味物质与其他热处理驼乳样品差异极其显著。由此可见,不同的热处理方式对羊乳和骆驼乳的风味品质有不同的影响。 因此,在满足产品工艺和杀菌要求的情况下,尽可能的提高产品的营养和活性物质水平、降低美拉德反应产物的生成、改善产品风味。

