微生物β-半乳糖苷酶的研究进展
刘芳宁,梁 琪,张 炎,张卫兵*
(甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
乳糖酶(β-galactosidase)是一种无毒无副作用的生物酶制剂,国际生化编号EC3.2.1.23。其能够催化β-半乳糖苷化合物中β-半乳糖苷键发生水解,还具有转半乳糖苷的作用。目前,乳糖酶的应用领域很广。在乳品工业中,乳糖酶可用于生产低乳糖制品和低聚半乳糖[1]。在乳品加工中,采用乳糖酶水解乳糖,可以避免冷冻浓缩乳制品中乳糖的结晶、乳清析出等问题。在酸奶的生产中,可加速酸化反应和提高发酵效率,使酸奶具有特有的乳香风味。在干酪生产中,可以加速干酪的成熟[2]。在分析方面,将葡萄糖氧化酶和乳糖酶联合使用制备生物传感器,直接测定牛乳等乳制品中乳糖的含量,该法简便快捷,费用低廉[3]。在环境保护方面,乳糖酶可以分解乳清中的乳糖,减缓乳清排放后较高的生物需氧量对水造成的污染[4]。其他方面,乳糖酶与桃果实成熟前期果实的软化启动密切相关,能促进其成熟及软化[5]。
关于乳糖酶的研究,国外学者从20世纪60年代开始研究,已成功地找到产乳糖酶的微生物,并研制了一系列乳糖酶商品,现已投入市场,如荷兰帝斯曼公司生产的商品名为Maxilact的乳酸克鲁维酵母乳糖酶;美国纽约酶发展公司生产的来源于黑曲霉的Fungal lactase等。近几十年国内对乳糖酶的研究也成为了热点,我国对乳糖酶的研究主要集中在产酶菌株的筛选,产酶条件的优化,酶的分离纯化及酶学性质研究等方面,哈尔滨美华生物技术股份有限公司的脆壁克鲁维酵母中性乳糖酶已经面世,但我国乳糖酶的产量低限制了其在乳品工业中的应用。由此可见,研究开发乳糖酶新产品将为我国乳糖酶的大规模工业化生产和乳品工业的飞速发展奠定基础。
1 乳糖酶的来源
乳糖酶的天然来源十分丰富,包括多种动物、植物、微生物。乳糖酶广泛存在于桃、杏、苹果和咖啡豆等植物中,豌豆、苜蓿、高粱、玉米的根尖组织能在酸性环境中分泌乳糖酶[6]。动物来源主要有肠、脑等器官和皮肤组织。
基于微生物的快速生长、高效代谢和易于控制等特性和微生物乳糖酶源丰富、性质多样、生产成本低、周期短,而且不受季节、地理位置等因素的影响的优势,产乳糖酶的微生物备受人们关注。微生物乳糖酶的来源主要有细菌、酵母、霉菌。细菌来源的乳糖酶的种类较多,其中包括大肠杆菌(Escherichia coli)、环状芽孢杆菌(Bacillus Circulans)、枯草芽孢杆菌(Bacillus subtilis)、巨大芽孢杆菌(Bacillus megaterium)、嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)、凝结芽孢杆菌(Bacillus coagulans)、卷曲乳杆菌(Lactobacillus crispatus)、长双歧杆菌(Bifidobacterium longum)、德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckiissp.bulgaricus)等;产乳糖酶的酵母主要有乳酸克鲁维酵母(Kluyveromyces lactis)、脆壁克鲁维酵母(Kluyveromyces fragilis)、马克斯克鲁维酵母(Kluyveromyces marxianus)、伪热带念珠酵母(Candida pseudotropicalis)、普鲁兰久浩酵母(Guehomyces pullulans)等;目前应用较多的霉菌乳糖酶产生菌主要是米曲霉(Aspergillus oryzae)和黑曲霉(Aspergillus niger),亮白曲霉(Aspergillus candidus)、产 黄 青 霉(Penicillium chrysogenum)、炭黑曲霉(Aspergillus carbonarius)等也能产生乳糖酶[7-8]。但是应用于食品工业的酶必须符合FDA的GRAS(generally regarded as safe)的要求。现在商品化的乳糖酶都来源于微生物发酵法,基本上由酵母和霉菌发酵获得。
2 微生物乳糖酶的分离纯化
乳糖酶的分离和纯化是研究其酶学性质、结构与功能的基础。一般情况下希望酶有较高的纯度,以避免其他酶(如蛋白酶)对酶的稳定性造成影响。乳糖酶分离纯化的过程一般包括预纯化过程和层析分离2个过程。
2.1 预处理
微生物来源的乳糖酶有胞内酶和胞外酶。在预处理中,产胞外酶的菌体的发酵液经过离心沉淀菌体,上清液即为乳糖酶粗酶液;胞内酶则需进行细胞破碎才能释放乳糖酶。粗酶液的浓缩手段主要有:超滤、等电点沉淀法、硫酸铵盐析沉淀法和有机溶剂沉淀等方法。
2.2 层析技术
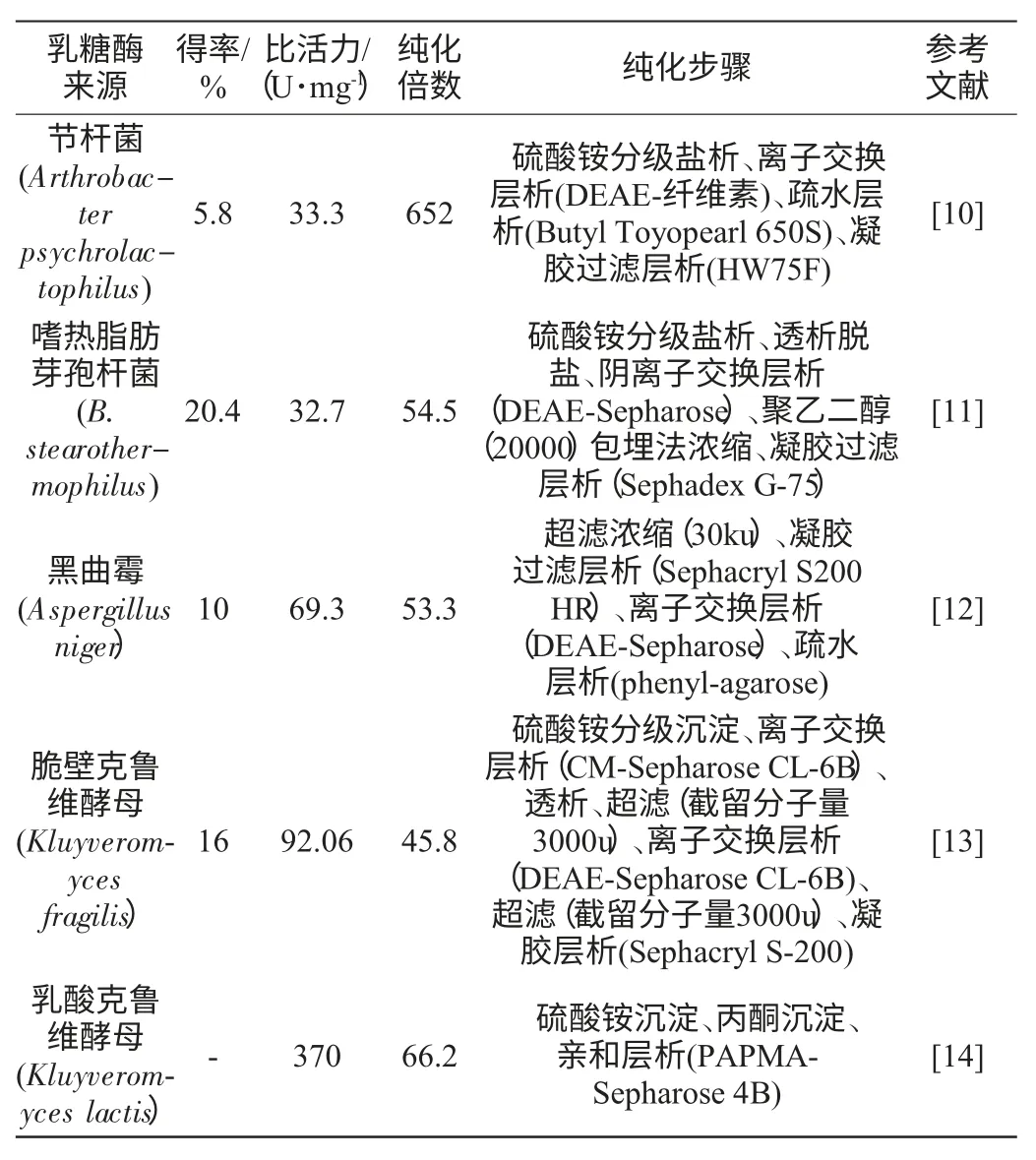
表1 不同的层析方法联合使用分离纯化乳糖酶[10-14]Table 1 Purification of β-galactosidase by joint application of different chromatography method[10-14]
预处理之后,一般采用层析方法进一步分离以获得高纯度的乳糖酶。表1列举了用不同的层析方法联合使用分离纯化乳糖酶的技术。从表1可以看出,乳糖酶的纯化过程中,人们用的常规的方法有:离子交换层析、凝胶过滤层析、亲和层析及疏水层析法等。由于酶蛋白来源的多样性和复杂性,导致酶的分离纯化没有固定的方法,因此在分离纯化过程中通常需要多种层析方法协同作用使酶得到纯化。工艺次序及层析分离次序的选择对纯化倍数和回收率的影响是至关重要的,纯化工艺次序的选择策略为:(1)选择不同机制的分离单元组成一套工艺;(2)将含量多的杂质先分离去除;(3)尽早采用高效的层析分离手段,将最昂贵、最费时的分离单元放在最后阶段[9]。
3 微生物来源的乳糖酶的特性
对乳糖酶生物学特性的研究,探索其规律特性,将为生产应用提供切实可行的理论依据。微生物乳糖酶酶源丰富、性质多样主要表现在其最适温度、最适pH值及其分子量等方面,表2列举了不同微生物来源的乳糖酶的性质。
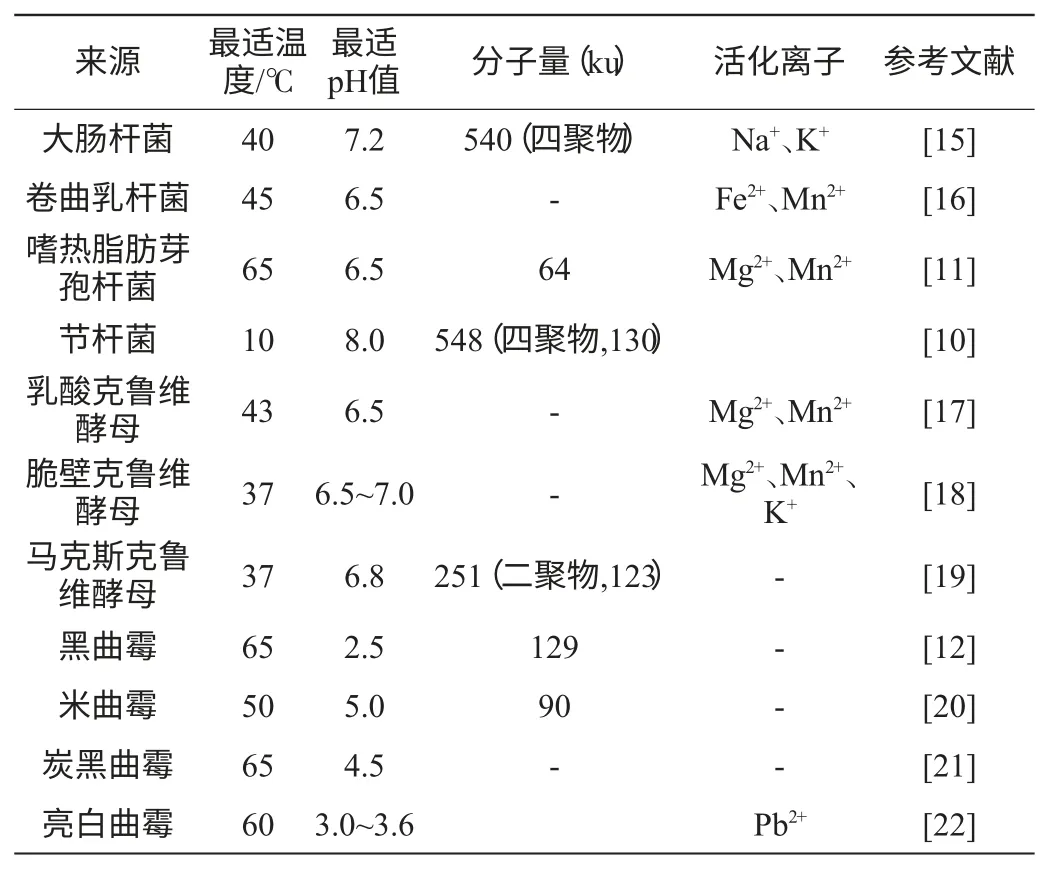
表2 不同微生物来源的乳糖酶的特性Table 2 Characterization of microbial sources of β-galactosidase
3.1 细菌产生的乳糖酶
细菌乳糖酶最适pH值接近中性,具有易于发酵、酶的性质稳定等优势,但由于安全性问题,在食品工业中的应用受到了限制。细菌产生的乳糖酶大多为常温乳糖酶,如大肠杆菌和卷曲乳杆菌ATCC33820乳糖酶的最适温度分别为40℃、45℃[15-16]。但有些耐热细菌乳糖酶的作用温度较高,来源于嗜热脂肪芽孢杆菌乳糖酶最适温度可达65℃,有些嗜冷菌乳糖酶的作用温度较低,节杆菌乳糖酶最适温度为10℃[10]。细菌产生的乳糖酶最适pH值近中性,一般为6.5~7.5,但节杆菌的最适pH值为8。
随着人们对基因工程法提高乳糖酶产量的研究,多种来源的乳糖酶的基因已经被克隆。细菌来源的乳糖酶基因大小和序列存在差异,但也有一定的同源性。Li对巨大芽孢杆菌2-37-4-1乳糖酶进行了纯化,并对乳糖酶基因(bgaBM)进行了分析,该酶的分子量为120ku,bgaBM核苷酸序列开放阅读框包含3105个bp,其编码蛋白质分子量为118ku[23]。乳酸球菌ATCC7962的乳糖酶的氨基酸序列与E.coli的相似性为46%,并且其催化酶活性的部位也含有Glu-429、Tyr-475[24]。嗜酸乳杆菌乳糖酶基因有lacZ和lacLM,对lacZ基因进行了研究,表明该基因开放阅读框含有2004个bp,编码的乳糖酶的分子量为70ku[25]。来源于地衣芽孢杆菌的乳糖酶基因(lacA),其开放阅读框包含2055个bp,可编码684个氨基酸,其蛋白质分子量为160ku(二亚基,80)。地衣芽孢杆菌与枯草芽孢杆菌乳糖酶的氨基酸残基相似性为76.6%,与产气荚膜梭菌的相似性为47.9%,与环状芽孢杆菌的相似性为36.9%,与嗜热脂肪芽孢杆菌的相似性为35.6%,与噬栖热菌的相似性为26.8%[26]。
3.2 酵母菌产生的乳糖酶
酵母所产乳糖酶最适pH值接近中性,被广泛应用于牛乳和乳清中乳糖的水解,但由于是胞内酶,不易提取。沈为群等[14]研究表明,来源于乳酸克鲁维酵母的乳糖酶最适作用pH值为6.4~6.8,最适温度为40℃,其分子量为85ku,Mg2+、Mn2+和还原剂巯基乙醇的存在能提高酶活力。谭树华等[18]研究了脆壁克鲁维酵母菌乳糖酶的性质,该酶最适作用pH值为6.5~7.0,最适作用温度为37℃,该酶在pH 值5.8~7.3范围内比较稳定,Mn2+、Mg2+、Na+、K+及微量Ca2+对酶有激活作用。马克斯克鲁维酵母乳糖酶的最适作用温度、pH值分别为37℃、6.8[19]。金属离子能在酶蛋白中形成盐桥,稳定酶蛋白的立体结构;巯基乙醇可以防止酶的活性中心受到破坏而提高了酶活性。
3.3 霉菌产生的乳糖酶
霉菌来源的乳糖酶是胞外酶,提取方便,在pH值为2.5~5.4和温度为50℃左右时,相对活力最高,主要用来处理生产干酪后的酸性乳清。CONNELL S等[21]研究表明,黑曲霉的最适温度为65℃,最适pH为2.5,分子量为129ku,该乳糖酶在pH值为2.0的条件下,作用2h之后,可保留68%的活力。从土壤中选育到的米曲霉ATCC20423乳糖酶在pH值为3.5~8.0的范围内酶活力稳定,温度为50℃,pH值为5.0时,相对活力最高,酶的相对分子质量是90ku,以ONPG为底物,Km为0.77mmol/L,0.01~0.1mmoL/L氯汞基苯甲酸盐和碘乙酰胺对酶活力有抑制作用,表明该酶不以巯基为活性中心[20]。炭黑曲霉菌能产生2种乳糖酶,β-gal 1 和β-gal 2,其最适作用温度分别为55℃、65℃。在胃环境中这2种酶均有良好的稳定性,尤其是β-gal 1,在胃蛋白酶参与和pH值为2.0的条件下,作用2h之后,仍保留70%的活力[24]。
霉菌来源的乳糖酶基因及氨基酸序列之间的同源性较高。亮白曲霉乳糖酶基因组DNA序列含3458bp,其中含有8个内含子,cDNA编码区长3015bp,共编码1005个氨基酸,亮白曲霉与同一属的黑曲霉的同源性为60%左右。其与商业化应用的米曲霉ATCC20423的乳糖酶氨基酸同源性达到99.5%,二者的氨基酸序列仅有3个氨基酸不同[25]。
4 产乳糖酶菌株的选育
4.1 高活力菌株的选育
目前,乳糖酶在乳品、医药、分析、环境保护等方面都具有广阔的应用前景,然而较低的产量限制了乳糖酶的工业化生产及应用。因此,通过遗传改良选育高活力菌株,是实现乳糖酶高效生产的关键。国内外的研究目前主要集中在诱变育种、基因重组上。
常规的诱变技术分为物理诱变和化学诱变两大类。杜海英等[27]采用紫外线诱变和Co-60γ射线协同诱变的方法,通过4min的紫外线照射和剂量为500Gy的γ射线对黑曲霉Uco-3的原生质体进行诱变,获得一株产高温乳糖酶的高产突变株,突变株产酶活力达44.37U/mL,是出发菌株Uco-3的2.73倍。李宁[28]以产高温乳糖酶的黑曲霉菌株D2-26作为出发菌株,经1次紫外线和3次Co-60γ射线诱变后获得1株产高温乳糖酶的黑曲霉突变株,该突变株产生的高温乳糖酶活力达16.27U/mL。宋礼[29]用0.1mol/L的亚硝酸处理亮白曲霉孢子悬液11min,涂布平板,再用15W的紫外灯,15cm垂直照射培养平板5min。分离获得的乳糖酶酶活从原来的0.13U/g提高到了1.1U/g。SIDDIQUE MA等[30]对黑曲霉通过γ-射线进行选育,得到突变株的产酶量比出发菌株提高了2倍,随机扩增多态性(RAPD)表明突变株和出发菌株的基因相似性为94.83%,突变株和出发菌株的发酵初始pH值和温度分别为5.5和30℃时,产酶能力都最高且突变株的产酶能力高于出发菌株。
采用基因工程技术可以克隆不同物种的乳糖酶基因,并且在易于培养、生长繁殖迅速的微生物体内表达,从而实现大规模、低成本生产乳糖酶。燕艳[31]从新疆火焰山筛选出来的菌株Huob菌株,克隆了Huob的乳糖酶基因,然后将此基因转化到原核表达载体PET-30(a)中,构建了重组质粒,实现了β-半乳糖苷酶基因在大肠杆菌中的表达,表达量为7.64U/mL,相对原始菌株乳糖酶的表达量提高了18倍。CHEN W等[32]将来源于嗜热脂肪芽孢杆菌的耐热乳糖酶基因(bgaB)转化到枯草芽孢杆菌WB600中,获得成功表达,乳糖酶活力提高了45倍。KHALED M等[33]研究表明,0.5%的乳糖和半乳糖能诱导产气肠杆菌(Enterobacter aerogenes)乳糖酶的产生,而0.5%葡萄糖等其他糖对产酶起抑制作用,他将菌血红蛋白基因(VHb)导入该菌后,能克服0.5%葡萄糖等其他糖的对产酶的抑制作用,并且能提高诱导乳糖酶的生成。DOMINGUES L等[34]构建载体将黑曲霉乳糖酶基因lacZ转化到酿酒酵母(Saccharomyces cerevisiae)表达系统中,乳糖酶活力达到350U/mL,比原始菌株的酶活提高20倍。
基因工程技术比诱变育种更能有效的提高乳糖酶的产量。诱变育种技术操作简便,科研实践中采用较为广泛。基因工程技术很可能从根本上解决乳糖酶产量的问题,但基因工程技术潜在的危害也不能被忽视。
4.2 微生物产生乳糖酶的获取方法
4.2.1 传统方法获取乳糖酶
用于细胞内乳糖释放手段主要分为化学方法和物理方法。化学方法是利用有机溶剂与细胞膜中的磷脂与脂蛋白相互作用,使细胞膜结构破坏,增加膜的通透性而释放乳糖酶。有机溶剂使用较多的是甲苯、乙酸乙酯、和对羟基苯甲酸、SDS-氯仿、甲苯-丙酮等。物理方法是使用物理剪切作用、撞击作用、空穴作用来破坏细胞壁,使乳糖酶彻底释放出来,常用的方法是超声波破碎法、高压均质法、球磨法。物理和化学的各种提取酶的方法,需要经过比较来选用。
4.2.2 基因工程技术获取乳糖酶
长期以来胞内乳糖酶提取困难、生产成本高一直是制约乳糖酶生产发展的重要因素。继而人们采用基因重组方法将乳糖酶自行分泌到胞外。张伟等[35]通过基因重组技术将亮白曲霉乳糖酶基因lacb′整合到毕赤酵母染色体上,实现了乳糖酶胞外高效分泌表达,重组酵母乳糖酶的活力为3600U/mL。BECERRA M等[36]以热敏型酵母突变体酿酒酵母为表达载体,异源表达乳酸克鲁维酵母乳糖酶基因,重组体的乳糖酶活性为75U/mL。
5 展望
随着人们对乳糖酶的进一步研究,乳糖酶的应用范围越来越广,微生物来源的乳糖酶备受人们关注。不同来源的乳糖酶的特性不同,其应用范围也存在差异,获得更多的产乳糖酶的微生物资源可以提高酶的适应性。筛选乳糖酶高产菌株,以降低乳糖酶生产应用成本。筛选高产、耐热乳糖酶生产菌株,可避免使用常温乳糖酶对牛奶体系造成的杂菌污染、水解速率慢、酶的热稳定性差、酶需要量大的问题。开发低温乳糖酶微生物资源,可以适应低温条件下乳中乳糖的水解。为了使我国乳品工业蓬勃发展,开发高质量的乳糖酶及对乳糖酶生物学特性的研究,探索其规律特性,实现乳糖酶工业化低成本生产已成为刻不容缓的事。
[1]PARK AR,OH DK.Galacto-oligosaccharide production using microbial β-galactosidase:Current state and perspectives[J].Appl Microbiol Biotechnol,2010,85(5):1279-1286.
[2]GOODA E,BEDNARSSKI W,POZNANSKI S.The protein degradation in cheddar cheese manufactured from milk treated with lactase[J].Mil Chwissenschaft,1983,38(2):83-86.
[3]TUGE G,MUSTAFA KS,ERHAN D.Glucose oxidase,β-galactosidase hybrid biosensor based on glassy carbon electrode modified with mercury for lactose determination[J].Anal Chim Acta,2005,551(1-2):51-56.
[4]BANSAL S,OBEROI HS,DHILLON GS,et al.Production of β-galactosidase byKluyveromyces marxianusMTCC 1388 using whey and effect of four different methods of enzyme extraction on β-galactosidase activity[J].Indian J Microbiol,2008,48(3):337-341.
[5]阚 娟,金昌海,汪志君,等.β-半乳糖苷酶及多聚半乳糖醛酸酶对桃果实成熟软化的影响[J].扬州大学学报:农业与生命科学版,2006,27(3):76-80.
[6]WEN F,CELOY I,PRICE J,et al.Identification and characterization of a rhizosphere β-glactosidase frompisum sativumL[J].Plant Soil,2008,304(1-2):133-134.
[7]赵 珊.高温乳糖酶高产菌株发酵条件优化及酶制剂的研究[D].河北:河北农业大学硕士论文,2008.
[8]QAYYUM H.β-Galactosidases and their potential applications:a review[J].Crit Rev Biotechnol,2010,30(1):41-62.
[9]阎金勇.微生物酶分离纯化研究进展[J].现代化工,2007,27(6):19-23.
[10]NAKAGAWA T,FUJIMOTO Y,RYOKO I,etal.Purification and molecular characterization of cold-active β-galactosidase fromArthrobacter psychrolactophilusstrain F2[J].Appl Microbiol Biotechnol,2006,72(4):720-725.
[11]高兆建,侯进慧,孙会刚,等.耐高温β-半乳糖苷酶的分离纯化与酶学性质分析[J].食品科学,2010,23(31):151-156.
[12]SHANE O,WALSH G.A novel acid-stable,acid-active β-galactosidase potentially suited to the alleviation of lactose intolerance[J].Appl Microbiol Biotechnol,2010,86(2):517-524.
[13]刘建福,陈庆森,王 璋.K.fragilisLFS-8611 β-D-半乳糖苷酶的分离纯化[J].食品科学,2005,26(7):46-49.
[14]沈为群,郭杰炎,李永福.乳酸克鲁维酵母β-半乳糖苷酶的分离纯化及性质研究[J].生物工程学报,1993,9(4):348-354.
[15]GARY R,EDWARD S,CHRISTIAN B.Purification,composition and molecular weight of theβ-galactosidase ofEscherichia coliK12[J].J Biol Chem,1965,240(6):2468-2477.
[16]KIM JW,RAJAGOPAL SN.Isolation and characterization of β-galactosidase fromLactobacillus crispatus[J].Folia Microbiol,2000,45(1):29-34.
[17]钱卫东,洪奕梅.一株Kluyveromyces lactis 酵母胞内乳糖酶性质的研究[J].中国酿造.2012,31(3):32-34.
[18]谭树华,高向东,吴梧桐.脆壁克鲁维酵母乳糖酶提取物性质研究[J].药物生物技术,2000,7(3):153-156.
[19]WALSH G,CONNELL S.Purification and properties of a β-galactosidase with potential application as a digestive supplement[J].Appl Microbiol Biotechnol,2007,141(1):1-13.
[20]MICHAEL J,BAILEY,MATTI LINKO VTT.Production of β-galactosidase byAspergillus oryzaein submerged bioreactor cultivation[J].J Biotechnol,1990,16(1-2):57-66.
[21]CONNELL S,WALSH G.Application relevant studies of fungal βgalactosidases with potential application in the alleviation of lactose intolerance[J].Appl Biochem Biotechnol,2008,149(2):129-138.
[22]张 伟,姚 斌,王 磊,等.来源于Aspergillus candidus 的乳糖酶基因的克隆及序列分析[J].生物工程学报,2002,18(5):566-570.
[23]LI YUMEI,WANG HM,LU LL,et al.Purification and characterization of a novel β-galactosidase with transglycosylation activity fromBacillus megaterium2-37-4-1[J].Appl Biochem Biotechnol,2009,158(1):192-199.
[24]LEE J M,CHUNG D K,PARK J H.Cloning and nucleotide sequence of the β-galactosidase gene fromLactococcus lactisssp.lactisATCC7962[J].Biotechnol Lett,1997,19(2):179-183.
[25]QU P,ZHU J,LIU L,et al.Functional identiication of a putative βgalactosidase gene in the special lac gene cluster ofLactobacillus acidophilus[J].Curr Microbiol,2010,60(3):172-178.
[26]ONLADDA J,NGUYEN T,THOMAS M,et al.Cloning,purification,and characterization of β-galactosidase fromBacillus licheniformisDSM 13[J].Appl Microbiol Biotechnol,2010,89(3):645-654.
[27]杜海英,于宏伟,韩 军,等.原生质体诱变选育乳糖酶高产菌株[J].微生物学通报,2006,33(6):48-51.
[28]李 宁.乳糖酶高产菌株的选育及其产酶研究[D].河北:河北农业大学,2005.
[29]宋 礼.复合诱变亮白曲霉筛选高产乳糖酶菌株[D].兰州:兰州大学,2010.
[30]SIDDIQUE MA,NABILA T,AYUB N,et al.Gamma radiation induced mutagenesis inAspergillus nigerto enhance its microbial fermentation activity for industrial enzyme Production[J].Mol Biol Rep,2011,38(2):1367-1374.
[31]燕 艳.乳糖酶产生菌的分离鉴定及其基因克隆的研究[D].哈尔滨:东北农业大学,2007.
[32]CHEN Wei,CHEN H,XIA Y,et al.Production,purification,and characterization of a potential thermostable galactosidase for milk lactose hydrolysis fromBacillus stearothermophilus[J].J Dairy Sci,2008,91(5):1751-1758.
[33]KHALED M,KHLEIFAT,MUAYAD M.Effects of carbon source andVitreoscillaHemoglobin(VHb)on the production of β-Galactosidase inEnterobacter aerogenes[J].Curr Microbiol,2006,53(6):277-281.
[34]DOMINGUES L,TEIXEIR JA,PENTTILA M,et al.Construction of a flocculentSaccharomyces cerevisiaestrain secreting high levels ofAspergillus nigerβ-galactosidase[J].Appl Microbiol Biotechnol,2002,58(5):645-650.
[35]张 伟,范云六,姚 斌.亮白曲霉乳糖酶基因在毕赤酵母中的高效分泌表达及酶学性质研究[J].微生物学报,2005,45(22):247-252.
[36]BECERRA M,CERDAN ME,GONZALEZ S.HeterologousKluyveromyces lactisbeta-galactosidase production and release bySaccharomyces cerevisiaeosmotic-remedial thermosensitive autolytic mutants[J].Biochim Biophys Acta,1997,1335(3):235-241.
——壳聚糖固定化乳糖酶条件的优化

