评价小儿糖尿病患者采用饮食疗法对其预后的影响
郑敏燕,许玉莲,王育红,郭雨柔,庄鑫赟
泉州市妇幼保健院儿童医院临床营养科,福建泉州 362000
小儿糖尿病以1型糖尿病为主,大多起病急,症状表现明显,出现腹痛、恶心呕吐等症状,部分患儿也可无明显症状。由于小儿处于生长发育快速阶段,身体各组织器官功能尚未发育成熟,一旦确诊为1型糖尿病,大多血糖波动较大,病情稳定性较差,容易发生糖尿病酮症酸中毒等急性并发症,严重损害患儿健康[1]。本病的发病机制复杂,病理表现为胰岛功能的衰退,临床缺乏特效治疗手段,一经确诊,需终身治疗。皮下注射胰岛素是主要的治疗方法,并辅助补液、纠正电解质紊乱等治疗,有助于降低血糖、排出酮体[2]。但小儿用药依从性较差,且机体免疫力较弱,导致病情的控制难度增加,容易发生血糖不稳、波动增大的问题[3]。营养饮食疗法是本病的重要辅助治疗手段,通过计算每日摄入热量,制定营养均衡的食谱,严格控制每餐摄入量,能达到协同控制血糖和体重的作用,维持机体糖脂代谢稳定,继而提高病情控制效果[4]。本研究选取2020年10月—2022年10月在泉州市妇幼保健院内分泌科治疗的120例小儿糖尿病患儿为研究对象,进一步分析小儿糖尿病患儿采用饮食疗法对其预后的影响,现报道如下。
1 资料与方法
1.1 一般资料
选取于本院内分泌科治疗的120例小儿糖尿病患儿为研究对象,依据随机数表法分为两组,各60例。对照组中男35例,女25例;年龄4~11岁,平均(8.52±2.31)岁;病程1~3年,平均(2.56±0.58)年。观察组中男34例,女26例;年龄4~12岁,平均(8.83±3.12)岁;病程1~4年,平均(2.98±1.25)年。两组一般资料对比,差异无统计学意义(P>0.05),具有可比性。本研究已经本院医学伦理委员会批准,患者及家属知情同意。
1.2 纳入与排除标准
纳入标准:①均符合WHO制定的1型糖尿病诊断标准;②空腹血糖(fasting plasma glucose, FPG)>7.0 mmol/L,餐后2 h血糖(2-hour plasma glucose,2 hPG)>11.0 mmol/L;③年龄4~12岁;④无其他严重疾病。
排除标准:①合并严重糖尿病急慢性并发症者;②合并系统性或重要脏器功能病变者;③治疗依从性差者。
1.3 方法
两组均使用重组人胰岛素注射液[国药准字J20040014;规格:3 mL∶300 U(笔芯)]皮下注射治疗,根据患儿的血糖、体质量等选择个体化剂量;期间密切监测血糖变化,观察症状及体征改善情况,警惕有无抗胰岛素症状;并指导患儿合理运动锻炼。在此基础上,对照组使用家属自备饮食,告知家长应给予患儿低糖、低脂、高蛋白饮食,少食多餐,主食一般200~400 g;选择低血糖生成指数的主食,全谷物、杂豆类应占主食摄入量的1/3;增加新鲜蔬菜摄入量,摄入量300~500 g,深色蔬菜占1/2以上,其中绿色叶菜不少于70%;两餐之间适量选择低血糖生成指数的水果。
观察组使用营养科配置的糖尿病膳食:①计算每日所需热量。根据患儿的体质指数(body mass index, BMI)、运动量、饮食习惯等数据,科学计算每日所需的总热量=1 000+年龄×(70~100)kcal;若偏瘦,设置热量值应偏高;若肥胖,设置热量值应偏低;若病情较为严重,设置每日热量为50 kcal;若患儿运动量较大,可适当调高每日热量值[5-6]。②食物类型分配。碳水化合物占50%~55%,脂肪占30%,蛋白质占15%~20%;一日分三餐及两加餐,热量分配为:早餐占20%,午晚餐各占25%,而两加餐占15%。维持各餐营养均衡,可根据患儿口味适当调整食物种类。观察患儿进食情况,应确保患儿每餐将食物吃完[7]。
两组均干预6个月后评价疗效。
1.4 评定标准
显效:临床症状基本消失,FPG在3.9~6.1 mmol/L,糖化血红蛋白(glycosylated hemoglobin, HbA1c)<6.5%,营养状态正常;有效:临床症状有所缓解,FPG在6.2~7.0 mmol/L,HbA1c在6.5%~7.5%,营养状态改善;无效:临床症状改善不明显,FPG仍高于7.0 mmol/L,HbA1c>7.5%,营养状态不佳,甚至出现严重并发症,总有效率=显效率+有效率[8]。
1.5 观察指标
①测定血糖各指标,抽取空腹、餐后2 h外周静脉血3 mL,用全自动生化仪、葡萄糖氧化酶法测定FPG、2 hPG,乳胶凝集反应法测定HbA1c;②测定营养指标,抽取外周静脉血3 mL,用全自动生化仪测定血红蛋白(hemoglobin, Hb)和白蛋白(albumin,ALB)、前白蛋白(prealbumin, PAB)、转铁蛋白(transferring, TRF)、Ca2+;③测定各项生长发育指标,包括身高、体质指数。
1.6 统计方法
统计学用SPSS 21.0软件版本,符合正态分布的计量资料以()表示,采用t检验;计数资料以例数(n)和率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者临床疗效比较
观察组治疗有效率为95.00%,明显高于对照组的78.33%,差异有统计学意义(P<0.05),见表1。

表1 两组患者临床疗效比较
2.2 两组患者血糖各指标比较
观察组治疗后FPG、2 hPG、HbA1c水平均低于对照组,差异有统计学意义(P<0.05),见表2。
表2 两组患者血糖各指标比较()
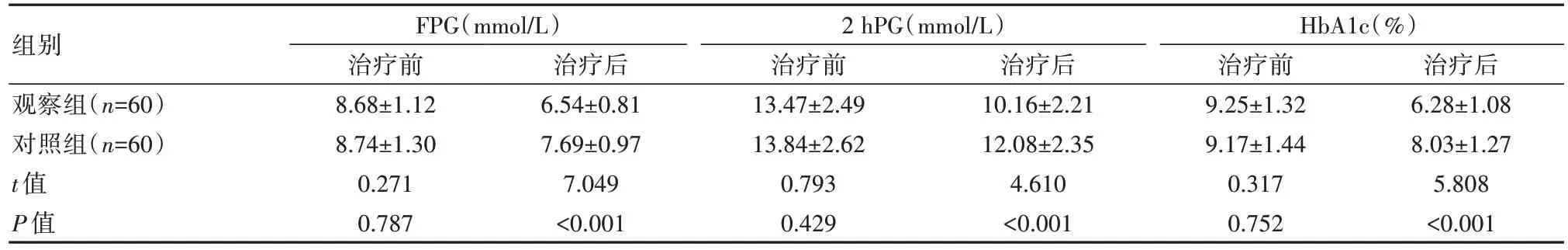
表2 两组患者血糖各指标比较()
组别观察组(n=60)对照组(n=60)t值P值FPG(mmol/L)治疗前8.68±1.12 8.74±1.30 0.271 0.787治疗后6.54±0.81 7.69±0.97 7.049<0.001 2 hPG(mmol/L)治疗前13.47±2.49 13.84±2.62 0.793 0.429治疗后10.16±2.21 12.08±2.35 4.610<0.001 HbA1c(%)治疗前9.25±1.32 9.17±1.44 0.317 0.752治疗后6.28±1.08 8.03±1.27 5.808<0.001
2.3 两组患者营养指标比较
观察组治疗后Hb、ALB、PAB、TRF、Ca2+水平均高于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者营养指标比较()
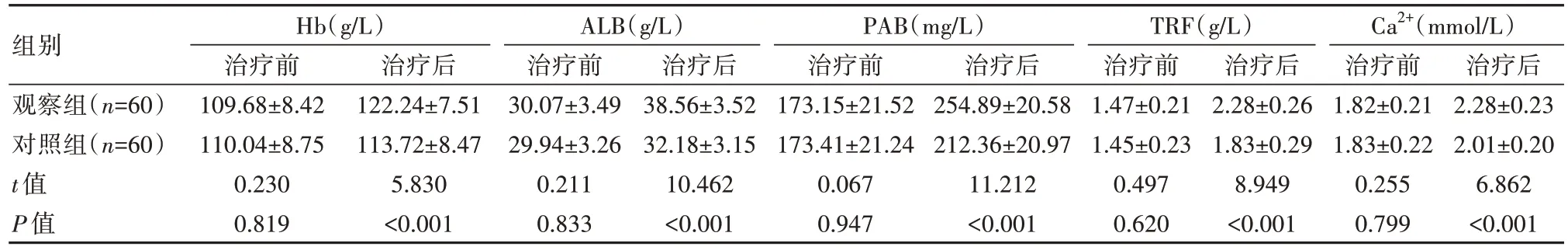
表3 两组患者营养指标比较()
组别观察组(n=60)对照组(n=60)t值P值Hb(g/L)治疗前109.68±8.42 110.04±8.75 0.230 0.819治疗后122.24±7.51 113.72±8.47 5.830<0.001 ALB(g/L)治疗前30.07±3.49 29.94±3.26 0.211 0.833治疗后38.56±3.52 32.18±3.15 10.462<0.001 PAB(mg/L)治疗前173.15±21.52 173.41±21.24 0.067 0.947治疗后254.89±20.58 212.36±20.97 11.212<0.001 TRF(g/L)治疗前1.47±0.21 1.45±0.23 0.497 0.620治疗后2.28±0.26 1.83±0.29 8.949<0.001 Ca2+(mmol/L)治疗前1.82±0.21 1.83±0.22 0.255 0.799治疗后2.28±0.23 2.01±0.20 6.862<0.001
2.4 两组患者生长发育各指标比较
观察组治疗后身高、BMI均优于对照组,差异有统计学意义(P<0.05),见表4。
表4 两组患者生长发育各指标比较()
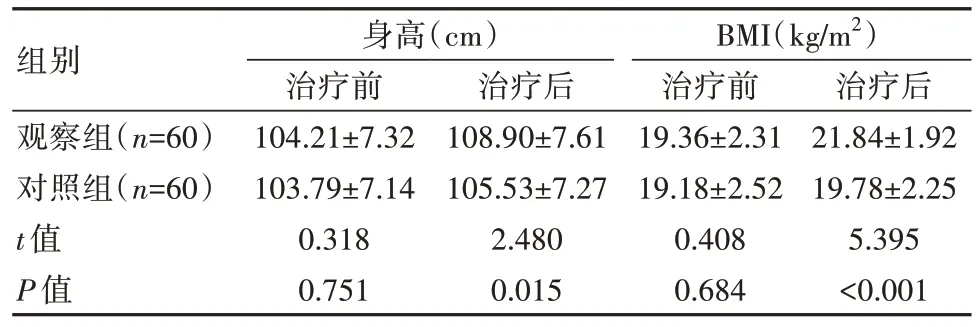
表4 两组患者生长发育各指标比较()
组别观察组(n=60)对照组(n=60)t值P值身高(cm)治疗前104.21±7.32 103.79±7.14 0.318 0.751治疗后108.90±7.61 105.53±7.27 2.480 0.015 BMI(kg/m2)治疗前19.36±2.31 19.18±2.52 0.408 0.684治疗后21.84±1.92 19.78±2.25 5.395<0.001
3 讨论
小儿糖尿病的发病机制复杂,与遗传、环境、自身免疫等因素有关,儿童糖尿病多为1型糖尿病,发病与胰岛功能受损、胰岛素绝对缺乏有关,一旦确诊需终身治疗,无法自愈。本病大多起病急骤,表现为腹痛、恶心呕吐以及典型的三多症状,机体代谢紊乱,容易发展为酮症酸中毒,长期发展还可损伤心、脑、肾等重要器官功能,严重损害患儿健康[9]。补充胰岛素治疗是本病基础治疗方法,通过皮下注射胰岛素,选用基础胰岛素+餐时胰岛素方案,可快速起效,有用于血糖的控制[10]。但小儿生理特点较为特殊,常无法完全配合治疗,加之对胰岛素的耐受及代谢情况存在个体差异,导致整体疗效不一,部分患儿存在血糖波动较大的情况,一定程度上增加了治疗风险[11]。
临床研究显示,小儿糖尿病患儿大多存在日常饮食习惯不佳、肥胖、运动量少等问题。特别是不良饮食习惯对机体糖脂代谢、内环境稳定等带来较大负担,是促进小儿糖尿病病情进展的重要因素之一[12]。因此,需严格控制小儿糖尿病患儿的饮食,维持健康饮食习惯,避免不良饮食对机体的负面影响。但小儿处于生长发育旺盛阶段,不能简单将小儿饮食结构进行调整,应根据小儿的病情、年龄、BMI等综合情况制定饮食干预方案[13]。饮食疗法以患儿的个体情况为出发点,以小儿糖尿病科学饮食为依据,合理计算每日所需热量,调整饮食结构,合理分配各营养素比例及每餐的热量,确保患儿完成每餐饮食量,从而有效保障患儿的营养需求,并减少糖脂的摄入,协同降低血糖、维持内环境稳定[14]。
本研究结果显示,观察组在临床疗效、血糖各指标、营养指标、生长发育指标方面均优于对照组(P<0.05)。证实小儿糖尿病实施饮食疗法有较好的辅助治疗作用,能针对患儿的个体情况制定科学饮食食谱,既能满足小儿机体的营养需求,促进生长发育,又能协同改善糖脂代谢,降低血糖,提高对病情的控制效果[15]。
综上所述,小儿糖尿病患儿采用饮食疗法的效果确切,能保障小儿的营养要求,促进生长发育,提高对血糖控制效果,值得推广使用。

