获能前后绵羊精子的差异蛋白质组学分析
毛飞,杨燕燕,苏杰,,赵高平,李秀男,,王大清,巴音吉日嘎拉,曹贵方,*,王彩云*
(1. 内蒙古农业大学兽医学院,内蒙古 呼和浩特 010018;2. 内蒙古农牧业科学院畜牧研究所,内蒙古 呼和浩特 010031;3. 内蒙古赛科星家畜种业与繁育生物技术研究院,内蒙古 呼和浩特 011517)
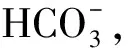
蛋白质组学是对组织或细胞中蛋白质的研究,精子蛋白质组学是鉴定精子中蛋白质的种类以及对其功能进行分析的研究。质谱技术的飞速发展为精子蛋白质组学奠定了基础[8]。早期二维电泳(2-DE)可以分离蛋白质,分离出的蛋白质收集到数据库中匹配;现在主要使用高效液相色谱使样品预分集,与2-DE相比具有更好的覆盖率与分辨率。精子的主要生成器官是睾丸,占所有已经鉴定组织特异性蛋白的1/3以上[9]。使用高效液相色谱与质谱联用的蛋白质组学方法,鉴定出7 346种蛋白,其中有300个蛋白编码基因主要在人类睾丸中表达[10]。有研究者使用串联质谱标签(TMT)技术结合液相色谱串联质谱(LC-MS/MS)技术分析了杜泊羊精子体外获能前后差异蛋白的表达,主要鉴定到的差异蛋白有热应激蛋白质家族和前列腺特异性膜抗原(PMSA)家族等蛋白等[11]。本试验利用生物信息学手段分析了绵羊精子获能前后的差异表达蛋白,结合参考文献筛选出乳铁蛋白(LTF)进行验证,为进一步研究杜泊羊体外受精技术奠定基础,以便提高母羊受胎率,实现地区经济效益的最大化。
1 材料与方法
1.1 绵羊精液
以手握法采集自内蒙古自治区呼和浩特市赛科星研究院2~4岁、体格健康的3只雄性杜泊羊精子。
1.2 主要试剂
全蛋白提取试剂盒购自江苏凯基生物科技有限公司;RNA提取试剂盒、反转录试剂盒、实时荧光PCR试剂盒均购自南京诺唯赞生物科技有限公司;SDS-PAGE凝胶试剂盒购自生工生物(上海)股份有限公司;LTF抗体、β-actin内参抗体均购自北京博奧森生物技术有限公司;胰蛋白酶(Trypsin)、二硫苏糖醇(DTT)、硫脲(Thiourea)、蛋白酶抑制剂(Protease inhibitor)均购自Sigma公司。
1.3 精子获能的处理
将绵羊新鲜精子4 ℃下111g离心10 min,用PBS重悬精子制成精子悬液,将精子浓度调整为1×108个/mL,均分为2份,即获能前的对照组与获能后的获能组。获能组置于获能培养基(0.0194 g咖啡因,0.06 g BSA,140 IU肝素,pH=7.5~7.8)孵育1 h,将获能组与对照组精子各取5 μL,考马斯亮蓝染色,封片观察。
1.4 总蛋白的提取及浓度测定
将对照组与获能组精子用等体积的PBS清洗,加入含有1 μL蛋白酶抑制剂、10 μL的磷酸酶抑制剂和PMSF的预冷裂解液。将精子用研磨法研磨,12 000g,4 ℃离心5 min,上清液即为精子蛋白,提取的精子蛋白在-80 ℃冰箱保存备用。采用BCA法测定蛋白质浓度,并绘制标准曲线。
1.5 SDS-PAGE
将精子细胞通过SDS-PAGE进行分离,分离胶浓度为12%,浓缩胶浓度为5%,厚度为1 mm,电压为80 V,待蛋白条带进入分离胶后将电压调到120 V。电泳完成后,用考马斯亮蓝染色液对凝胶染色15 min,用脱色液脱色2 h。观察蛋白条带分布。
1.6 数据检索与生物信息学分析
收集好各个样本,采用FASP酶解法对蛋白质分解,取出部分酶解多肽,用反向高效液相色谱法(High PH RP)进行分级,将上述得到的各个组分使用数据依赖采集(DDA)与数据非依赖采集(DIA)进行数据采集与定量分析,每个样本各采集1针。定量差异倍数阈值为≥1.5或≤0.6时选取为差异表达蛋白质,通过DAVID软件进行GO分析,分别是生物进程、细胞组分和分子功能,通过KEGG在线数据库对差异蛋白信号通路分析(北京奥维森基因科技有限公司协助完成)。
1.7 实时荧光定量验证
将对照组与获能组精子纯化,用PBS洗3遍后向离心沉淀的精子团加入1 mL TRIzol 裂解液,室温静置 5 min后加入 0.2 mL 氯仿,室温静置5 min。4 ℃、12 000g离心,将上层水相小心移入新的 1.5 mL EP管,加入0.5 mL异丙醇,4 ℃、12 000g离心,弃上清液,加入1 mL经DEPC处理过的75%乙醇,4 ℃、7 500g离心。弃上清液,紫外分光光度计测量RNA的纯度和浓度,参照反转录试剂盒说明书进行反转录。所有操作均在冰上操作。
依据荧光定量说明书,将各个试剂置于冰上,按照2×ChamQ Μniversal SYBR qPCR Master Mix(10.0 μL)、上游引物(0.4 μL)、下游引物(0.4 μL)、 cDNA (1.0 μL)和ddH2O(8.2 μL)配置反应体系,总体积共20 μL。操作完成后,按照反应程序,每个样品做3次重复。样品基因为Lactoferrin,内参为Protamine,利用NCBI设计特异性引物,物种为绵羊,引物序列如表1。

表1 引物序列
1.8 Western blot验证
将筛选出的差异蛋白进行Western blot验证。用SDS-PAGE分离获能组与对照组的等量精子蛋白质,用转膜仪将蛋白质转移到PVDF膜上,转膜后置于无蛋白快速封闭液中,于摇床上封闭15 min,分别加入LTF抗体(1∶1 000)、β-actin内参抗体(1∶9 000),4 ℃孵育过夜。随后用TBST清洗3次,孵育二抗(1∶2 000)2 h,清洗后显色成像。
1.9 数据统计和分析
使用Image J软件对蛋白条带灰度值进行分析,使用t检验对数据进行显著性分析,使用GraphPad Prism对数据分析并制图。
2 结果与分析
2.1 绵羊精子获能鉴定分析
通过咖啡因、肝素诱导的方法使获能组精子发生顶体反应。如图1所示,未获能的精子头部前段被考马斯亮蓝染成蓝紫色(红色箭头),获能精子由于顶体破裂,精子头部呈浅蓝色(橙色箭头)。表明精子体外获能成功并发生顶体反应。

注:红色箭头代表未获能,橙色箭头代表获能。
2.2 SDS-PAGE分析
精子细胞蛋白质样品SDS-PAGE分析结果见图2,对照组3个样品与获能组3个样品的精子细胞蛋白质电泳条带清晰。分离出的蛋白质质量大多在35~100 kDa。

M. Marker;1~3. 对照组3个样品;4~6. 获能组3个样品。
2.3 获能前后绵羊精子差异蛋白表达GO分析
鉴定到杜泊绵羊精子蛋白共2 118个,其中获能前后差异表达蛋白203个,获能后表达上调蛋白质27个,表达下调蛋白质176个。对203个差异表达蛋白进行GO分析,共有193个蛋白质存在注释信息。从生物学进程(biological processes)上看,参与解剖结构发育(anato-mical structure development)的29个差异表达蛋白,上调3个,下调26个,参与生殖(reproduction)的25个差异表达蛋白,上调4个,下调21个(图3A)。从细胞组分(cellular component)上看,定位在细胞溶质(cytosol)的差异蛋白有43个,36个下调,7个上调,定位在质膜(plasma membrane)的差异蛋白有33个,28个下调,5个上调(图3B)。从分子功能(molecular functions)上看,参与氧化还原(oxidoreductase activity)的有2个上调蛋白,17个下调蛋白(图3C)。

A. 生物进程分类;B. 细胞组分分类;C. 分子功能分类。
2.4 获能前后绵羊精子差异表达蛋白质KEGG通路分析
为了获得差异蛋白参与的信号通路,使用KEGG对差异蛋白进行通路分析。KEGG分析表明,差异蛋白参与到25个相关的信号转导过程中,一些重要的信号通路如表2所示,其中,cAMP信号通路参与精子获能、顶体反应和酪氨酸磷酸化等调节。蛋白酶体和精子移动有关,蛋白酶体与透明带结合促进顶体胞吐,精子泛素化和蛋白水解酶抑制剂有助于阻碍精子多精入卵,蛋白酶水解被抑制改变精子获能进程。Hedgehog信号通路与生物体组织器官的生长发育有关,在精子发生的早期过程中起到调控作用,除此之外,还可以促进卵巢中一些细胞的增殖、分化与修复。
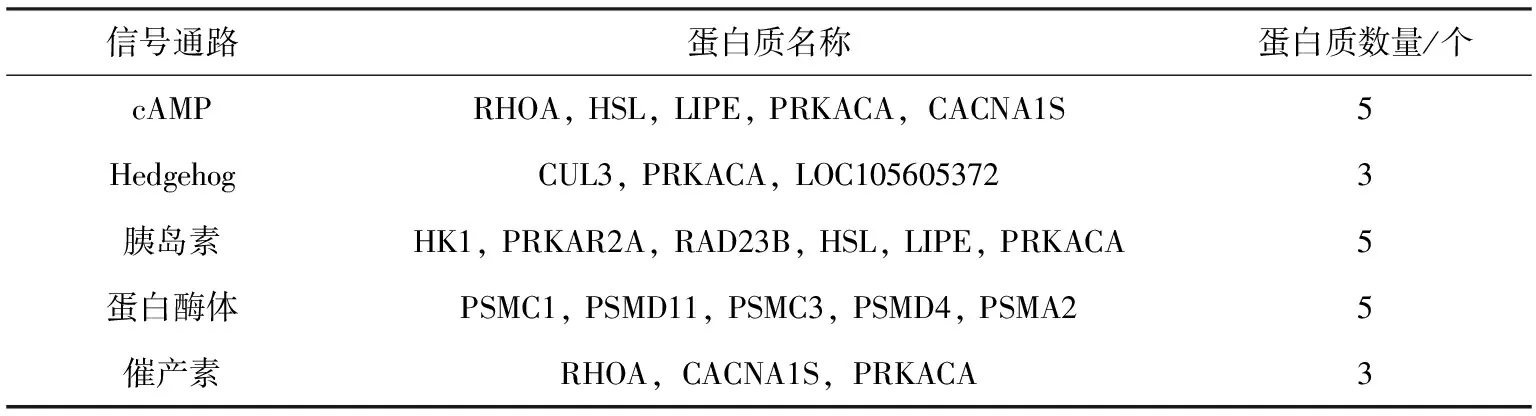
表2 获能前后绵羊精子表达差异蛋白质KEGG信号通路
2.5 获能前后部分差异表达蛋白
由表3可见,在筛选出的差异蛋白中,3个精子蛋白在获能过程中丰度增加,13个精子蛋白在获能过程中丰度下降。上调蛋白包括精子发生与中心粒关联1样蛋白、ADAM金属肽酶结构域2,下调蛋白包括乳铁蛋白、β-防御素和精囊蛋白等,结合前人的研究,最终选取LTF做进一步验证。
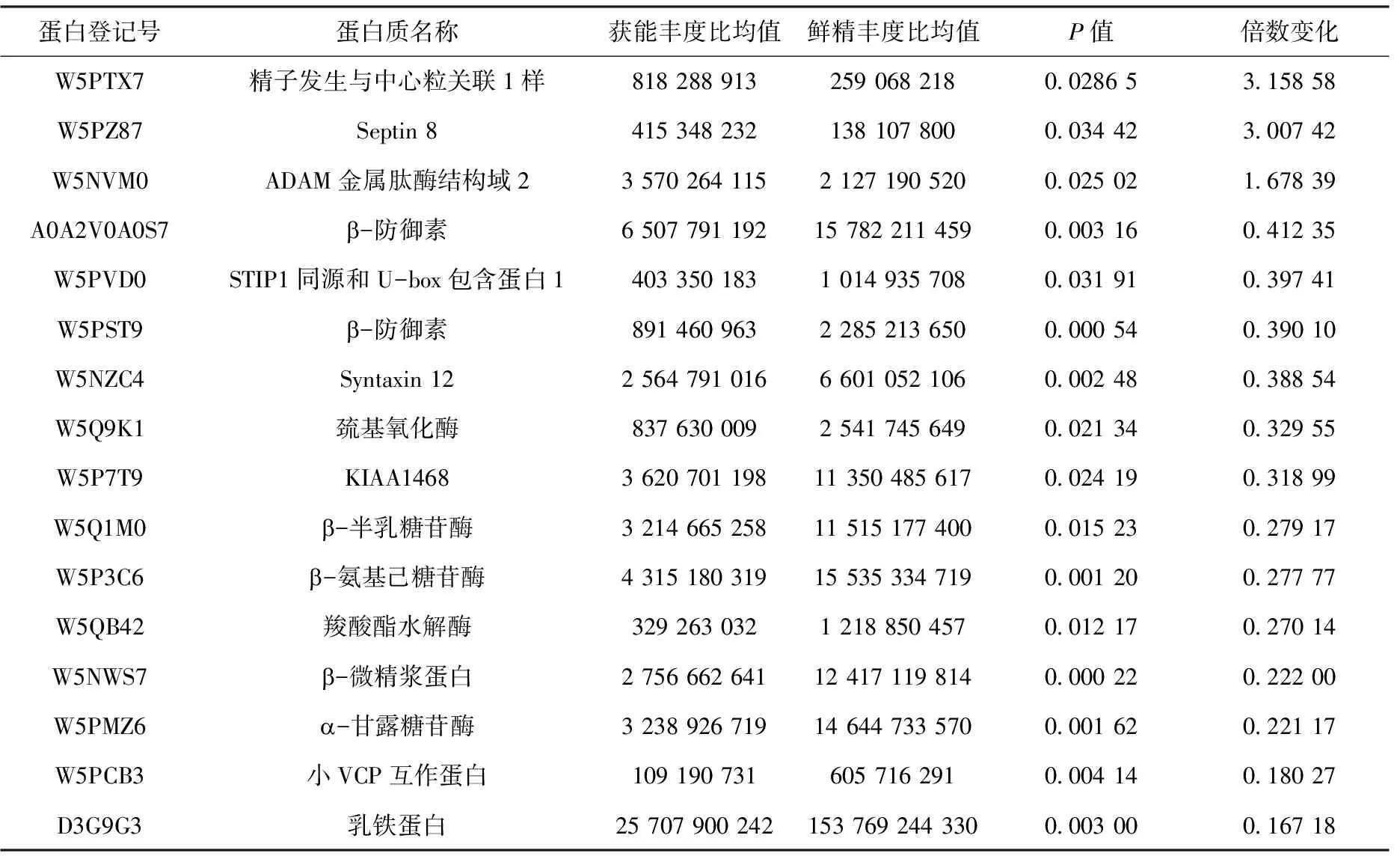
表3 获能前后绵羊精子表达差异蛋白质列表
2.6 获能对绵羊精子LTF表达量的影响
通过质谱分析筛选出LTF作为研究目标。通过实时荧光定量与免疫印迹对LTF表达分布进行分析。免疫印迹结果显示(图4),LTF蛋白在对照组与获能组均有表达,且获能组的表达量低于对照组(P<0.000 1)。RT-qPCR结果显示(图5),LTF基因mRNA在对照组与获能组均表达,且获能组表达量低于对照组(P<0.001)。
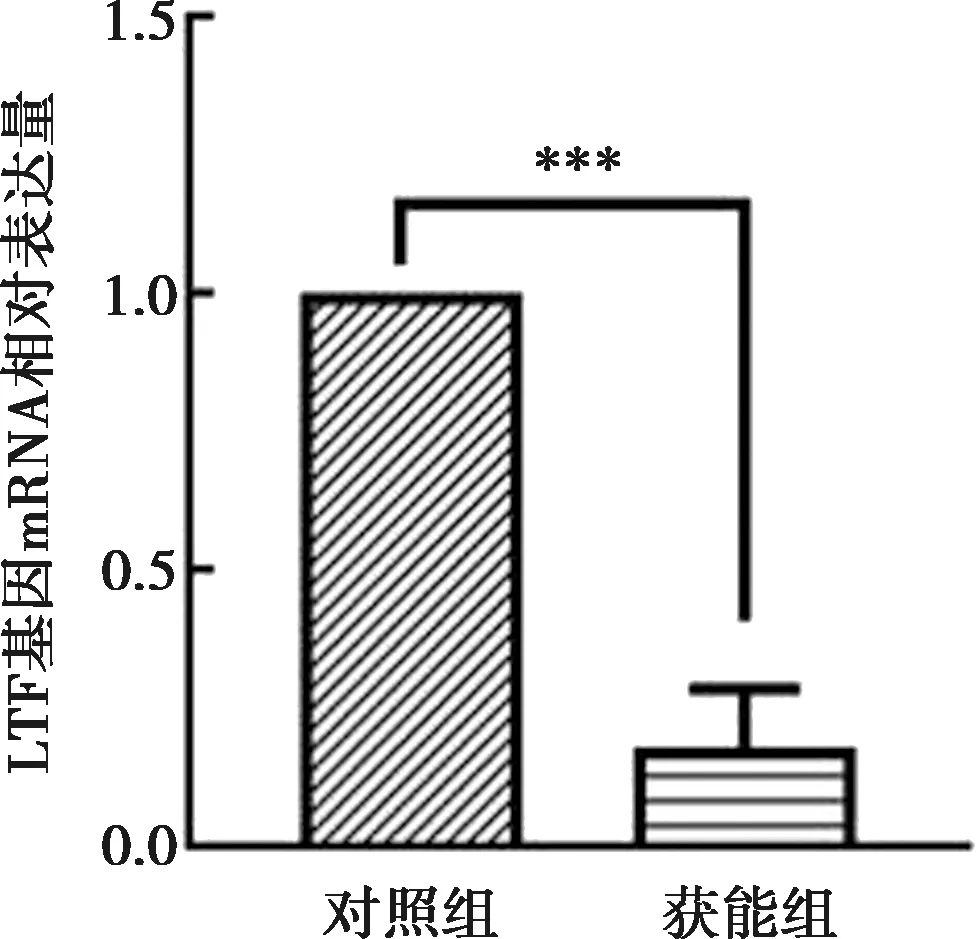
注:***表示P<0.001。
3 讨论

蛋白质组学技术的发展对精子的功能提供了新的见解,鉴定到的蛋白质可以作为促进精子的生理功能的标志物。有研究者分析杜泊羊精子体外获能前后差异蛋白的表达,鉴定到差异蛋白共有348种,其中上调蛋白280种,下调蛋白68种。鉴定的差异蛋白有VCP蛋白和PMSA家族蛋白,与本研究所鉴定出的差异蛋白一致。这些蛋白主要参与信号转导、生殖等过程,也参与了蛋白酶体信号通路[11]。本研究鉴定到差异蛋白质数量与前人研究有所不相同,由于本研究设置的差异倍数阈值为≥1.5或≤0.6,而文献中的差异倍数阈值是以1.5倍为变化;也可能是安徽与内蒙不同地域环境对杜泊羊个体差异的影响等因素导致。前人研究得出PMSA家族蛋白在蛋白质互作中作用明显,而未具体研究信号通路分析。本研究得到的结果是在蛋白酶体信号通路中有PMSA家族蛋白参加。Hedgehog信号的调节表达是成人精子发生的一个特征,有研究表明Hedgehog信号通路参与小鼠精子的发生,通过SuFu蛋白可能会关闭单倍体生殖细胞中的Hedgehog信号传导[15-16]。蛋白酶体是一种蛋白复合物,由催化蛋白和调节蛋白构成,可以降解结构发生错误的蛋白质。泛素与蛋白质连接后会产生泛素-蛋白酶系统(UPS),UPS参与生殖过程中配子的发生、受精和获能等过程[17]。蛋白质泛素化是一种稳定的共价修饰后翻译,26S蛋白酶体和溶菌酶等可以降解底物蛋白。这种系统可以维持精子在受精时的正常功能,也是牛和其他哺乳动物卵母细胞和精子中存在的底物特异性蛋白质回收途径[18]。有研究表明,精子携带的蛋白酶体参与精子获能已在人和猪精子中发现[19]。 LTF对精子获能可能也有重要作用,参与了cAMP途径,对获能的作用还需要进一步验证。
LTF是一种分子量为80 kDa的铁结合糖蛋白,属于转铁家族,首次在牛奶中分离出来,并在人乳中证明是铁结合糖蛋白[20]。LTF在黏膜分泌物广泛存在,例如泪液、唾液、阴道黏液、精浆、鼻腔和支气管分泌物、胆汁、胃肠道液体和尿液等,在血液中主要是由中性粒细胞产生[21]。LTF具有多种生物活性,参与多种生理和保护作用,主要有抗氧化、抗肿瘤、抗炎和抗菌等活性[14]。LTF在绵羊精子冷冻前后有显著变化,可能与绵羊精子冷冻后品质密切相关。LTF在先天免疫系统中起重要作用,存在于哺乳动物的精浆中,包括马、牛、狗和人。LTF是种马附睾分泌的最丰富的蛋白质之一,约占总蛋白质分泌量的 41% 。研究显示精液中的LTF与精子浓度和总精子呈正相关。LTF在附睾体和尾部细胞中表达可与精子结合,可能在保护和调节精子活性方面发挥生物学作用。Zumoffen等[22]报道在人的输卵管分泌物中检测到LTF,研究显示LTF可以促进生殖过程的调节,刺激精子获能,调节精子亚群,使其与卵母细胞相互作用和受精。Kobayashi等[23]在牛的冷冻精液中添加了不同浓度的LTF,利用CASA分析了解冻后牛冷冻精液发现添加LTF有利于提高精子的活力和运动性能,人工授精率有所提高。Martins等[24]在冷冻马精子中添加LTF有助于在冷冻期间保护马精子。 Su等[25]研究发现10 μg/mL的LTF显著改变了精子的活力。Estefanía等[26]研究发现LTF促进大鼠精子的体外获能,诱导顶体反应的发生,影响胚胎移植的数量。在本研究中,LTF在获能组中的表达量显著降低,与前人研究结果一致。提示LTF对精子具有保护作用,且对获能过程具有促进作用。
4 结论
本试验鉴定出与绵羊精子获能相关的差异表达蛋白共203个,其中27个上调蛋白,176个下调蛋白。蛋白参与解剖发育与生殖过程,也参加了cAMP和蛋白酶体等信号通路。并验证发现LTF对精子获能具有促进作用。

