基于网络药理学探讨七味白术散治疗脾虚泄泻小鼠的作用机制
林颖,司红彬,王海林
(1. 广西大学动物科学技术学院/广西畜禽繁育与疾病防控重点实验室,广西 南宁 530004;2. 重庆大学附属三峡医院,重庆 404100)
脾虚腹泻(spleen-deficiency diarrhea,SDD)是中医常见的泄泻证型之一,临床表现与西医常见的肠易激综合征腹泻(irritable bowel syndrome with diarrhea,IBS-D)基本相似[1-2]。脾虚泄泻是一种临床常见的消化道疾病,它会破坏肠黏膜结构并导致肠道微生物组成发生变化[3]。目前脾虚泄泻的具体发病机制尚不明确。临床上用于治疗脾虚泄泻的常用药物主要包括洛哌丁胺、阿托品和蒙脱石散等,但这些药物在使用时可能会出现不同程度的副作用[4]。因此,迫切需要发现治疗脾虚泄泻的新药物。
七味白术散出自《小儿药证直诀》,主要由人参、白茯苓、炒白术、藿香叶、木香、甘草、葛根组成,具有健脾益气和胃生津的功效。在临床上广泛用于脾虚泄泻的治疗[5-7],但其具体作用机制尚不明确。因此,结合实际应用情况,将原方人参换为党参,采用网络药理学结合番泻叶诱导的脾虚泄泻模型,探讨七味白术散改善脾虚泄泻的作用机制,为临床应用七味白术散治疗脾虚泄泻及机制探讨提供理论依据。
1 材料与方法
1.1 中药材来源及七味白术散制备
试验所用番泻叶、党参片、麸炒白术、茯苓、甘草片、木香、广藿香和葛根等中药材均购于重庆大学附属三峡医院中药房,经鉴定均符合2020版《中国药典》;蒙脱石散(dictahedral smectite powder,DSP)购于中兴大药房。
番泻叶水煎液的制备:称取番泻叶500 g,加水适量浸泡后,煮沸10 min后过滤,使用旋转蒸发仪65 ℃对滤液进行浓缩,浓缩到相当于原生药浓度为1 g/mL,4 ℃保存备用。
七味白术散水煎液制备:参考2020年版《中国药典》,结合临床及课题组的方法进行制备。党参10 g、麸炒白术12 g、茯苓12 g、甘草片3 g、木香6 g、广藿香10 g、葛根15 g,浸泡半小时,大火煮沸后改用小火煎煮,每次煎煮时间20~30 min。先后煎煮2次过滤,将2次煎煮的滤液混合,使用旋转蒸发仪对滤液进行浓缩,浓缩到相当于原生药浓度为1 g/mL,4 ℃保存备用。
1.2 实验动物
SPF级昆明小鼠,雌雄各半,8周龄,体质量18~22 g,购自湖南斯莱克景达公司,许可证号SCXK(湘)2019-0004。饲养于重庆大学附属三峡医院动物房。试验经重庆大学附属三峡医院实验动物伦理委员会批准,所有试验操作均按照标准操作规程进行。
1.3 主要试剂
HE染液套装(Servicebio,G1003)、Occludin抗体(Servicebio,GB111401)和Claudin-1(Servicebio,GB112543)抗体均购自武汉赛维尔生物科技有限公司;D-木糖试剂盒(A035-1-1)购自于南京建成生物工程研究所。
1.4 七味白术散活性成分的筛选和靶点的收集
依据TCMSP数据库“OB≥30%和DL≥0.18”的筛选规则,分别检索七味白术散中各单味中药的有效成分和对应的靶点蛋白。通过UniProt数据库,将靶点蛋白进行均一化处理。
1.5 脾虚泄泻疾病靶点的收集
鉴于西医中无“脾虚泄泻”的说法,其症状与IBS-D基本相似,因此借助IBS-D疾病靶点来推测脾虚泄泻疾病的靶点。通过GEO数据库获取GSE14841数据集,该数据集对4个健康志愿者和5个IBS-D患者的结肠进行了基因测序。利用GEO2R进行在线分析,获取潜在的疾病靶点。在GeneCards、OMIM和DisGeNET数据库中,以“irritable bowel syndrome with diarrhea”为检索词,收集IBS-D疾病相关的靶点。最后,将上述数据库靶点进行去重、合并。
1.6 七味白术散治疗脾虚泄泻靶点的收集和PPI网络构建
使用韦恩图筛选七味白术散活性成分和IBS-D的交集靶点,该交集靶点被视为七味白术散治疗脾虚泄泻的潜在靶点。将潜在靶点输入到String数据库中,以获取蛋白质-蛋白质相互作用(protein-protein interactions,PPI)的相关信息。接下来,采用Cytoscape软件构建可视化的PPI网络,计算各个节点的Degree值,并获得PPI网络中关键靶点。
1.7 七味白术散治疗脾虚泄泻潜在靶点富集分析
将七味白术散治疗脾虚泄泻的潜在靶点导入Metascape数据库中,对潜在靶点进行GO和KEGG的富集分析。P<0.01为参考阈值进行检索,借助微生信网站对分析结果进行可视化处理。
1.8 造模及分组
小鼠适应性饲养1周后,将小鼠随机分为正常组(NC)8只和造模组40只。造模组采用番泻叶水煎液建立脾虚泄泻小鼠模型,给药剂量为0.02 mL/g,连续给药5周;正常组给予相应剂量的生理盐水。以小鼠腹泻表现明显以及小鼠体重减轻、活跃状态减少和大便稀溏判断为造模成功[8]。将造模成功的小鼠随机分为模型组(Model)、蒙脱石散2 g/kg组(DSP)和七味白术散5 g/kg(低剂量)、10 g/kg(中剂量)和20 g/kg(高剂量)组,每组8只。蒙脱石散组和七味白术散组分别灌胃对应剂量药物,正常组和模型组灌胃等体积的生理盐水,连续给药7 d,每天1次。给药结束后,眼眶采血,收集血清和结肠组织。
1.9 相关指标观察和检测
1.9.1 小鼠一般情况观察
每日观察并记录各组小鼠体重、耗食量、粪便性状、活动度、精神状态及死亡等情况。
1.9.2 小鼠结肠组织病理学观察
将小鼠结肠组织分离、清洗干净后,置于4%多聚甲醛溶液中固定,参照HE染色法制备切片,光学显微镜下观察组织病理学变化。
1.9.3 免疫组化法检测结肠组织Claudin-1、Occludin蛋白的表达情况
参考文献[9]方法,将包埋的结肠组织进行免疫组化染色,在显微镜镜检拍照并扫描图片,分析各组结肠组织样本中Claudin-1、Occludin蛋白的表达情况。
1.9.4 血清D-木糖检测
小鼠禁食不禁水24 h后,将3%D-木糖溶液按10 mL/kg的量灌胃,1 h后眼球取血,离心取血清,按照D-木糖试剂盒说明书进行操作。
1.10 统计学分析
采用GraphPad Prism 9软件对数据进行统计学分析,数据表示为“平均数±标准差”,多组间均数比较采用单因素方差分析,P<0.05表示组间差异具有统计学意义。
2 结果
2.1 七味白术散活性成分的筛选和靶点的收集
通过TCMSP数据库和文献检索七味白术散的化合物,然后依据TCMSP数据库的筛选规则收集七味白术散活性成分及其相关靶点,见表1。经过合并和去重后,共获得367个潜在靶点。

表1 七味白术散“中药-化合物-活性成分-潜在靶标”信息 个
2.2 脾虚泄泻疾病靶点的筛选与分析
通过GEO2R在线分析发现GSE14841数据集中共有17 271个差异基因,以P<0.05和|log2FC|≥1.5为筛选条件,绘制火山图和热图,共获得77个差异基因,其中30个基因上调,47个基因下调,见图1。然后将Genecards、OMIM、Disgenet和GEO数据库合并,删除重复项后共获得742个IBS-D的潜在治疗靶点。
2.3 七味白术散治疗脾虚泄泻潜在靶点的筛选与PPI网络构建
如图2所示,七味白术散活性成分与IBS-D共有36个交集靶点,上述交集靶点被视为七味白术散治疗脾虚泄泻的潜在靶点。构建上述交集靶点的PPI图,节点的大小和颜色反映Degree值的大小。根据Degree值的排序,AKT1(蛋白激酶)、EGFR(表皮生长因子受体)、TNF(肿瘤坏死因子)和IL6(白介素6)等可能是七味白术散改善SDD的关键靶点。表明七味白术散可能通过减轻脾虚泄泻患者的炎症,来减轻肠道损伤。

图2 七味白术散治疗脾虚泄泻潜在靶点PPI网络
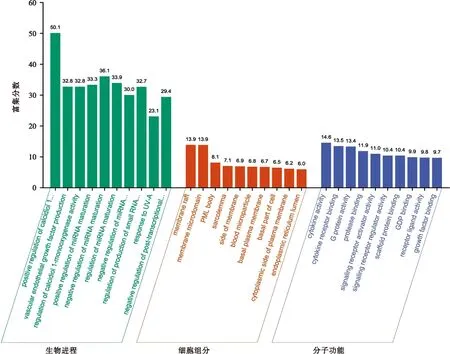
图3 七味白术散治疗脾虚泄泻潜在靶点GO富集
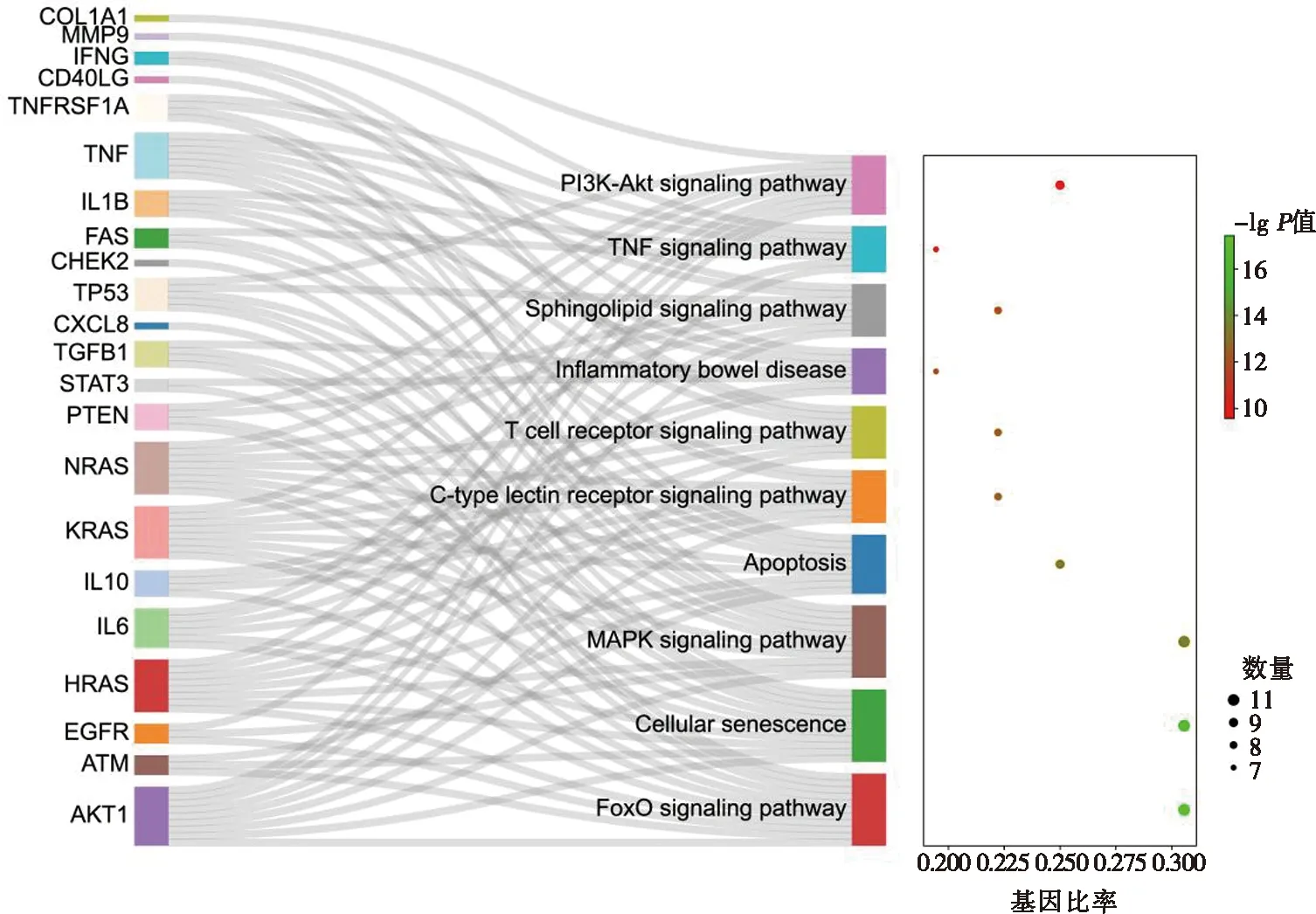
图4 七味白术散治疗脾虚泄泻潜在靶点KEGG通路富集

A.正常组;B.模型组;C.蒙脱石散组;D~F.分别为七味白术散低、中、高剂量组。

A.正常组;B.模型组;C. 蒙脱石散组;D~F.分别为七味白术散低、中、高剂量组。

A.正常组;B.模型组;C. 蒙脱石散组;D~F.分别为七味白术散低、中、高剂量组。
2.4 七味白术散治疗脾虚泄泻潜在靶点的富集分析
将上述36个潜在靶点导入Metascape数据库中,进行GO和KEGG通路分析。图3表示七味白术散治疗脾虚泄泻主要与血管内皮生长因子的产生(vascular endothelial growth factor production)、细胞膜的结构(membrane microdomain)和细胞因子活性(cytokine activity)等生物进程有关。由于癌症相关信号通路不是我们关注的重点,故KEGG富集分析主要为非癌症信号通路。根据P值大小对富集通路进行分析,七味白术散可能通过调控细胞凋亡(Apoptosis)、T细胞受体信号通路(T cell receptor signaling pathway)、炎症性肠病(Inflammatory bowel disease)和TNF(TNF signaling pathway)等信号通路改善脾虚泄泻,主要涉及炎症反应、免疫调节等相关生物进程,见图4。
2.5 七味白术散对各组小鼠一般情况和体重的影响
在试验期间,正常组小鼠饮食正常、反应灵敏、粪便呈条状或颗粒状,体重增加。与正常组相比,模型组小鼠饮食减少,体重下降,反应迟钝,胆怯聚集,粪便为稀软或带有血丝,肛门红肿并有污秽附着。如图5所示,给药7 d后,与正常组相比,模型组体重显著降低;与模型组相比,蒙脱石散和七味白术散3个剂量组小鼠体重也明显升高,但无统计学差异。小鼠的饮食情况、精神状态和活动度等也有一定程度的改善。
2.6 七味白术散对各组小鼠结肠组织病理学的影响
正常组小鼠结肠黏膜上皮完整,上皮细胞排列整齐,刷状缘清晰可见,有大量杯状细胞,炎性细胞浸润较少(图6A)。模型组小鼠结肠黏膜上皮细胞坏死、脱落,其形态结构完整性被破坏,细胞排列紊乱,结肠黏膜层可见炎性细胞浸润,杯状细胞减少(图6B)。蒙脱石散和七味白术散低、中、高剂量组小鼠结肠黏膜出现上皮再生,其形态结构完整性得到恢复,细胞排列规则有序,炎性细胞浸润明显减少(图6C~F)。结果表明,七味白术散能有效减轻脾虚泄泻小鼠结肠组织病理学损伤。
2.7 七味白术散对各组小鼠结肠组织Claudin-1、Occludin蛋白的影响
与正常组相比较,模型组小鼠结肠组织中Claudin-1、Occludin蛋白的表达明显降低;与模型组相比较,蒙脱石散和七味白术散高剂量组(20 g/kg)小鼠结肠组织中Claudin-1、Occludin蛋白的表达显著升高,见图7、8和表2。表明七味白术散具有明显改善脾虚泄泻小鼠肠道屏障的作用。

表2 各组小鼠结肠组织中Claudin-1、Occludin表达平均光密度值比较(n=3)
2.8 七味白术散对各组小鼠血清D-木糖的影响
与正常组小鼠相比,模型组小鼠血清D-木糖含量明显降低(P<0.05)。D-木糖进入体内后,通过消化道到达小肠,在小肠吸收入血,血清D-木糖的含量降低表明模型组小鼠小肠吸收功能下降。与模型组相比,蒙脱石散和七味白术散20 g/kg组血清D-木糖水平显著升高(P<0.05),见图9。
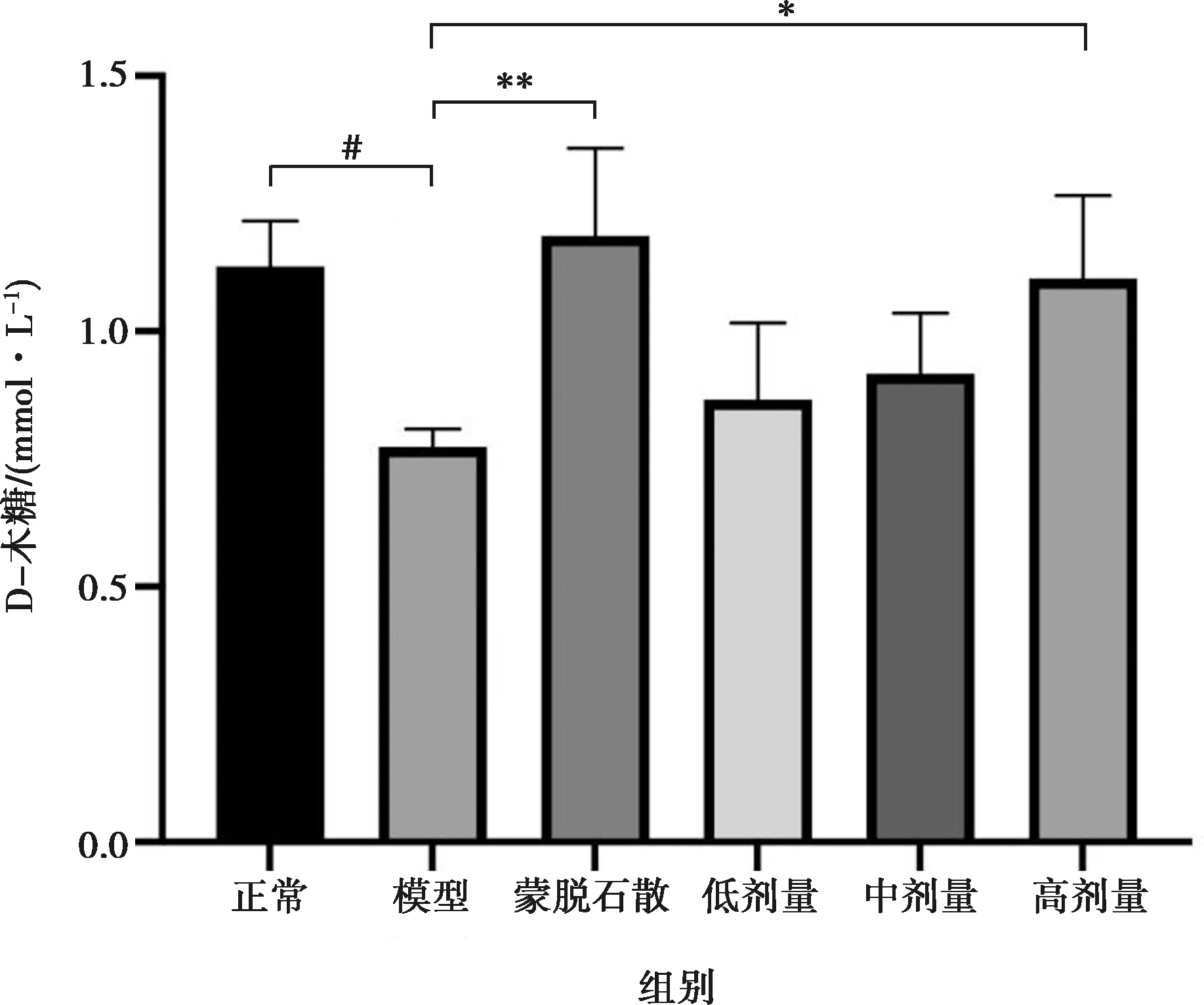
注:*表示P<0.05,**表示P<0.01。
3 讨论
脾虚泄泻是临床常见的胃肠道综合征,以泄泻为最常见的症状。常表现为大便稀溏、腹痛、精神状态不佳等[10]。中医学认为脾虚泄泻主要是由于脾气虚导致运化失常,引起腹泻、久泻不愈和消瘦或乏力等症状,临床上主要采用健脾渗湿止泻的方法治疗[11]。中医药治疗脾虚泄泻不仅可有效改善其临床症状,而且具有成本低廉、毒副作用小等优点[12-13]。七味白术散是根据现代社会脾虚泄泻患者中医辨证论治,在《小儿药证直诀》原方上改良的经验方剂。研究表明七味白术散对脾虚泄泻等症状具有明显的改善作用[14],但其作用机制尚不明确。网络药理学可为中药复方的作用机制研究提供一定的参考。本研究整合网络药理学、生物信息学和药理学研究探索七味白术散治疗脾虚泄泻潜在作用机制。
网络药理学研究表明,AKT1、EGFR、TNF和IL6等可能是七味白术散抗脾虚泄泻的关键靶点,七味白术散可能通过调控细胞凋亡、T细胞受体信号通路、炎症性肠病和TNF等信号通路改善脾虚泄泻,主要涉及炎症反应、免疫调节等途径改善脾虚泄泻。腹泻和试验性腹泻患者常伴有肠道炎症,以及严重脱水和肠道屏障受损[15]。炎症介质水平的升高与肠炎过程中黏膜的病理损伤有关,反映了疾病的严重程度。本研究结果表明,患有脾虚泄泻小鼠的结肠组织中存在严重的炎症浸润,伴随着组织结构的丧失和杯状细胞数量的减少,七味白术散干预可减轻结肠组织的病理损伤。Claudin-1、Occludin是肠道屏障完整性相关蛋白,与肠道吸收、分泌和代谢密切相关[16-18]。腹泻时紧密连接蛋白的表达下调,肠黏膜屏障功能受损,免疫组化结果证实在给予七味白术散后,脾虚泄泻小鼠结肠中Claudin-1、Occludin的表达明显上调,表明其具有改善肠道通透性和维持肠上皮完整性的作用。
血清D-木糖是一种戊糖,在小肠内通过被动扩散的方式进行吸收,吸收在体内不被肝脏代谢,其吸收水平能反映小肠的吸收功能水平。故能通过各组小鼠的血清D-木糖含量来评价小鼠的肠道功能[19]。本文中模型组小鼠D-木糖含量明显下降,表明脾虚时小鼠的胃肠功能紊乱。使用七味白术散治疗后,小鼠血清D-木糖含量增加,提示七味白术散可通过改善小鼠胃肠道功能发挥作用。
本研究仍存在一些不足之处。首先,数据库筛选获取的七味白术散活性成分和靶点可能不够准确。因为七味白术散是通过口服吸收发挥作用的,七味白术散的化学成分可能在体内进行了代谢和转化;其次,虽然我们发现七味白术散可能通过抗炎、调节免疫等途径改善脾虚泄泻的症状,但具体的分子调控机制需要进一步验证;最后,肠道菌群也是脾虚泄泻发生发展的最关键因素之一,在未来的研究中需进一步关注七味白术散对脾虚泄泻小鼠肠道菌群的影响。
综上,通过整合网络药理学、生物信息学分析和试验验证,预测了七味白术散治疗脾虚泄泻的物质基础,关键靶点与潜在分子机制,初步阐明了七味白术散可通过“多成分、多靶点、多途径”改善脾虚泄泻症状,为七味白术散治疗脾虚泄泻的临床应用提供了科学依据。

