黄色瘤胃球菌双功能酶xynD基因在毕赤酵母中的表达及其酶学特征
王蕾,李文菁,杨东林,陈勇
(新疆农业大学动物科学学院,新疆 乌鲁木齐 830052)
酶制剂在饲料、食品、造纸、医药及生物能源等多领域具有广泛的应用,从环境中筛选酶的基因资源一直都是该领域的研究热点。反刍动物瘤胃是高效降解植物纤维的“发酵罐”,其中纤维降解菌及其产生的纤维素酶和半纤维素酶发挥着重要作用[1]。瘤胃中的纤维素降解菌包括瘤胃球菌(Ruminococcus)、产琥珀酸丝状杆菌(Fibrobactersuccinogenes)、溶纤维丁酸弧菌(Butyrivibriofibrisolvens)和梭菌(Clostridium)等[2]。其中黄色瘤胃球菌(R.flavefaciens)和白色瘤胃球菌(R.albus)是瘤胃中主要的纤维降解菌[3]。黄色瘤胃球菌可编码糖苷水解酶、碳水化合物酯酶、多糖裂解酶等多种酶,通过产生木聚糖酶复合体、多种内切葡聚糖酶以及外切葡聚糖酶来降解纤维素。黄色瘤胃球菌甚至能降解那些通常难以降解的、坚韧的棉花纤维[2],这说明黄色瘤胃球菌纤维素及半纤维素基因资源的独特性及其潜在的应用价值。
研究发现,黄色瘤胃球菌FD-1基因组共有101个糖苷水解酶基因,分布在25个糖苷水解酶家族中。黄色瘤胃球菌FD-1基因组中共有12个开放阅读框(open reading frame,ORF),编码β-1,4-木聚糖酶(EC 3.2.1.8,简称木聚糖酶),其中有2个ORF编码双功能木聚糖酶[4]。另一黄色瘤胃球菌17至少有 4个编码木聚糖酶的基因,其中xynA和xynD编码双功能酶;xynA基因编码的双功能酶由2个不同的木聚糖酶结构域组成,并由1个非常规连接区连接;xynD基因编码的双功能酶由1个木聚糖酶和1个β-1,3-1,4-葡聚糖酶(EC 3.2.1.73,简称葡聚糖酶)结构域组成[5]。由于植物性饲料中含丰富的葡聚糖和木聚糖,添加木聚糖酶与葡聚糖酶具有提高饲料的消化利用率、促进动物生长的作用。因此,通过基因工程技术异源表达xynD基因生产重组木聚糖酶和葡聚糖酶具有开发利用价值。在大肠杆菌(Escherichiacoli)DH5α中,xynD基因的表达产物可降解燕麦木聚糖和地衣多糖,不降解羧甲基纤维素,其木聚糖酶和葡聚糖酶比活性分别为95.5和83.2 IU·mg-1,如此低的酶活性限制了该木聚糖酶和葡聚糖酶的进一步应用。与大肠杆菌表达系统相比,酵母表达系统具有表达水平更高、培养简单、可分泌表达等优点,还可以使重组蛋白适当折叠并以Kex2作为信号肽酶分泌至细胞外[6]。因此,在毕赤酵母(Pichiapastoris)中表达xynD基因有望获得更高的酶活性。
本研究在不改变氨基酸序列的情况下对来源于黄色瘤胃球菌的双功能酶xynD基因进行密码子优化,再在毕赤酵母中表达并对其酶学特征进行研究,为重组工程菌应用到饲料工业中提供参考。
1 材料与方法
1.1 菌株与试剂
大肠杆菌DH5α、毕赤酵母GS115和表达载体pPIC9K均为本课题组保存。TaqDNA聚合酶、限制性内切酶、DNA和蛋白质标准分子质量购自宝生物工程(大连)有限公司;质粒小提试剂盒和DNA纯化试剂盒购自天根生化科技(北京)有限公司;地衣多糖、大麦β-葡聚糖、阿拉伯木聚糖购自Megazyme公司;4-O-甲基-D-葡萄糖醛酸-D-木聚糖、燕麦木聚糖购自Sigma公司;其他试剂为国产分析纯。毕赤酵母GS115使用的培养基为酵母提取物蛋白胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)。
1.2 主要仪器与设备
BioFlo®115发酵罐和Centrifuge 5810R型低温高速离心机(德国Eppendorf生命科学公司),Infinite M200酶标仪(瑞士TECEN集团公司),ECM399型电转仪(美国HAVARD公司的BTX子公司),My Cycler梯度PCR仪和Gel Doc XR+全自动凝胶成像系统(美国BIO-RAD公司),Frac-920半自动部分收集器(美国Amersham公司),SHZ-88水浴恒温振荡器(上海金怡医疗科技有限公司),ZHWY200B气浴摇床(上海智城分析仪器制造有限公司),Gene Quant型核酸蛋白仪(德国GE公司)等。
1.3 黄色瘤胃球菌双功能酶xynD基因的优化与合成
根据黄色瘤胃球菌xynD基因序列(GenBank ID:S61204.1),使用SignalP 4.1 Server在线分析基因的信号肽编码序列。为提高重组蛋白的表达水平,去除xynD的信号肽编码区(93 bp)以及催化模块间的连接序列(393 bp)。根据毕赤酵母密码子的偏爱性消除稀有密码子,降低mRNA二级结构自由能和调整GC含量,消除限制酶切位点,在不改变氨基酸序列的情况下利用Optimum GeneTM对xynD基因进行密码子优化,优化后的基因命名为xynDm,以进一步提高重组蛋白表达水平。将xynDm序列送至GenScript®公司合成。合成的xynDm和表达载体pPIC9K经SnaB Ⅰ/AvrⅡ双酶切,构建重组质粒pPIC9K-xynDm并转化至感受态大肠杆菌DH5α,经培养后采用碱裂解法提取重组质粒DNA,经BamHⅠ和SalⅠ双酶切初步鉴定后分别由GenScript公司和Sangon Biotech公司重复测序。
1.4 重组毕赤酵母工程菌的构建及筛选鉴定
用限制性内切酶SalⅠ将pPIC9K-xynDm线性化,经琼脂糖凝胶电泳后纯化并回收,电转化至毕赤酵母GS115感受态细胞。将电转后的细胞涂布于最小葡萄糖培养基(minimal dextrose medium,MD)平板上,29 ℃培养48 h。挑选生长良好的菌落在MD平板和最小甲醇培养基(minimal methanol medium,MM)平板上进行甲醇利用慢型(Muts)和甲醇利用正常型(Mut+)表型的筛选,再分别经0、1、2和4 mg·mL-1遗传霉素(geneticin)G418的抗性筛选得到高拷贝阳性转化子。将得到的转化子进行YPD平板培养,挑取单菌落液体培养12 h,提取重组酵母基因组DNA,以序列(5′-GCGACTGGTTCCAATTGACAAGC-3′)和(5′-GGCAAATGGCATTCTGACATCCT-3′)为引物(由GenScript公司合成),采用PCR验证xynDm基因是否插入。
1.5 XynDm的逐级诱导表达及活性测定
1.5.1 XynDm的试管、摇瓶表达及酶活性的定性和定量测定根据Invitrogen的毕赤酵母GS115表达手册,将抗4 mg·mL-1G418的21个转化子从缓冲复合甘油培养基(buffered glycerol-complex medium,BMGY)转接至5 mL缓冲复合甲醇培养基(buffered methanol-complex medium,BMMY),使菌悬液的A600值为0.9~1.1,进行试管甲醇诱导表达,于29 ℃、220 r·min-1水浴恒温振荡器中培养,每24 h添加甲醇至终含量为0.5%,诱导表达48 h结束,采集样品,经低温高速离心机以4 000 r·min-1离心30 min后取上清液用于测定葡聚糖酶和木聚糖酶活性。从上述转化子中挑取酶活性最高的转化子,在250 mL摇瓶中扩大培养,甲醇诱导144 h。摇瓶表达为每瓶100 mL BMMY培养基,培养条件及样品的处理和测定与试管培养一致。
分别取摇瓶中诱导培养36和72 h的GS115-pPIC9K和GS115以及分别诱导表达0、36和72 h的GS115-pPIC9K-xynDm的培养上清液,以高黏度阿拉伯木聚糖或大麦β-葡聚糖为底物,采用刚果红平板染色法定性检测XynDm的酶活性[7]。分别以高黏度阿拉伯木聚糖或大麦β-葡聚糖为底物,采用DNS法定量测定XynDm的木聚糖酶和葡聚糖酶活性[8-9],酶活性均测定3次。1个木聚糖酶活性单位(IU)是以 8 mg·mL-1高黏度阿拉伯木聚糖为底物,在pH6.0、37 ℃条件下每分钟分解木聚糖生成1 μmol还原糖所需的酶量。1个葡聚糖酶活性单位(IU)是以8 mg·mL-1大麦葡聚糖为底物,在pH6.0、55 ℃条件下每分钟分解葡聚糖生成1 μmol还原糖所需的酶量。
1.5.2 XynDm在发酵罐中的高密度发酵表达及纯化鉴定将工程菌划线培养后挑取单克隆进行液体培养,当菌液中菌浓度为108CFU时,取3 mL菌液加入300 mL BMGY培养基中培养48 h,得到的菌液为种子液(A600>2)。在装有3 L FM22培养基[(KH2PO4、(NH4)2SO4、CaSO4·2H2O、K2SO4、MgSO4·7H2O]的发酵罐中接种300 mL种子液,分别以甲醇或山梨醇/甲醇(体积比为1∶6)为碳源(单碳源和双碳源的添加量均为60 μL·min-1,持续添加),诱导表达144 h。每12 h收集样品10 mL,离心后取上清液用于酶活性的测定和SDS-PAGE及酶谱分析[10]。
活性酶谱的凝胶配制与SDS-PAGE(120 g·L-1分离胶及浓缩胶:双蒸水,30 g·L-1丙烯酰胺,1.5 mol·L-1Tris-HCl、pH8.0,1 mol·L-1Tris-HCl、pH6.8,100 g·L-1SDS,100 g·L-1过硫酸铵,5 μL四甲基乙二胺)相同,酶谱凝胶中分别加入8 g·L-1阿拉伯高黏度木聚糖和大麦低黏度葡聚糖,酶液与未加二硫苏糖醇的2×SDS-PAGE上样缓冲液(1 mol·L-1Tris-HCl、pH8.0,20 g·L-1SDS,1 g·L-1%溴酚蓝,100 g·L-1甘油)1∶1(体积比)混匀上样电泳。取下凝胶置于洗涤液(10 mmol·L-1CaCl2、10 mmol·L-1NaCl、2.5% Triton X-100、Tris,pH7.5)中洗涤2次,每次15 min,以去除凝胶中的SDS,再置于孵育液(10 mmol·L-1CaCl2、10 mmol·L-1NaCl、Tris,pH7.5)中清洗3次,每次10 min,更换新的孵育液并将凝胶放入37和55 ℃中孵育1 h。将凝胶使用10 g·L-1的刚果红染色30 min,用1 mol·L-1NaCl溶液脱色至出现清晰条带。
取发酵上清液经超滤浓缩后用葡聚糖凝胶G-100层析,选用长为50 cm、直径为1 cm的层析柱,使用0.2 mol·L-1磷酸氢二钠-柠檬酸缓冲液为洗脱液,以部分收集器每1 min收集1管,根据A280值绘制吸收曲线。合并同一吸收峰的组分,采用DNS法测定XynDm各吸收峰的木聚糖酶和葡聚糖酶活性并进行SDS-PAGE。
1.6 XynDm酶学特性测定
1.6.1 XynDm的最适pH值及不同pH值下的稳定性取纯化后的XynDm与不同pH值的缓冲液(pH2.2、0.2 mol·L-1甘氨酸-盐酸缓冲液,pH值2.5~8.0、0.2 mol·L-1磷酸氢二钠-柠檬酸缓冲液,pH值 8.5~10.5、0.2 mol·L-1甘氨酸-氢氧化钠缓冲液)适当稀释,在pH 值2~11条件下,分别于37和55 ℃反应 5 min 测定木聚糖酶和葡聚糖酶活性。每0.5个pH值为1个间隔,以酶活性最高为100%,以相对酶活性判断XynDm的最适pH值。在pH值2~11条件下,将XynDm于37和55 ℃保持60 min后分别测定剩余的木聚糖酶和葡聚糖酶活性,以酶活性最高为100%,以相对酶活性判断XynDm在不同pH值下的稳定性。
1.6.2 XynDm的最适温度及不同温度下的稳定性取纯化后的XynDm,分别在10~90 ℃条件下于pH6.0反应5 min,测定其酶活性,温度间隔为10 ℃,以酶活性最高为100%,以相对酶活性判断XynDm的最适温度。取XynDm在上述温度条件下放置60 min后于pH6.0条件下测定剩余酶活性,以酶活性最高为100%,以相对酶活性判断XynDm在不同温度下的稳定性。
1.6.3 XynDm的底物特异性取纯化后的XynDm,以浓度为8 mg·mL-1(终浓度为0.027 mmol·mL-1)的桦木木聚糖(BX)、燕麦木聚糖(OSX)、4-O-甲基-D-葡萄糖醛酸-D-木聚糖(MGX)、高黏度阿拉伯木聚糖(AXH)和对硝基苯酚-β-D-木糖苷(pNPX)为底物,参考上述方法在最适条件下测定木聚糖酶的最适底物;以8 mg·mL-1的地衣多糖(Li)、低黏度大麦β-葡聚糖(BGL)、高黏度大麦β-葡聚糖(BGH)和羧甲基纤维素(CMC)为底物,在最适条件下测定葡聚糖酶的最适底物,以酶活性最高为100%。
1.6.4 金属离子、螯合剂和表面活性剂对XynDm活性的影响测定取10 μL 10 mmol·L-1的双蒸水配制的含金属离子溶液(CaCl2、MgSO4、AlCl3、MnCl2、FeSO4、FeCl3、CuSO4、ZnSO4、AgNO3、BaCl2、CoCl2、LiCl、(NH4)2SO4、KCl、NaCl)和乙二胺四乙酸(EDTA)、十二烷基硫酸钠(SDS)、β-巯基乙醇(β-ME)、二硫苏糖醇(DTT)(参与作用的金属离子及试剂的浓度均为1 mmol·L-1)与90 μL酶液混匀后在室温下保持 60 min,在pH6.0、温度分别为37和55 ℃条件下测定木聚糖酶和葡聚糖酶活性,以加入10 μL双蒸水的酶活性(对照)为100%计算各底物的相对酶活性。
1.6.5 XynDm酶解反应的动力学参数测定将酶液与不同质量浓度(0、1、2、3、4、5、6、7、8、9和10 mg·mL-1)和不同底物的溶液在最适条件下反应并测定酶活性,使用Lineweaver-Burk双倒数作图法计算XynDm酶解反应的米氏方程并计算米氏常数(Km)和最大反应速度(Vmax)。
2 结果与分析
2.1 黄色瘤胃球菌xynD基因的密码子优化
优化后的xynDm基因经DNA测序,基因全长1 863 bp,编码621个氨基酸残基,理论相对分子质量为69.0×103,优化前后DNA序列的一致性为78.37%,提交至GenBank后获得的登录号为MW290983。
2.2 XynDm重组酵母表达质粒的构建与鉴定
从图1可以看出:重组质粒pPIC9K-xynDm经BamHⅠ和SalⅠ双酶切,电泳显示有2条DNA条带,相对分子质量与预期相符,初步说明xynDm基因已插入到pPIC9K。从图2可以看出:提取GS115-pPIC9K-xynDm、GS115和GS115-pPIC9K基因组DNA,经PCR和电泳后GS115在2 200 bp左右出现1条带,此条带为野生型乙醇氧化酶(AOX1)基因扩增产物;GS115-pPIC9K有2条带分别在2 200和500 bp左右,分别为野生型AOX1基因和α-因子编码基因扩增产物;GS115-pPIC9K-xynDm的PCR产物在2 200和 2 400 bp 左右分别有2条带,分别为野生型AOX1基因和α-因子及目的基因扩增产物,表明目的基因xynDm成功导入P.pastorisGS115基因组DNA。

图1 双酶切重组质粒的鉴定Fig.1 Identification of expression plasmids bydouble enzyme digestionM. DL10000 DNA 标准品 DNA marker DL10000;1. 重组质粒Recombinant plasmid;2. 经BamHⅠ和SalⅠ双酶切的重组质粒Recombinant plasmid digested with BamHⅠand SalⅠ.
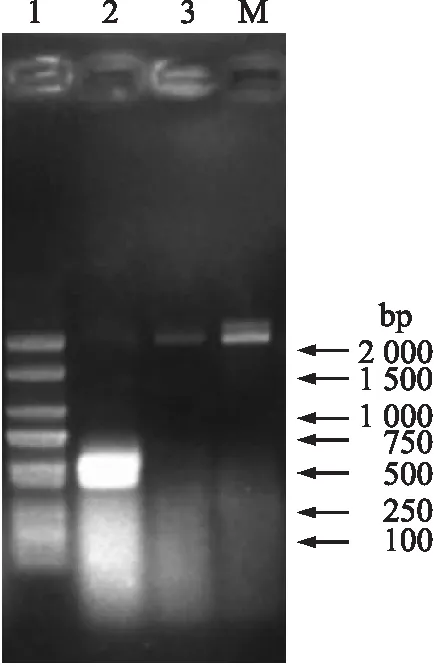
图2 重组酵母鉴定Fig.2 Identification of recombinant Pichia pastorisM. DL2000 DNA 标准品DNA marker DL2000;1. GS115-pPIC9K基因组DNA GS115-pPIC9K genomic DNA;2. GS115基因组DNA GS115 genomic DNA;3. 重组毕赤酵母Recombinant P.pastoris.

图3 XynDm在试管表达下的酶活性Fig.3 Enzyme activty of XynDm expressed in test tube
2.3 XynDm的逐级诱导表达及酶活性
2.3.1 XynDm转化子的初筛经筛选共得到抗4 mg·mL-1G418的Mut+转化子21个。在试管中,XynDm的木聚糖酶平均酶活性为21.14 IU·mL-1,XynDm的葡聚糖酶平均酶活性为9.05 IU·mL-1,其中338号转化子的木聚糖酶活性为26.41 IU·mL-1,葡聚糖酶活性为24.93 IU·mL-1,木聚糖酶活性是平均活性的1.25倍,葡聚糖酶活性是平均活性的2.75倍。后续试验均选取338号转化子。
2.3.2 XynDm在摇瓶中经甲醇诱导表达酶活性的定性测定338号转化子的XynDm木聚糖酶经诱导 0~36 h,随诱导时间的延长,酶活性逐渐增加,在36 h的酶活性达到最大(36.20 IU·mL-1);之后随着时间的延长酶活性快速下降(图4-A)。XynDm葡聚糖酶经诱导0~72 h,随着诱导时间延长,酶活性升高,在诱导72 h时,酶活性达到最大值(106.24 IU·mL-1);之后随着时间延长酶活性趋于稳定(图4-B)。

图4 XynDm在摇瓶培养条件下的酶活性Fig.4 Enzyme activity of XynDm expressed in flask level
2.3.3 刚果红平板染色法定性检测XynDm活性从图5-A可知,分别诱导12和36 h的酶液在含阿拉伯木聚糖的平板中产生直径分别为18和20 mm的透明圈(a1、b1)。如图5-B可知,分别诱导36和72 h的酶液在含大麦β-葡聚糖的平板中产生直径分别为21和25 mm的透明圈(a2、b2),这表明XynDm在P.pastorisGS115中得到表达,产生了木聚糖酶和葡聚糖酶。分别诱导36 h、72 h的P.pastorisGS115、转化空表达载体pPIC9K的P.pastorisGS115以及338号未诱导时的发酵液均未产生透明水解圈,说明它们没有酶分泌。
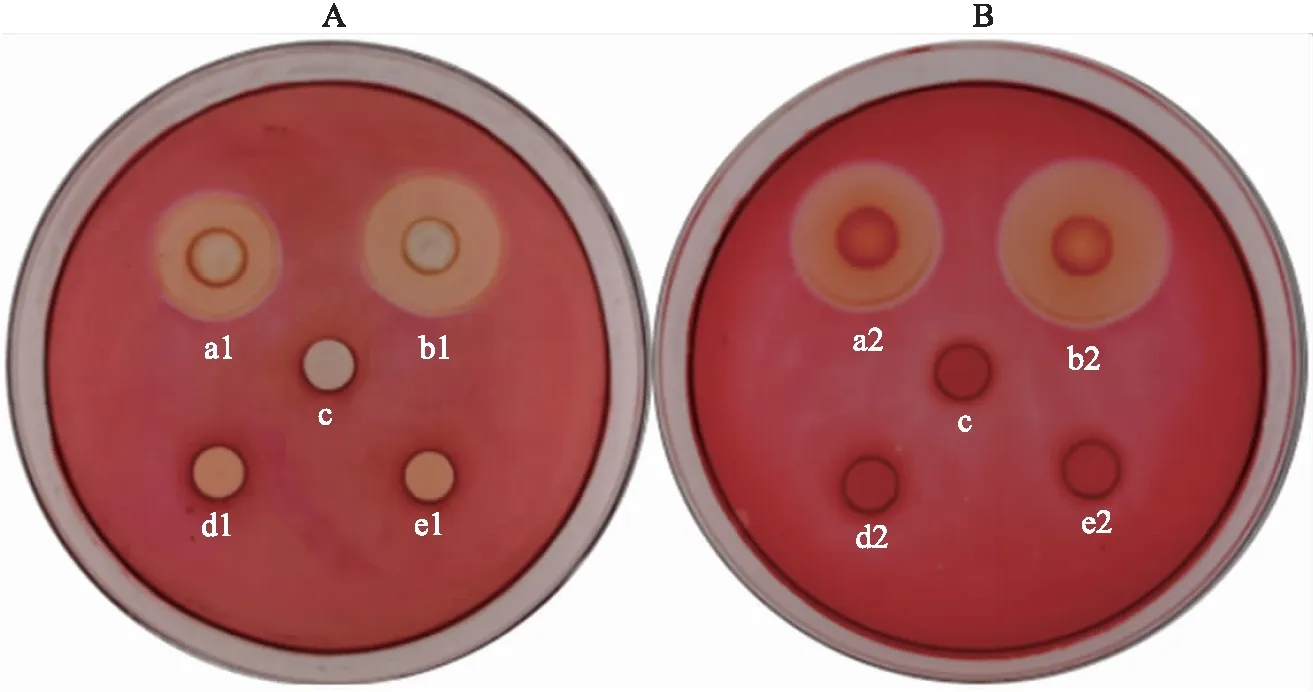
图5 阿拉伯木聚糖(高黏度,A)和大麦葡聚糖(低黏度,B)刚果红琼脂平板染色法测定XynDm酶活性Fig.5 Identification of bifunctional enzyme activity by Congo red staining on arabinoxylan(high viscosity,A)and barley β-glucan(low viscosity,B)agar platesa1、a2. 诱导12和36 h的GS115-pPIC9K-xynDm GS115-pPIC9K-xynDm induced for 12 and 36 h;b1、b2. 诱导36和72 h的GS115-pPIC9K-xynDm GS115-pPIC9K-xynDm induced for 36 and 72 h;c. 诱导前的GS115-pPIC9K-xynDm GS115-pPIC9K-xynDm before induced;d1、d2. 诱导36和72 h的毕赤酵母GS115 The host P.pastoris GS115 induced for 36 and 72 h);e1、e2. 诱导36和72 h的GS115-pPIC9K GS115-pPIC9K induced for 36 and 72 h.
2.3.4 XynDm在发酵罐中表达的酶活性如图6-A所示:以甲醇为碳源时,XynDm木聚糖酶活性在诱导36 h时达到最大值,为265.32 IU·mL-1,比活性最高为468.36 IU·mg-1,之后随着时间增加而平稳下降;而以甲醇/山梨醇为碳源表达时木聚糖酶活性随着时间的增加而上升,在144 h达到最大且趋于稳定,酶活性为267.27 IU·mL-1,比活性仅为154.65 IU·mg-1。如图6-B所示:XynDm葡聚糖酶活性在以甲醇以及以甲醇/山梨醇为碳源时变化曲线基本一致,酶活性随着时间的增加而上升并在72 h达到最大,分别为 2 260.87 和3 547.39 IU·mL-1,且比活性也达到最大,分别为3 208.31和2 563.51 IU·mg-1;单碳源时的酶活性随着时间增加趋于平稳,双碳源时的酶活性有较明显的波动。
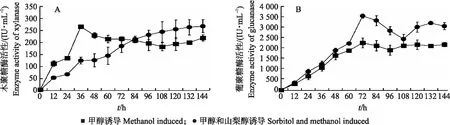
图6 在发酵罐中XynDm木聚糖酶(A)和葡聚糖酶(B)的酶活性随诱导时间的变化Fig.6 Changes of xylanase(A)and glucanase(B)enzyme activity of XynDm with induction time in fermentor
2.4 XynDm的SDS-PAGE分析及酶谱分析
如图7所示:发酵上清经SDS-PAGE,在66.2×103~97.4×103与31.0×103~42.7×103出现了明显的蛋白条带。由于0 h时在66.2×103左右有1条条带,而0 h几乎没有酶活性,因此该条带应当为非目的条带。
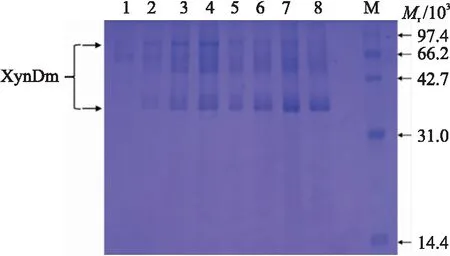
图7 不同时间发酵上清液的SDS-PAGEFig.7 SDS-PAGE of fermentation supernatantsharvested at different timeM. 蛋白标准品Protein marker;1~8. 诱导0、12、24、36、48、60、72和84 hInduced 0,12,24,36,48,60,72 and 84 h.
如图8-A所示:对36和72 h的摇瓶酶液和发酵罐酶液进行酶谱分析,泳道1和2为摇瓶表达72和36 h的葡聚糖酶活性,在85.0×103左右出现条带;泳道3和4为发酵罐表达葡聚糖酶活性,在35.0×103左右出现条带;泳道5由于摇瓶中的木聚糖酶活性在72 h很低,因此未出现条带,可能由于发酵罐高密度表达后的酶活性较高,也有可能是在35.0×103左右时具有2种酶活性。
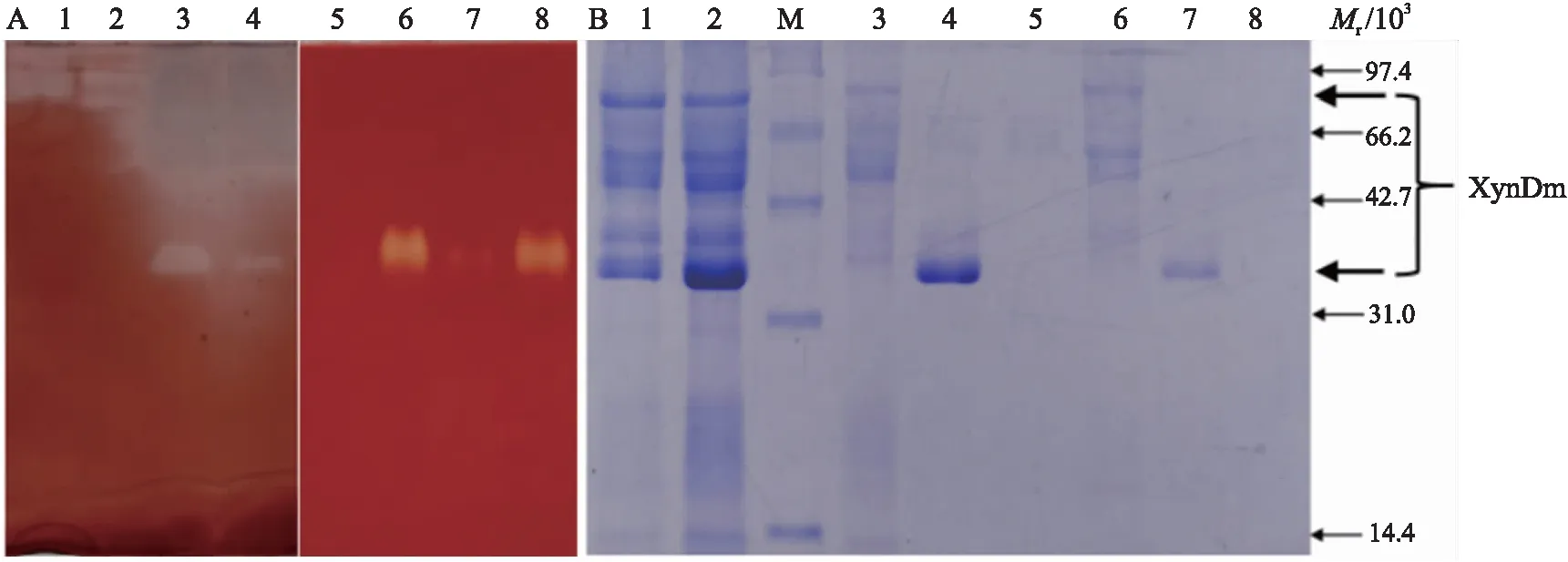
图8 XynDm的酶谱(A)及不同酶谱组分的SDS-PAGE(B)Fig.8 Zymogram(A)and SDS-PAGE(B)of different chromatographed fractionsA. 1~2. 在摇瓶中72和36 h的葡聚糖酶谱72 and 36 h glucanase zymogram in flask;3~4. 在发酵罐中72和36 h的葡聚糖酶谱72 and 36 h glucanase zymogram in fermentor;5~6. 在摇瓶中72和36 h的木聚糖酶谱72 and 36 h xylanase zymogram in flask;7~8. 在发酵罐中72和36 h的木聚糖酶谱72 and 36 h xylanase zymogram in fermentor.B. M. 蛋白标准品Protein marker;1、2. 36和72 h的浓缩上清液36 and 72 h concentrated supernatants;3、6. 72和36 h的组分1 72 h and 36 h fractions 1;4、7. 72和36 h的组分272 h and 36 h fractions 2;5、8. 72和36 h其他酶谱组分 72 h and 36 h other chromatographed fractions.
如图8-B所示:对72和36 h的酶液进行层析纯化,得到3个组分,其中组分1和组分2均含有蛋白质且具有酶活性。经测定,组分1具有葡聚糖酶活性,组分2具有木聚糖酶活性及葡聚糖酶活性,组分3无蛋白质且不具有酶活性,有可能是培养基的成分。对比图8-A与图8-B,可以推断具有酶活性的条带如同图7所指位置,分别为具有葡聚糖酶活性的条带出现在85.0×103左右和35.0×103左右,均具有木聚糖酶活性的条带出现在35.0×103左右。
2.5 XynDm酶学性质研究
2.5.1 XynDm的最适反应温度及温度稳定性从图9可知:在10~37 ℃,随着温度的升高,木聚糖酶活性迅速升高,在37 ℃时酶活性到达最高,之后随着温度升高酶活快速下降;木聚糖酶在37~40 ℃保持 60 min,相对酶活性均>80%;随后酶活性迅速降低。因此,木聚糖酶最适温度为37 ℃,并在37~40 ℃较稳定。在10~50 ℃,随着温度的升高,葡聚糖酶活性逐渐提高,并在55 ℃时酶活性达到最高,之后随着温度升高酶活性逐渐下降;葡聚糖酶在各温度下保持60 min,40~55 ℃相对酶活性均>80%,之后酶活性迅速下降。因此,葡聚糖酶最适温度为55 ℃,并在40~55 ℃热稳定较好。

图9 XynDm的最适温度及温度稳定性Fig.9 Optimum temperature and temperature stability of XynDm
2.5.2 XynDm的最适反应pH值及pH稳定性由图10可知:木聚糖酶在pH3.5时相对酶活性为23.88%;在pH值4.5~6.5时,相对酶活性均在80%以上;在pH10时,相对酶活性仅为11.32%。将其在各pH值下保持60 min,在pH3.5时剩余酶活性为35.67%;在pH值4.5~6.5时酶活性均大于80%;当pH值升高至10.0时,木聚糖酶的剩余酶活性仅为18.49%。因此,木聚糖酶最适反应pH值为6.0,在pH值4.5~6.5的条件下较稳定。葡聚糖酶在pH4.0的相对酶活性为15.66%;在pH值5.5~9.0时,相对酶活性均在80%以上;在pH11.0时相对酶活性仅为11.20%。将其在各pH值下保持60 min,在pH4.0时剩余酶活性为 7.97%;在pH值5.5~9.0时酶活性均大于80%;当pH值升高至11.0时剩余酶活性仅为7.14%。因此,葡聚糖酶最适反应pH值为6.0,在pH值5.5~9.0的条件下较稳定。

图10 XynDm酶活性的最适pH值及pH值稳定性Fig.10 Optimum pH value and pH value stability of XynDm enzyme activity
2.5.3 XynDm的底物特异性从图11可知:XynDm木聚糖酶对4-O-甲基-D-葡萄糖醛酸-D-木聚糖(MGX)的水解作用最好,并以此为100%,对高黏度阿拉伯木聚糖(AXH)和桦木木聚糖(BX)的水解作用也较好,分别为94.67%和90.88%,对燕麦木聚糖(OSX)的水解作用为56.89%,对对硝基苯酚-β-D-木糖苷(pNPX)的水解作用较弱,为3.36%。XynDm葡聚糖酶对大麦低黏度葡聚糖(BGL)水解作用最好,以此为100%,对大麦高黏度葡聚糖酶(BGH)具有较好的水解作用,为76.44%,对地衣多糖(Li)的水解作用较弱,为19.45%,几乎不降解羧甲基纤维素(CMC)。
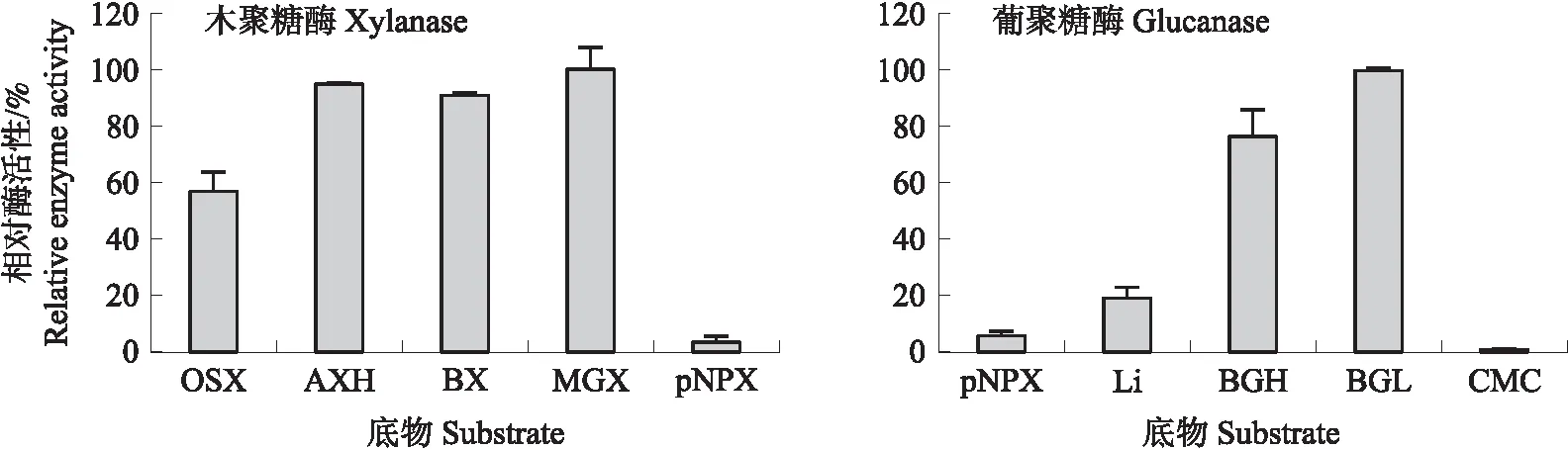
图11 XynDm的底物特异性Fig.11 Substrate specificity of XynDmOSX:燕麦木聚糖Oat splet xylan;AXH:阿拉伯木聚糖(高黏度)Arabinoxylan(high viscosity);BX:桦木木聚糖birchwood xylan;MGX:4-O-甲基-D-葡萄糖醛酸-D-木聚糖4-O-methyl-D-glucurono-D-xylan;pNPX:对硝基苯酚-β-D-木糖苷p-nitrophenyl-β-D-xyloside;Li:地衣多糖 Lichenan;BGH:大麦葡聚糖(高黏度)Barley β-glucan(high viscosity);BGL:大麦葡聚糖(低黏度)Barley β-glucan(low viscosity);CMC:羧甲基纤维素Carboxymethyl cellulose.

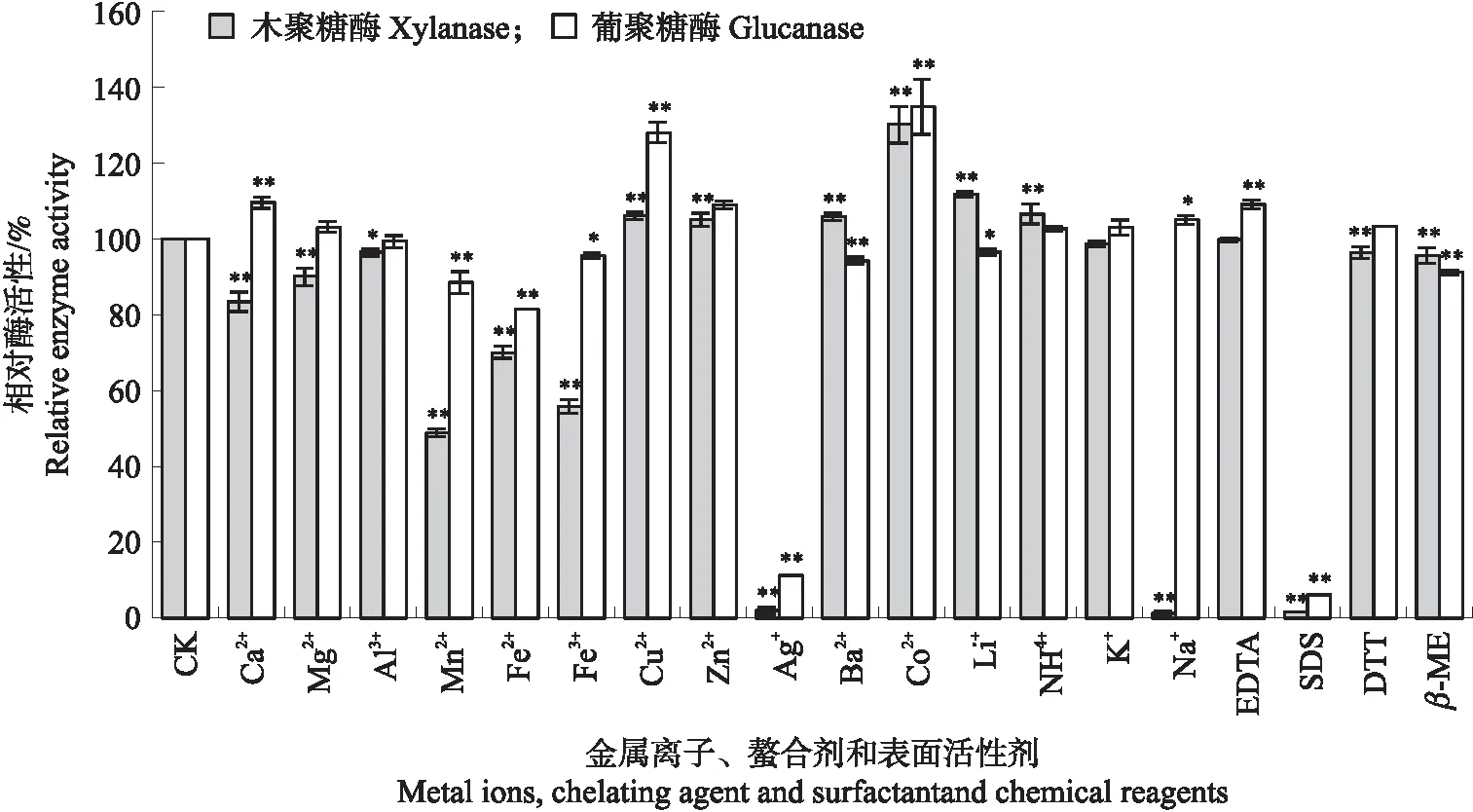
图12 金属离子、螯合剂及表面活性剂对XynDm的影响Fig.12 The influence of metal ions,chelating agent and surfactant chemical reagent on XynDm*、**分别表示与对照组相比差异显著(P<0.05)和差异极显著(P<0.01)*,**mean significant difference(P<0.05)and extremely significant differences(P<0.01)compared with black control。CK为空白对照CK means blank control;EDTA、DTT和 β-ME为螯合剂EDTA、DTT and β-ME are chelating agent;SDS为表面活性剂SDS is surfactant.
2.5.5 XynDm的动力学参数如图13-A所示,XynDm以高黏度阿拉伯木聚糖为底物时,酶促反应的米氏方程:1/V=0.0285(l/[S])+2.0×10-4,米氏常数Km为142.5 mg·mL-1,最大反应速度Vmax为5×103mg·mL-1·min-1。如图13-B所示,以大麦β-葡聚糖为底物时,米氏方程:1/V=0.0019(l/[S])+1.0×10-5,米氏常数Km为190.0 mg·mL-1,最大反应速度Vmax为1.0×105mg·mL-1·min-1。

图13 XynDm以木聚糖(A)和β-葡聚糖(B)为底物时酶解反应的1/V与1/[S]关系图Fig.13 The relationship between 1/V and 1/[S] of XynDm with xylan(A)and β-glucan(B)as substrate
3 讨论
对基因进行密码子优化是提高异源蛋白表达水平的主要途径之一。Lu等[11]基于P.pastoris密码子使用偏爱性对芽胞杆菌木聚糖酶基因XynHBN188A进行优化,G-C含量从39.60%提高至42.41%,酶活力提高39.5%。基因优化主要针对密码子的特性、G-C含量及mRNA二级结构进行。杨玉霞等[12]将产琥珀酸丝状杆菌的β-聚糖酶基因FsGLU进行密码子优化后在毕赤酵母中表达,表达的重组酶活性达到 6 424 U·mg-1;而经大肠杆菌BL21(DE3)表达的酶活性仅为3.3 IU·mg-1[13]。本试验为提高黄色瘤胃球菌xynD基因在毕赤酵母中的表达水平(由于目前对催化模块间的连接区域功能尚不知晓,因此将催化模块间的连接区域去除),经过密码子优化后,xynD的G-C含量从47.19%降低至41.96%,密码子适应指数(codon adaptation index,CAI)从0.70升高到0.86,使mRNA结构更加稳定,更有利于XynDm基因的表达。
在本试验中,XynDm由621个氨基酸残基组成,理论分子质量69.0×103,图5中所示有1条略高于理论分子质量的条带,可能是由于XynDm表达后发生了磷酸化、糖基化等翻译后修饰,导致条带迁移率下降;还有1条低于理论分子质量的条带,可能是由于随着发酵时间的延长,毕赤酵母本身产生的蛋白酶降解XynDm所致;也可能由于蛋白前体在进行加工时,Kex2蛋白酶将蛋白前体剪切,导致酶蛋白分子质量降低。
本试验中的双功能酶由于其对木聚糖和葡聚糖均具有较高的催化效率而受到关注。李晓丽等[14]从嗜热子囊菌(ThermoascuscrustaceusJCM12803)中表达了木聚糖酶和纤维素酶TcXyn10A双功能酶基因,其中木聚糖酶和纤维素酶比活性分别为1 480.0和7.4 U·mg-1。Qiao等[15]研究的2个嵌合基因表达产物XynA-Bs-Glu-1和XynA-Bs-Glu-2,具有木聚糖酶和葡聚糖酶的活性,XynA-Bs-Glu-1的比活性分别为303.5和377.1 IU·mg-1,XynA-Bs-Glu-2的比活性分别为102.0和303.5 IU·mg-1。谢晨等[16]从黑酵母(Hortaeawerneckii)中得到的糖苷水解酶HwXYL10A基因在毕赤酵母中表达,以榉木木聚糖、甘蔗木聚糖和玉米芯木聚糖为底物测得比活性分别是3 260、3 160和3 870 U·mg-1,10 mmol·L-1Mn2+对Hortaeawerneckii的HwXYL10A木聚糖酶活性有一定的抑制作用,而Ca2+和K+的促进效果更明显。Kiribayeva等[17]从BacillussonorensisT6菌株中表达木聚糖酶基因rXynT6,并在大肠杆菌(rXynT6-E)和毕赤酵母(rXynT6-P)中表达。rXynT6-E和rXynT6-P表达的木聚糖酶的比活性分别为1 030.2和873.8 U·mg-1。Liu等[18]从氧化节杆菌G6-4B中纯化葡聚糖酶,经过阴离子交换层析,葡聚糖酶成功纯化了32.25倍,比活性为288.62 U·mg-1,葡聚糖酶活性被Ni+、Cu2+、Zn2+、Fe3+和Co2+等金属离子显著抑制。本试验中xynD基因在毕赤酵母中表达后,表现出木聚糖酶和葡聚糖酶的双酶活性,且比活性分别达到468.36和3 208.31 IU·mg-1,比已报道的双功能酶的活性高,相较于单功能酶,其能达到2种酶的效果,且酶活性也相对较高。
酶分子中的活性中心是由必需基团所组成的特定空间结构,酶蛋白结构会随着环境(如pH值、温度和化学试剂等)改变导致双功能酶蛋白结构变化,会使其生物活性显著变化甚至完全被抑制。StreptomycesthermocerradoensisI3固态发酵时分泌的双功能木聚糖酶/内切葡聚糖酶活性在70 ℃、pH6.0和55 ℃、pH6.0条件下,均表现出2种酶最佳活性,且均在pH值4.0~9.0时具有60%酶活性;木聚糖酶活性在60~80 ℃保持稳定,葡聚糖酶在50~70 ℃下保持60%酶活性[19]。Mondal等[20]从黄色瘤胃球菌中得到的纤维素酶RfGH16基因,经大肠杆菌BL21表达的RfGH16_21在pH值5.0~8.0和温度50~70 ℃下均表现出稳定的酶活性,在pH7.0和55 ℃达到最适和最大酶活性,RfGH16_21对大麦β-D-葡聚糖显示最大酶活性(257 U·mg-1),其次是地衣多糖(247 U·mg-1),但对其他供试多糖均未表现出明显活性,表明其具有特异性β-1,3-1,4-内切葡聚糖酶活性。Goyal等[21]从黄色瘤胃球菌得到的纤维素酶RfGH5,其N端结构域具有内切葡聚糖酶活性的糖苷水解酶5家族基因GH5_4,C端结构域是内切甘露聚糖酶基因(GH5_7)。将GH5_7(RfGH5_7)在大肠杆菌BL21(DE3)中表达并纯化,表达产物RfGH5_7对刺槐豆半乳甘露聚糖酶的活性最高(298.5 U·mg-1),其次是对魔芋葡甘露聚糖酶(256.2 U·mg-1)和胡萝卜半乳甘露聚糖酶(177.2 U·mg-1)。RfGH5_7的最适pH值为6.0,最适温度为60 ℃。RfGH5_7在pH值6.0~9.0具有较好的稳定性,在50 ℃时热稳定性较好;10 mmol·L Ca2+使其酶活提高了33%。王小松等[22]将贵州木霉NJAU4742几丁质酶基因chi8表达至大肠杆菌,表达产物Chi8在30~40 ℃具有较好的热稳定性,但高于50 ℃时基本失去活性。本研究分别以高黏度阿拉伯木聚糖和大麦葡聚糖为底物,得到双功能酶的木聚糖酶最适反应温度37 ℃、最适pH值为6.0,在温度37~40 ℃、pH值4.5~6.5下具有较好的稳定性;葡聚糖酶最适反应温度 55 ℃、最适pH值为6.0,在温度40~55 ℃、pH值5.5~9.0下保持良好的稳定性:证明XynDm的适宜活性pH值呈弱酸性至中性。不同菌种产生的双功能酶不同,每种酶的结构存在差异,因此最适条件和稳定性不同,与黄色瘤胃球菌中的其他酶相比,pH值和温度稳定性具有一定的相似性,由于基因所在位置、催化结构域以及不同的酶类型,最适条件和稳定性也会存在差异。该试验中的XynDm双功能酶在最适条件下,对高黏度阿拉伯木聚糖和大麦葡聚糖的降解作用均最强,其次是低黏度阿拉伯木聚糖,对对硝基苯酚底物的降解活性较弱;另外葡聚糖酶对羧甲基纤维素和地衣多糖无降解作用或较弱。
金属离子导致双功能酶活性有不同的变化。Co2+、Mn2+和Zn2+对Bacillussp.CSB55的葡聚糖酶活性有激活作用,EDTA和Ca2+对其有抑制作用[23]。李凌波等[24]筛选表达了纤维素酶cell基因,Co2+、Mn2+、Ca2+对内切纤维素酶活性有激活作用,Mn2+对外切纤维素酶活性有显著激活作用,Zn2+、Fe3+具有抑制作用。PenicilliumchrysogenumP33的xyl1、xyl2、xyl3三种木聚糖酶活性被Na+和K+激活,而被Cu2+、Ag+和Fe3+抑制[25]。本试验中XynDm双功能酶活性可被Cu2+、Zn2+和Co2+激活,可能是离子促进了酶蛋白与底物的结合;Fe2+、Ag+、SDS和β-ME抑制双功能酶活性,有可能是金属离子、SDS和β-ME破坏了酶的空间结构,使酶活性下降或者失去。
综上,优化后的黄色瘤胃球菌双功能酶基因xynD在毕赤酵母中得到表达,在发酵罐中表达的XynDm的木聚糖酶与葡聚糖酶在36和72 h时酶活性和比活性均达到最大值,分别为265.32、468.36 IU·mL-1和2 260.87、3 208.31 IU·mg-1。XynDm的木聚糖酶最适反应温度和pH值分别为37 ℃和6.0,其葡聚糖酶最适反应温度和pH值分别为55 ℃和6.0。Cu2+、Zn2+和Co2+对双功能酶有激活作用,Ag+和SDS使其活性明显被抑制。

