肿瘤免疫治疗相关不良事件严重程度与外周血CD8+ T细胞水平的相关性Δ
化怡纯,李羽斌,安 娟,周莉莉,郑希希,施 卉,李晓燕(首都医科大学附属北京天坛医院肿瘤科,北京 100070)
针对程序性死亡受体1(programmed death-1,PD-1)途径的免疫检查点抑制剂(immune checkpoint inhibitor,ICI),在不同的恶性肿瘤中带来了显著的临床获益[1]。ICI通过阻断PD-1、与伴侣蛋白结合,导致肿瘤中的免疫微环境的激活,然而该过程可能导致过度活跃的免疫反应,从而引发免疫相关不良事件(immune-related adverse events,irAEs)[2]。任何器官都可能受到影响,irAEs最常发生在皮肤、内分泌器官、肝脏、肾脏和肺,有些不良反应并不常见,如心肌炎和神经毒性[3];而发生在有些部位的irAEs是严重的和致命的,如脑炎和心肌炎[4]。irAEs常与其他疾病相混淆,如感染、肿瘤进展以及其他药品不良反应等,从而使诊断出现困难[5]。因此,若存在标志物在发生irAEs时表现出异常,那么也许可以成为辅助诊断irAEs的一项依据。同时,irAEs的严重程度与转归密切相关,高级别的irAEs本身以及治疗所使用的糖皮质激素及免疫抑制剂等会带来一系列的严重后果[6-7]。因此,评估irAEs的易感人群十分关键。美国临床肿瘤学会关于ICI相关毒性的管理指南中推荐,在进行ICI治疗前,需要对患者的体力状况、是否患有免疫系统疾病、重要脏器的功能等进行评估[4]。但即便如此,在某些人群中依然会发生非预期的irAEs,既往有研究结果显示,血细胞计数[8]、自身抗体[9]、趋化因子[10]和C反应蛋白[11]等可能与irAEs的发生、发展存在一定的相关性。综上,寻找临床中简易可行的irAEs相关的标志物十分必要。本研究通过回顾性分析接受ICI治疗的实体瘤患者的CD4+T淋巴细胞、CD8+T淋巴细胞(以下简称CD4+、CD8+)水平,比较ICI治疗前及发生irAEs时CD4+、CD8+水平的变化,分析动态监测CD4+、CD8+水平与irAEs的发生及严重程度的相关性,现报告如下。
1 资料与方法
1.1 资料来源
选取2020年1月至2023年4月我院肿瘤内科178例接受ICI治疗的实体瘤患者作为研究对象。入选标准:接受免疫检查点抑制剂单药治疗或联合化疗、靶向治疗;有免疫治疗前和(或)发生irAEs时的CD4+、CD8+水平监测数据。排除标准:存在自身免疫性疾病者;合并严重感染者。其中irAEs组共32例患者,非irAEs组共146例患者,记录患者的年龄、性别等基本个人信息,收集患者的临床病理学资料、程序性死亡受体配体1(PD-L1)表达、肿瘤突变负荷(TMB)和治疗方案等,见表1。免疫检查点抑制剂包括PD-1单抗,如帕博利珠单抗、纳武利尤单抗、派安普利单抗、信迪利单抗、替雷利珠单抗、卡瑞利珠单抗和斯鲁利单抗等;或PD-L1单抗,如阿替利珠单抗、度伐利尤单抗等。所有患者均签署知情同意书,本研究经我院伦理审查委员会审查批准(伦理审查编号:KY2022-112-02)。

表1 患者的一般临床资料Tab 1 General clinical data of patients
1.2 方法
根据美国国家癌症研究所不良事件通用术语标准(CTCAE)5.0版本和2023年美国国家综合癌症网络免疫治疗相关毒性管理第2版,所有患者均接受ICI治疗,在ICI治疗前和(或)发生irAEs时接受外周血T淋巴细胞亚群检测,记录CD4+、CD8+水平。若发生irAEs,记录其发生时间、部位、级别、处理方法及转归等。
1.3 统计学方法
采用非参数Mann-Whitney检验计算CD4+、CD8+水平之间的统计学差异,使用ROC曲线计算cut-off值,分类变量比较采用χ2检验。双侧P<0.05为差异有统计学意义。所有计算均采用R软件4.3.0版本。
2 结果
2.1 irAEs的类型、分级及转归
32例患者发生irAEs,irAEs的类型和分级分布情况见表2。经治疗后,好转28例,稳定1例,恶化3例。
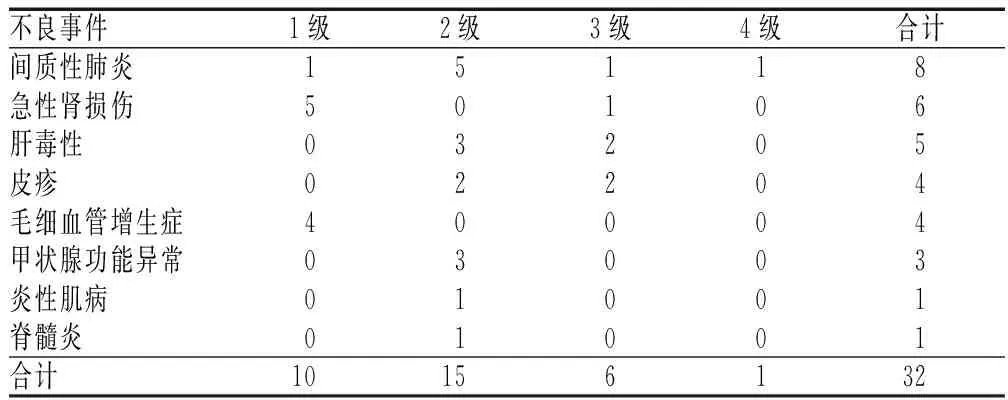
表2 irAEs的类型和分级分布情况(例)Tab 2 Distribution of types and grades of irAEs(cases)
2.2 ICI治疗前及发生irAEs时患者的CD4+、CD8+水平变化情况
发生irAEs的32例患者中,共有27例监测到了发生irAEs时CD4+、CD8+水平。在上述27例患者中,ICI治疗前CD4+水平的中位数为39.16%(范围:21.14%~63.95%),发生irAEs时CD4+水平的中位数为42.36%(范围:21.14%~63.63%),差异无统计学意义(P>0.05),见图1(A);ICI治疗前CD8+水平的中位数为26.80%(范围:17.34%~48.07%),发生irAEs时CD8+水平的中位数为27.73%(范围:15.95%~52.10%),差异无统计学意义(P>0.05),见图1(B)。提示发生irAEs时的CD4+、CD8+水平与ICI治疗前相比并无明显变化,动态监测CD4+、CD8+水平与irAEs的发生无相关性。
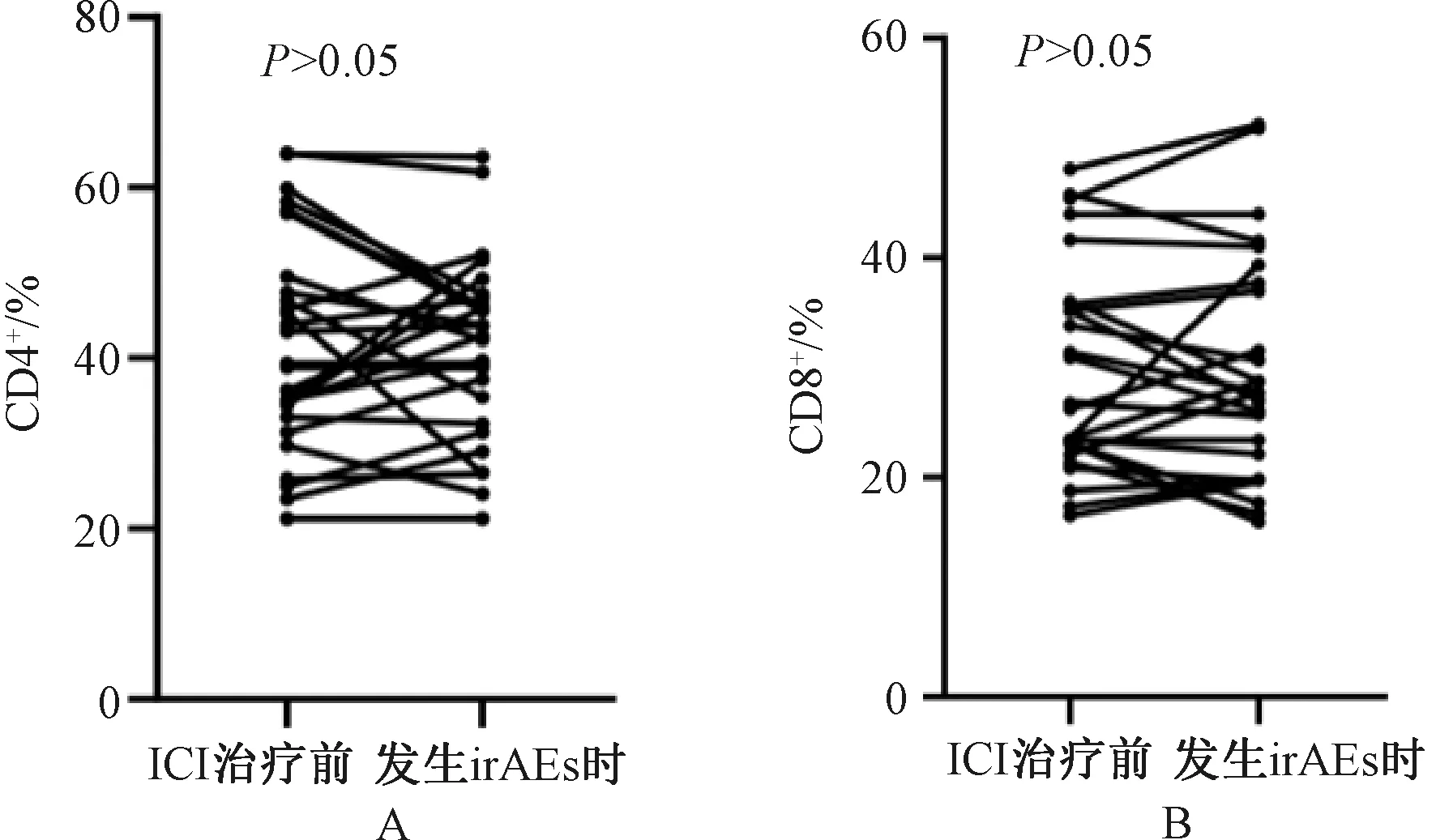
A.CD4+ 水平;B.CD8+水平。A. CD4+ levels; B. CD8+ levels.图1 ICI治疗前与发生irAEs时患者的CD4+、CD8+水平变化情况Fig 1 Changes of CD4+ and CD8+ levels before ICI treatment and at the occurrence of irAEs
2.3 irAEs等级与ICI治疗前CD4+水平的关系
32例发生irAEs的患者中,25例为1—2级irAEs患者,其ICI治疗前CD4+水平的中位数为43.27%(范围:21.14%~63.95%);7例为3—4级irAEs患者,其ICI治疗前CD4+水平的中位数为38.96%(范围:25.82%~47.68%),差异无统计学意义(P=0.474 4),提示治疗前CD4+水平与irAEs发生的严重程度无相关性,见图2。
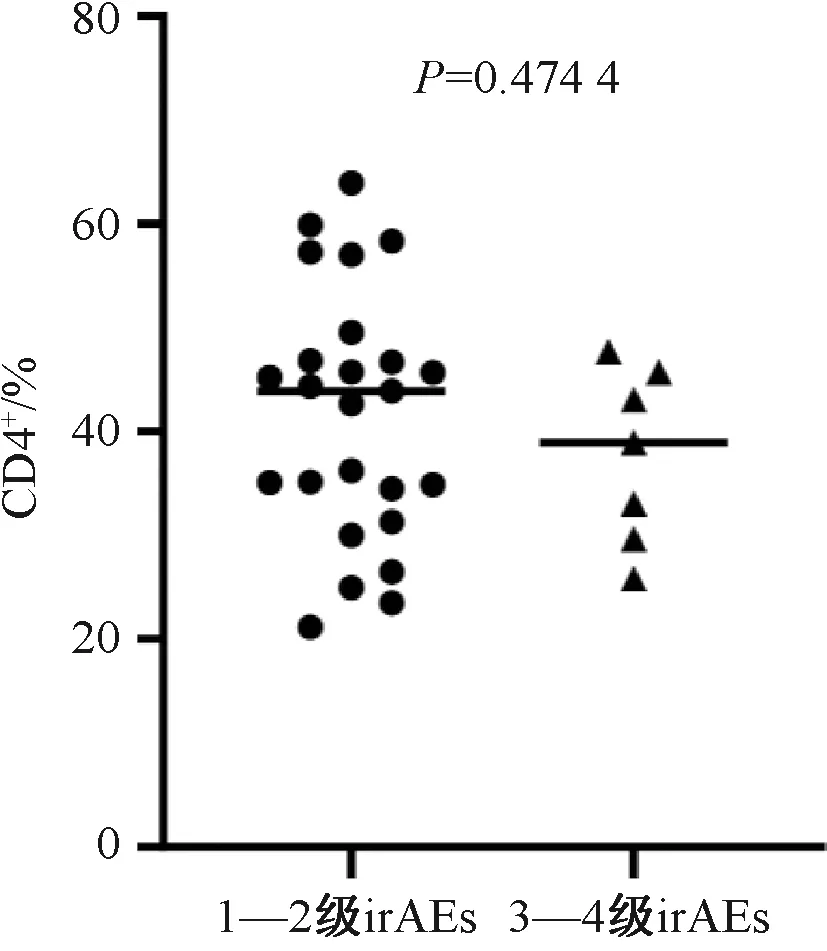
图2 发生1—2级irAEs与发生3—4级irAEs的患者ICI治疗前CD4+水平分布Fig 2 Distribution of CD4+ levels in patients with grade 1-2 irAEs and patients with grade 3-4 irAEs before ICI treatment
2.4 irAEs等级与CD8+水平的关系
25例1—2级irAEs患者ICI治疗前CD8+水平的中位数为27.36%(范围:17.34%~48.74%);7例3—4级irAEs患者ICI治疗前CD8+水平的中位数为36.04%(范围:18.76%~48.07%),高于1—2级irAEs患者,差异有统计学意义(P=0.042 2),提示ICI治疗前CD8+水平与irAEs发生的严重程度具有正相关性,见图3(A)。共有27例患者监测到了发生irAEs时的CD8+水平,此时1—2级irAEs患者CD8+水平的中位数为26.98%(范围:15.95%~43.97%),3—4级irAEs患者CD8+水平的中位数为37.67%(范围:19.80%~52.10%),差异无统计学意义(P=0.071 6),提示发生irAEs时的CD8+水平无法反映irAEs的严重程度,但3—4级irAEs患者较1—2级irAEs患者发生irAEs时的CD8+水平有一定的升高趋势,见图3(B)。
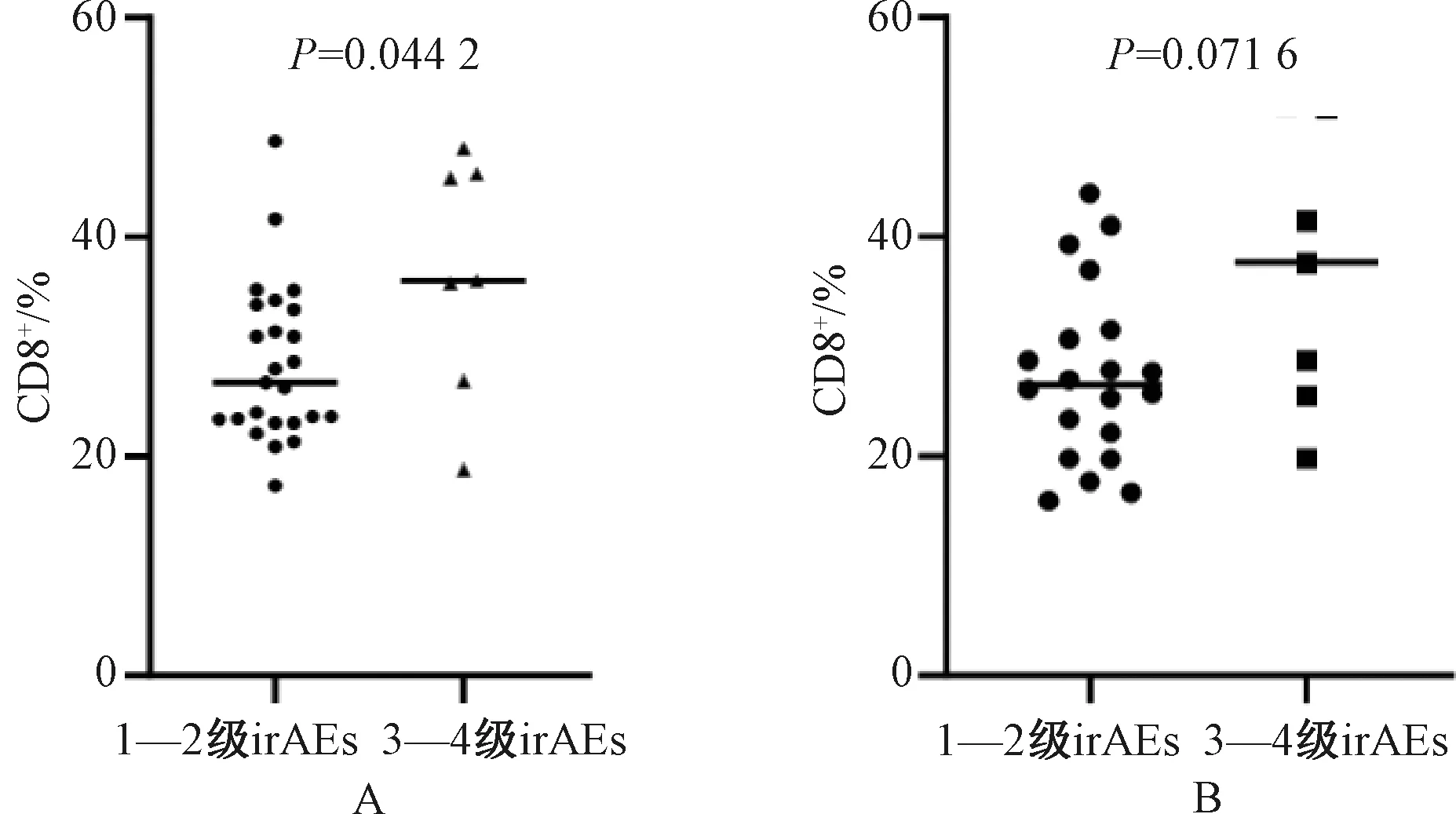
A.ICI治疗前;B.发生irAEs时。A. before ICI treatment; B. at the occurrence of irAEs.图3 发生1—2级irAEs与发生3—4级irAEs的患者ICI治疗前及发生irAEs时的CD8+水平分布Fig 3 Distribution of CD4+ levels in patients with grade 1-2 irAEs and patients with grade 3-4 irAEs before ICI treatment and at the occurrence of irAEs
2.5 不同irAEs等级患者ICI治疗前CD8+水平的cut-off值
1—2级与3—4级irAEs患者ICI治疗前CD8+水平的cut-off值为35.475%,曲线下面积(AUC)为0.771 4(95%CI=0.496 3~1.000 0),见图4。按照ICI治疗前CD8+水平=35%为界,将32例发生irAEs的患者分为两组,其中CD8+≤35%组患者23例,发生1—2级irAEs的患者有21例(占91.30%),发生3—4级irAEs的患者有2例(占8.70%);CD8+>35%组患者9例,发生1—2级irAEs的患者有4例(占44.44%),发生3—4级irAEs的患者有5例(占55.56%)。χ2检验结果显示,两组发生1—2级及3—4级irAEs患者的比例不同,差异有统计学意义(P=0.010),CD8+>35%组发生3—4级irAEs患者所占比例更高。

图4 发生1—2级irAEs与发生3—4级irAEs的患者治疗前CD8+水平cut-off值ROC曲线图Fig 4 ROC curve of cut-off value of CD8+ Levels in patients with grade 1-2 irAEs and patients with grade 3-4 irAEs before ICI treatment
3 讨论
既往研究结果显示,irAEs的发生与淋巴细胞数量有一定的相关性,尤其是2级及以上的irAEs[12];而且,严重irAEs患者与轻度irAEs患者之间的外周T细胞水平存在差异[13]。但T淋巴细胞亚群的相关性仍需要进一步探索。提高肿瘤微环境中CD8+T淋巴细胞水平有助于提高抗肿瘤免疫治疗的疗效[14]。关于CD8+T淋巴细胞,既往已有多项小样本研究结果证实其与irAEs的发生、发展存在关系。Damo等[15]对2例皮肤地衣样irAEs患者皮肤活检的转录组学分析结果显示,在病变和非病变皮肤中都存在克隆扩张的效应CD8+T淋巴细胞。Lechner等[16]获得了免疫相关性甲状腺炎的甲状腺标本,发现在白细胞介素21存在的情况下,CD8+T淋巴细胞通过细胞毒性分子γ干扰素和颗粒酶B的上调,增加了CXC趋化因子受体6的表达和甲状腺毒性能力。Zhu等[17]发现,CD8+T淋巴细胞在免疫相关性心肌炎患者的血液中显著增加,而这些细胞在糖皮质激素治疗2个月后几乎消失。上述研究结果均提示,CD8+T淋巴细胞与irAEs之间可能存在密切的联系。Zhang等[18]的研究指出,发生irAEs时,患者铁蛋白水平的中位数明显高于治疗前,提示铁蛋白可作为使用ICI治疗的患者发生irAEs的诊断标志,过量的铁蛋白会影响T淋巴细胞亚群的分布,会降低CD4+T淋巴细胞的数量和活性,并增加CD8+T淋巴细胞的数量和活性。
本研究中发现,ICI治疗前的CD8+水平与3—4级irAEs有相关性,与上述既往研究得出的结论似乎有一定程度的吻合,发生3—4级irAEs的患者ICI治疗前的CD8+水平明显高于发生1—2级irAEs的患者。通过AUC曲线确认35%为cut-off值,可能是由于样本量小的关系导致较宽泛的置信区间,未来需要更大样本量的计算增加可信性。随后使用χ2检验进一步验证,发现CD8+>35%组中发生3—4级irAEs的患者所占比例增加,说明在使用ICI前,应检测CD8+水平,若>35%,提示未来发生3—4级irAEs的可能性升高。而发生irAEs时,发生3—4级irAEs患者与发生1—2级irAEs患者之间CD8+水平的差异无统计学意义(P=0.071 6),但3—4级irAEs患者较1—2级irAEs患者发生irAEs时的CD8+水平有一定的升高趋势。本研究的发现提示,未来CD8+T淋巴细胞或可作为irAEs药物治疗的切入点,以减少ICI治疗的患者出现高级别的严重irAEs。Zhang等[19]通过分析美国食品药品监督管理局不良事件报告系统和癌症基因组图谱多组学数据,发现通过树突状细胞、TMB结合CD4+T淋巴细胞丰度可以提高irAEs预测的准确性。根据本研究的结果,发生irAEs时患者CD4+、CD8+水平与ICI治疗前的差异无统计学意义(P>0.05),因此,动态监测CD4+、CD8+水平并不能起到提示irAEs发生、发展趋势的作用,提示可能需要与其他可能影响irAEs的因素进行联合分析。
此外,Zhang等[18]的研究评估了irAEs患者的治疗效果,治疗有效患者的铁蛋白水平持续降至正常范围,疾病稳定的患者无明显变化,死亡患者的铁蛋白水平持续升高,提示铁蛋白可作为irAEs的预后标志。本研究拟根据irAEs治疗后的转归,分为结局好转、稳定和恶化三组进行探索性分析,比较各组患者CD4+、CD8+水平在治疗前和发生irAEs时的区别。但由于本研究为回顾性研究,统计发现恶化组仅3例患者,样本量过低,无法进行有效的统计学分析,同时大部分患者缺失发生irAEs后CD4+、CD8+连续多次动态监测数据,因此无法判断CD4+、CD8+水平是否会提示ICI治疗患者irAEs的预后,需要大样本量、前瞻性随机对照、多中心的深入研究进一步探索。
综上所述,实体瘤患者使用ICI治疗前外周血中CD8+水平与irAEs的严重程度具有相关性,当CD8+>35%时,提示未来发生3—4级irAEs的可能性增加。发生3—4级irAEs的患者治疗前CD8+水平升高的机制有待进一步研究。
[致谢:本研究由国家自然科学基金项目(No.81974361)资助,感谢我院所有参与此项研究的肿瘤科成员]
(利益冲突声明:作者声明不存在利益冲突)

