TACE联合射频消融术与卡瑞利珠单抗治疗原发性肝癌的临床疗效及预后研究Δ
陈晓丽,付彦爽,付彦青(1.衡水市第三人民医院消化二科,河北 衡水 05000; .衡水市第三人民医院内二科,河北 衡水 05000; .衡水市第六人民医院内一科,河北 衡水 05000)
作为肝癌高发国家,我国肝癌患者占全球肝癌患者的40%~45%,且每年因肝癌而死亡的人数达到20余万[1]。经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)将药物注入肿瘤供血动脉,使肿瘤细胞缺血缺氧坏死[2]。然而,由于TACE栓塞不完全、侧支循环建立、促血管生长因子高表达等因素,可能导致肿瘤易出现复发或者转移。射频消融治疗作为热消融治疗手段在临床应用广泛,现阶段TACE联合射频消融术已成为肝癌介入治疗的新模式之一[3]。原发性肝癌患者早期症状不明显,确诊时常已失去最佳根治性治疗机会。近年来,肿瘤免疫治疗领域中免疫检查点抑制剂的研究得到了重大突破,该类药物通过靶向作用于T细胞、肿瘤细胞表达检查点分子,激活机体免疫抗肿瘤效应。卡瑞利珠单抗可阻断程序性死亡受体1(PD-1)通路,可提高机体抗肿瘤免疫力,并已获批作为二线单药应用于晚期肝癌[4]。本研究探讨了TACE联合射频消融术与卡瑞利珠单抗治疗原发性肝癌的临床疗效及预后,旨在为临床疾病治疗提供参考,报告如下。
1 资料与方法
1.1 资料来源
回顾性分析2017年3月至2019年8月衡水市第三人民医院收治的102例原发性肝癌患者的临床资料。纳入标准:符合《中国常见恶性肿瘤诊治规范》[5]中肝癌的诊断标准;巴塞罗那(BCLC)分期为B或C期;Child-Pugh分级为A或B级;美国东部肿瘤协作组(ECOG)体能状态评分为0~1分;临床资料完整。排除标准:淋巴结或肝外转移者;合并其他器质功能严重不全者;合并免疫缺陷疾病者;合并凝血功能相关疾病者;门静脉主干癌栓完全栓塞且不能有效纠正者;甲状腺功能异常者;伴感染、腹腔大量积液和肝性脑病者。依照治疗方式的不同,将采用TACE联合射频消融术与卡瑞利珠单抗治疗的51例患者纳入A组,将采用TACE联合射频消融术治疗的51例患者纳入B组,两组患者一般资料具有可比性,见表1。
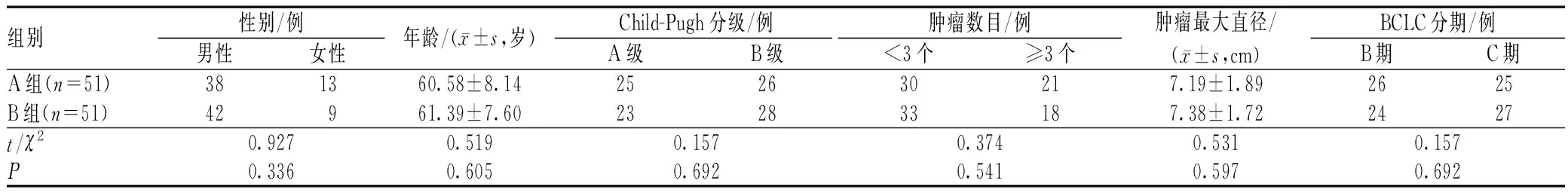
表1 两组患者一般资料比较Tab 1 Comparison of general information between two groups
1.2 方法
B组患者接受TACE联合射频消融术治疗。(1)TACE:局部浸润麻醉(1%利多卡因),股动脉穿刺,置入5F-RH导管,明确供血靶动脉,注入卡铂、多柔比星和丝裂霉素,剂量分别为200~300、20~60和10~20 mg;将40%碘化油与丝裂霉素制成乳剂,加入适量利多卡因,选择性、超选择性栓塞供血动脉,血供极丰富或肝动脉-门静脉瘘者,可给予明胶海绵强化栓塞效果。若病灶较多或存在多个供血动脉,则分别找出供血血管,超选择插管栓塞。造影结果显示病灶区碘油的存积状态良好则代表充填完全,血供阻断理想,拔出导管及血管鞘,压迫止血,加压包扎。接受TACE治疗1~3个周期,每次间隔时间为1个月,经影像学复查有明确残留活性病灶行射频消融术治疗。(2)射频消融术:行TACE治疗后2周,再行射频消融术治疗,每次间隔时间为1个月,超声引导下穿刺,消融布针及点数根据病灶大小确定。功率初始值为50 W,每1 min增加10~100 W,当阻抗升高显著、输出功率不足10 W时,该点位热凝完成,覆盖肿瘤全部,并超出周围0.5 cm以上的正常肝组织,完成后进行针道凝血。治疗后30 min行超声造影,六氟化硫微泡为造影剂,溶解于5 mL的0.9%氯化钠注射液,制备为8 μg/mL造影剂混悬液,注入肘浅静脉,明确完全消融后,结束治疗。
A组患者在B组的基础上加用注射用卡瑞利珠单抗(规格:200 mg),1次200 mg,静脉注射,3周1次,以3周为1个治疗周期,治疗6个月。
1.3 观察指标
(1)血清肿瘤标志物水平,包括癌抗原199(CA199)、甲胎蛋白(AFP)和癌胚抗原(CEA)。(2)血清肝功能指标水平,包括天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)和总胆红素(TBIL)。(3)T淋巴细胞亚群(CD4+CD25+FOXP3+Treg、CD4+和CD8+)比率。(4)比较两组患者治疗期间并发症发生率,包括腹泻、发热、高血压、蛋白尿、手足综合征、反应性毛细血管增生症(PCCEP)和血小板减少等。(5)评估两组患者2年无进展生存率和总生存率,从接受治疗开始计算,随访2年。总生存率从患者接受治疗开始计算,到死亡或最后随访时间结束,计算生存率。无进展生存率从接受治疗开始,到疾病进展或最后随访时间结束,计算无进展生存率。疾病进展定义为消融或免疫抑制治疗开始后,未处理肝或肝外区域有新的肝细胞癌出现,消融区或其他部位出现肿瘤增殖与转移。
1.4 疗效评定标准
参照《实体肿瘤近期疗效的分级标准》[6]评定疗效:完全缓解(CR),原始病灶消失,无新病变,持续1个月以上;部分缓解(PR),原始病灶大小(两径乘积)缩小≥50%,持续1个月以上;稳定(SD),原始病灶大小缩小<50%或增大≤25%,无新病灶;进展(PR),有新病灶出现,或者原始病灶大小增长>25%。有效率=(CR病例数+PR病例数)/总病例数×100%。
1.5 统计学方法
采用SPSS 25.0软件进行分析,计数资料组间比较采用χ2检验,计量资料组间采用t检验,生存曲线通过Kaplan-Meier法绘制,组间以Log-rank检验比较,P<0.05为差异有统计学意义。
2 结果
2.1 治疗情况及临床疗效比较
A组患者共接受TACE治疗104次,平均(2.04±0.32)次;共接受射频消融术治疗84次,平均(1.65±0.41)次;B组患者共接受TACE治疗107次,平均(2.10±0.34)次;共接受射频消融治疗88次,平均(1.73±0.40)次。两组患者TACE治疗次数、射频消融治疗次数比较,差异均无统计学意义(P>0.05)。A组患者临床治疗有效率为90.20%(46/51),高于B组的74.51%(38/51),差异有统计学意义(χ2=4.317,P=0.038),见表2。

表2 两组患者临床疗效比较Tab 2 Comparison of clinical efficacy between two groups
2.2 血清肿瘤标志物水平比较
两组患者治疗前血清肿瘤标志物水平比较,差异均无统计学意义(P>0.05);两组患者治疗后血清AFP、CA199和CEA水平均较治疗前降低,且A组患者低于B组,差异均有统计学意义(P<0.05),见表3。

表3 两组患者治疗前后血清肿瘤标志物水平比较Tab 3 Comparison of serum tumor markers levels between two groups before and after treatment
2.3 T淋巴细胞水平比较
两组患者治疗前T淋巴细胞水平比较,差异均无统计学意义(P>0.05)。治疗后,两组患者外周血CD4+、CD4+/CD8+水平较治疗前降低,且B组低于A组;外周血CD4+CD25+FOXP3+Treg、CD8+水平较治疗前升高,且B组高于A组,差异均有统计学意义(P<0.05),见表4。

表4 两组患者治疗前后T淋巴细胞水平比较Tab 4 Comparison of T lymphocytes levels between two groups before and after treatment
2.4 肝功能指标水平比较
两组患者治疗前及治疗后的ALT、AST和TBIL水平比较,差异均无统计学意义(P>0.05),见表5。

表5 两组患者治疗前后肝功能指标水平比较Tab 5 Comparison of liver function indicators between two groups before and after treatment
2.5 并发症发生情况比较
两组患者发热、腹泻、高血压、手足综合征和蛋白尿的发生率比较,差异均无统计学意义(P>0.05);A组患者PCCEP、血小板减少的发生率高于B组,差异均有统计学意义(P<0.05),见表6。
2.6 预后生存情况比较
A组患者的2年总生存率为72.55%(37/51),无进展生存率为64.71%(33/51);B组的2年总生存率为66.67%(34/51),无进展生存率为60.78%(31/51);两组患者的2年无进展生存率、总生存率比较,差异均无统计学意义(P>0.05),见图1—2。
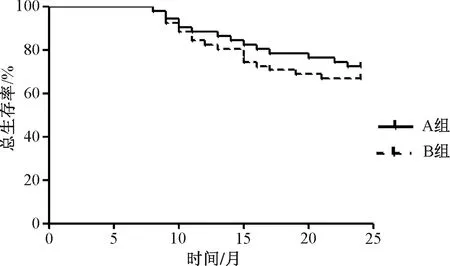
图1 两组患者2年总生存情况分析Fig 1 Analysis of 2-year overall survival of both groups
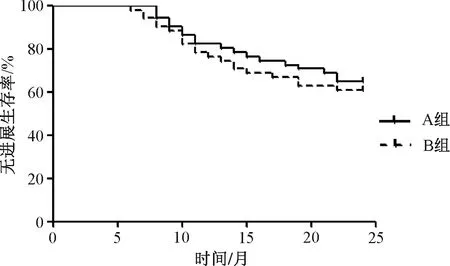
图2 两组患者2年无进展生存情况分析Fig 2 Analysis of 2-year progression-free survival of both groups
3 讨论
原发性肝癌统指起源于肝细胞和肝内胆管上皮细胞的恶性肿瘤,其中以肝细胞癌和肝内胆管癌最为常见[7]。原发性肝癌多呈现隐匿、多中心、多结节生长,患者常合并各类慢性肝脏疾病,如肝硬化等,或伴门脉高压等并发症,肿瘤较大且存在肝内或肝外转移。
美国肝病学会肝癌诊治指南指出,TACE是临床无法接受根治性手术的原发性肝癌患者的一线治疗方法[8]。然而,由于肿瘤的供血动脉较为复杂,单纯TACE治疗的远期疗效并不十分理想,尤其是肿瘤较大者,残癌组织的存在易导致复发、转移[9]。射频消融治疗通过热消融效应使肝脏肿瘤细胞坏死,但其应用效果与肿瘤大小、位置和血液循环等关系密切,已有研究结果证实,对于小肝癌射频消融治疗的远期疗效与肝切除相当,但对于>5 cm的肿瘤,单纯射频消融治疗不能达到根治性治疗效果,易遗漏小卫星病灶导致复发[10]。TACE结合射频消融术,二者联合可在一定程度上形成优势互补,产生协同增效效应,用于肝癌治疗,可提高疗效[11]。PD-1与程序性死亡受体配体1(PD-L1)属于重要免疫抑制分子,可下调机体免疫应答,在一定程度上阻碍机体免疫对肿瘤细胞的干预作用[12-13]。卡瑞利珠单抗由我国自主研发,作为PD-1阻断剂可阻碍PD-1与受体结合,从而阻断PD-1/PD-L1通路,达到肿瘤免疫治疗的目的[14]。本研究将TACE联合射频消融术与卡瑞利珠单抗应用于原发性肝癌的治疗,取得了良好的效果。
本研究结果显示,治疗后,A组患者临床治疗有效率高于B组,提示在TACE与射频消融术的基础上联合应用卡瑞利珠单抗可进一步提高临床疗效。AFP为临床肝癌常用检测指标,人体血清AFP含量极低,但肝癌发生后AFP表达明显升高,且其表达与肿瘤生物学特性、分化程度等相关,也是病情变化、疗效评估的敏感指标[15]。杨秋雨等[16]研究结果显示,将卡瑞利珠单抗用于TACE治疗的肝癌患者,可有效提高患者AFP转阴率。本研究结果也显示,A组患者治疗后血清AFP水平低于B组,与上述研究结果一致。此外,本研究结果显示,治疗后,A组患者血清CEA、CA199水平低于B组。CEA是一种广谱肿瘤标志物,为肿瘤细胞表面多糖蛋白复合物,在肝癌患者中呈现高表达水平;CA199是消化系统肿瘤细胞产生的一种抗原,在肝癌治疗监测中也具有一定作用。上述结果进一步表明,卡瑞利珠单抗的应用有利于降低原发性肝癌患者血清肿瘤标志物水平,提高临床疗效。卡瑞利珠单抗是亲和力强的单克隆抗体,具有人源化、选择性的特点,可与B淋巴细胞、自然杀伤细胞和T细胞等表面PD-1结合,阻断其与肿瘤细胞、肿瘤浸润性淋巴细胞与树突细胞等表面存在的相互作用,解除PD-1通路介导的T淋巴细胞免疫抑制,增强肿瘤细胞杀灭功能,促进免疫监测体系重建,发挥抗肿瘤效应[17]。
T淋巴细胞亚群为机体免疫重要构成部分,CD4+为辅助性T细胞,在免疫应答中具有正向调节作用,可增强机体抗肿瘤效应;而CD8+为抑制性T细胞,在免疫应答中具有负向调节作用。CD4+CD25+Treg为调节性T细胞,多项临床研究结果显示,CD4+CD25+Treg细胞与肿瘤免疫抑制相关,CD4+CD25+Treg占比升高可抑制抗肿瘤免疫应答[18]。FOXP3为调节性T细胞特异标志物,肿瘤细胞可在一定程度上促使幼稚T细胞向FOXP3+Treg转变,致使调节性T细胞蓄积,阻碍肿瘤免疫监视。本研究结果显示,原发性肝癌患者使用TACE联合射频消融术治疗后,外周血CD8+水平升高,CD4+、CD4+/CD8+水平降低,同时CD4+CD25+FOXP3+Treg水平升高;但A组患者治疗后外周血CD4+、CD4+/CD8+水平高于B组,外周血CD4+CD25+FOXP3+Treg、CD8+水平低于B组。提示TACE联合射频消融术可在一定程度上损伤机体正常免疫,加重免疫紊乱,使残存肿瘤细胞免疫逃逸,导致肿瘤复发;而联合应用卡瑞利珠单抗能明显抑制CD8+表达,促进CD4+、CD4+/CD8+水平升高,同时降低外周血CD4+CD25+FOXP3+Treg细胞成分。可见卡瑞利珠单抗在细胞免疫改善方面具有明显优势,卡瑞利珠单抗可与PD-1靶向结合,活化机体淋巴细胞,借助免疫功能重建产生抗肿瘤效应,抑制肿瘤生长。本研究中,两组患者治疗后肝功能指标ALT、AST和TBIL水平均较治疗前升高,且A组与B组的差异无统计学意义(P>0.05)。提示TACE联合射频消融术会对患者肝细胞带来一定程度的损伤,导致患者肝功能降低,联合应用卡瑞利珠单抗未导致这一损害加重。
陈烁等[19]的研究结果显示,作为免疫检查点抑制剂,卡瑞利珠单抗可导致机体免疫激活过度,引起免疫相关不良反应。本研究对比了两组患者不良反应发生情况,结果显示,A组患者的PCCEP发生率高于B组。PCCEP为卡瑞利珠单抗高发的不良反应,卡瑞利珠单抗的应用在有效逆转机体免疫抑制的同时也在一定程度上导致血管内皮生成因子表达失衡,导致PCCEP发生。但本研究中两组患者治疗过程中出现的均为Ⅰ级不良反应,未影响治疗进程。此外,本研究结果显示,A组患者的血小板减少发生率也在一定程度上高于B组,但不良反应大多轻微,耐受性良好,不影响治疗。随访发现,两组患者2年无进展生存率、总生存率的差异均无统计学意义(P>0.05)。这可能是由于本研究纳入样本量有限,导致结果存在一定的偏倚性,后续可扩大样本量进一步研究。
综上所述,在TACE联合射频消融术的基础上加用卡瑞利珠单抗治疗,可有效抑制原发性肝癌患者肿瘤标志物表达,促进患者自身免疫功能重建,提高临床疗效。但值得注意的是,卡瑞利珠单抗的使用也在一定程度上增加了不良反应发生风险。

