Bacillus sp.AFJ-3产T-2毒素降解酶发酵工艺优化
■ 马 妍 刘虎军 王 峻 杜 稳 孙长坡 周文化 赵一凡*
(1.中南林业科技大学食品科学与工程学院,湖南长沙 410000;2.国家粮食和物资储备局科学研究院,北京 100037)
T-2 毒素是由拟枝孢镰刀菌、枝孢镰刀菌和三线镰刀菌等产生的有毒次级代谢产物,属于毒性最强的A 类单端孢霉烯族毒素[1-2]。研究表明,低剂量的T-2毒素能引起人畜呕吐、腹泻、食欲下降、内分泌紊乱和免疫系统失调等,达到一定剂量后会导致休克甚至死亡[3-4];在细胞水平,T-2 毒素的毒性作用表现为抑制蛋白质合成,从而导致DNA 和RNA 合成受阻[5]。T-2毒素通常存在于谷物和动物饲料中,尤其是燕麦及燕麦产品[6],广泛污染全球农作物[7-9],造成了巨大的经济损失。因此,如何高效地降低T-2 毒素的危害,成为了目前粮食、饲料行业亟待解决的关键问题。
T-2 毒素脱毒方式包括物理、化学和生物法三大类。传统的物理、化学法存在脱毒效果不彻底、感官品质降低、营养物质损失等局限性[10]。近年来,生物法因其高效、安全、专一、无污染的特点,成为了当前最具前景的T-2 毒素脱毒方法[11]。生物法包括吸附和降解两条途径,其中生物降解法是利用微生物代谢产生的酶将毒素转化为低毒或无毒的产物。目前从土壤或水域中发现了短小杆菌[12]、氧化微杆菌[13]、黑曲霉[14]、弯曲假单胞菌[15]、芽生杆菌等[16]微生物能够降解T-2 毒素。然而从自然环境中获得的微生物产酶量少,不利于T-2 毒素降解酶的分离纯化,也无法满足酶制剂的工业化生产需求。而微生物产酶水平与发酵工艺密切相关,其中培养基组成、pH、温度、接种量等多个因素均对微生物产酶具有重要影响[17]。现已有研究者通过响应面法、正交试验、均匀设计和神经网络等方法优化微生物发酵产酶的条件。赵一凡等[18]利用正交试验结合人工神经网络优化了毕赤酵母产伏马毒素羧酸酯酶的发酵条件和培养基,优化后酶活提高了1.19 倍;杨文华等[19]和戴军等[20]通过响应面法优化了施氏假单胞菌和中华假单胞菌产黄曲霉毒素B1(AFB1)降解酶的发酵条件,酶活力较优化前分别提高了28.99%和25.54%。但目前还未有利用响应面法优化微生物发酵产T-2 毒素降解酶的相关报道。
本团队前期从小麦中筛选获得一株T-2 毒素降解菌株Bacillussp.AFJ-3,已证实其胞内酶对T-2 毒素具有降解效果[21]。在此基础上,本研究通过单因素试验、Plackett-Burman(PB)试验和响应面设计对该菌株的发酵条件和培养基进行优化,以期提高T-2 毒素降解酶的产量,为该酶后期的分离纯化与酶制剂的工业化生产提供研究基础。
1 材料与方法
1.1 材料
1.1.1 菌株来源
T-2 毒素降解菌Bacillussp.AFJ-3,由国家粮食和物资储备局科学研究院粮油加工所粮油真菌毒素防控实验室筛选与保藏。
1.1.2 试剂与仪器
T-2 毒素标准品,购自北京普瑞邦科技有限公司;酵母提取物、胰蛋白胨、乙腈(色谱级),购自赛默飞世尔科技有限公司;NaCl,购自上海麦克林生化科技有限公司;KCl、NaH2PO4·12H2O、KH2PO4,购自国药集团。
Multitron Cell精密振荡培养箱,购自瑞士Infors公司;Centrifuge 5810R型高速冷冻离心机,购自德国Eppendorf 公司;e2695 型高效液相色谱仪、2475 型荧光检测器、XBridge C18色谱柱(250 mm×4.6 mm,5 μm),购自美国Waters 公司;真空离心浓缩仪,购自美国LABCONCO 公司;多参数测试仪S400-K,购自瑞士Mettler Toledo 公司;GT100 球磨机,购自长沙市德科仪器设备有限公司;G8080 玻璃珠,购自北京索莱宝科技有限公司。
1.1.3 培养基与溶液
LB 培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L;固体培养基加20 g/L琼脂。
磷酸盐(PBS)缓冲液:氯化钠8 g/L,氯化钾0.2 g/L,十二水磷酸二氢钠3.63 g/L,磷酸二氢钾0.24 g/L,pH 7.4。
T-2毒素标准液:2 mg T-2毒素标准品溶于100 mL乙腈(色谱级)。
1.2 方法
1.2.1 菌株培养
种子活化:取保存于-20 ℃甘油管中的菌液划线于LB固体培养基,37 ℃培养12~24 h。
种子培养:挑取单菌落接种于30 mL LB 液体培养基中,37 ℃、200 r/min培养12 h。
发酵培养:按1%的接种量,将种子培养液接种于30 mL 发酵培养基中,于初始pH 7、37 ℃、200 r/min条件下摇瓶发酵培养。
1.2.2 T-2毒素HPLC检测
T-2 毒素HPLC 检测方法参照GB 5009.118—2016《食品安全国家标准 食品中T-2毒素的测定》。
1.2.3 T-2毒素降解酶酶活力测定
粗酶液制备:取5 mL 发酵菌液,5 000 r/min 离心5 min,菌体用PBS缓冲液洗涤后用1 mL PBS缓冲液重悬,菌悬液中加入0.5 g玻璃珠,在球磨仪中振荡10 min进行细胞破碎,4 ℃,12 000 r/min离心10 min,上清液即为粗酶液。
酶反应:取适量T-2 毒素标准液至离心管,于真空离心浓缩仪中旋蒸制成T-2毒素管。粗酶液50 μL与450 μL PBS 缓冲液在毒素管中混匀,37 ℃、pH 7条件下振荡反应30 min,加入500 μL 乙腈终止反应,T-2 毒素终浓度3 μg/mL,等量的PBS 缓冲液作为空白对照;取100 μL 反应液于真空离心浓缩仪蒸干,衍生,HPLC测定酶活力。
酶活力定义:在37 ℃,pH 7条件下,每1 min降解1 ng T-2毒素所需酶量定义为一个酶活力单位(U)。
1.2.4 单因素试验
① 最佳产酶时间:取Bacillussp.AFJ-3 的种子培养液,接入30 mL LB 培养基进行发酵培养,不同时间取样,在600 nm 波长下测定吸光度,同时HPLC 检测酶活力。以培养时间为横坐标,OD600值和酶活力为纵坐标绘制生长曲线和产酶曲线。
② 最适培养基:以LB培养基为基础,使用无水葡萄糖、可溶性淀粉、蔗糖、麦芽糖、玉米糊精、甘油、糖蜜替换酵母提取物,添加量5 g/L;使用蛋白胨、玉米浆、牛肉膏、硫酸铵、大豆蛋白胨、黄豆饼粉替换胰蛋白胨,添加量10 g/L;使用KH2PO4、K2HPO4·3H2O、Na2HPO4·12H2O、MgSO4·7H2O、CaSO4、CaCO3、CaCl2替换NaCl,添加量10 g/L。发酵培养12 h,取样测定酶活力。
③ 最适培养基添加量:确定培养基种类的基础上,分别添加1、5、10、15、20 g/L 碳源,5、10、15、20、25 g/L 氮源,5、10、15、20、25 g/L 无机盐。发酵培养12 h,取样测定酶活力。
④ 最适培养条件:以LB 培养基为基础,分别调整初始pH 为4、5、6、7、8;摇床温度为25、29、33、37、41 ℃;接种量为0.25%、0.5%、1.0%、2.0%、3%、4.0%、5.0%;摇床转速为140、160、180、200、220、240 r/min。发酵培养12 h,取样测定酶活力。
1.2.5 Plackett-Burman试验
在单因素试验基础上,选择6 个因素作为变量,各取2 个水平,选择3 组空白项,以酶活力(Y)为响应值,使用Design Expert 8.0.6 软件设计PB 试验并进行结果分析。各因素与水平设置见表1。

表1 Plackett-Burman试验设计因素与水平表
1.2.6 Box-Behnken试验
根据单因素试验和PB 试验结果,选择MgSO4·7H2O浓度、pH和温度三个因素作为自变量,以酶活力(Y)为响应值,利用Design Expert 8.0.6 软件进行Box-Behnken 试验设计与结果分析,并对获得的最优产酶条件进行发酵验证。各因素和水平如表2所示。

表2 Box-Behnken试验设计因素与水平
1.2.7 数据处理与分析
所有试验均重复3 次,结果用“平均值±标准差”表示。采用SPSS 22.0 和Origin 2018 软件进行数据统计分析和图表绘制,选择Duncan’s 法进行显著性分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 单因素试验
2.1.1 最佳产酶时间
Bacillussp.AFJ-3 经活化后,按1%接种量接种至30 mL LB 培养基中,菌体的生长与产酶曲线如图1所示,酶的生物合成与细胞生长同步进行。菌体生长从4 h 开始进入对数期,快速繁殖产生大量T-2 毒素降解酶,酶活力迅速升高;在10~12 h 时,菌体生长进入稳定期,12 h 时酶活力达到最大值1 136.19 U/mL;12 h 之后进入生长凋亡期,产酶量减少,酶活力呈现下降趋势,故选择12 h作为后续优化培养时间。

图1 菌体生长与产酶曲线
2.1.2 最适碳源及添加量
碳源为微生物的基本构成与代谢产物的合成提供碳骨架,同时为细胞生命活动提供所需能量[22]。如图2(a)所示,不同碳源对酶活力的影响较为显著(P<0.05)。当碳源为酵母提取物时酶活力最高(1 083.38 U/mL),而可溶性淀粉、蔗糖、玉米糊精和甘油不利于Bacillussp.AFJ-3 产酶。可能是因为酵母提取物中含有丰富的碳水化合物、蛋白质、核苷酸、生长因子和微量元素等有助于微生物生长,某些酵母提取物还含有诱导因子能够引起蛋白质的大量表达[23]。因此选择酵母提取物作为最适碳源进行后续研究。
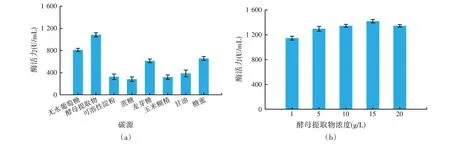
图2 碳源对酶活力的影响
进一步考察酵母提取物的最适添加量,结果见图2(b)。酶活力随着其浓度的增加逐渐升高,当浓度为15 g/L 时酶活力最大,继续提高其浓度,酶活力开始下降。同时考虑到发酵生产成本,当浓度为10 g/L 和15 g/L 酶活力相差不大,故选择10 g/L 作为酵母提取物的最适添加量进行后续优化。
2.1.3 最适氮源及添加量
氮源主要用于构成菌体细胞物质(氨基酸、蛋白质、核酸等)和含氮代谢物[24]。不同氮源对酶活力的影响如图3(a)所示,相较于无机氮源(硫酸铵),有机氮源更适合Bacillussp.AFJ-3 的生长产酶,可能是因为其含多种小分子肽有助于菌体吸收利用。当氮源为黄豆饼粉时酶活力最高(1 296.77 U/mL)。史翠娟[25]研究表明,豆制品中含有完全蛋白、糖、维生素与矿物质,是工业生产芽孢杆菌及其代谢产物的优质培养基。此外,黄豆饼粉价格低廉,有利于降低发酵成本。故选择黄豆饼粉作为最适氮源进行后续优化。

图3 氮源对酶活力的影响
进一步探究黄豆饼粉添加量对酶活力的影响,结果见图3(b)。随着黄豆饼粉浓度的提高,酶活力变化不显著(P>0.05),当浓度为15 g/L 时酶活力最高,超过15 g/L 后酶活力开始下降,推测原因可能是破坏了培养基的最适碳氮比。考虑生产应用的经济成本,选取10 g/L作为黄豆饼粉添加量进行后续优化。
2.1.4 最适无机盐及添加量
无机盐不仅参与构成微生物细胞和酶的组成成分,还具有维持渗透压和pH 稳定的作用[22]。如图4(a)所示,不同无机盐对酶活力的影响较为显著(P<0.05)。当 无 机 盐 为MgSO4·7H2O 时,酶 活 力 最 高(1 247.06 U/mL),这可能是因为Mg2+能作为激活剂促进降解酶的合成[20]。周雨亭[26]发现Mg2+能够显著提高贝莱斯芽孢杆菌的纤溶酶活性;冒鑫哲等[27]研究表明添加Mg2+促进了枯草芽孢杆菌中角蛋白酶的合成与分泌。由此推断,Mg2+可能对大多数芽孢杆菌产酶具有促进作用。因此选择MgSO4·7H2O作为最适无机盐。

图4 无机盐对酶活力的影响
MgSO4·7H2O 浓度对酶活力的影响如图4(b)所示,酶活力随着其浓度的增加而升高,当浓度为15 g/L时酶活力最高,超过15 g/L 之后酶活力开始下降,培养基中Mg2+浓度过高或过低均会抑制芽孢杆菌AFJ-3 的产酶能力,因此以15 g/L 为MgSO4·7H2O 的最适添加量进行后续优化。
2.1.5 最适培养条件
培养基pH是影响细胞生长、酶活力以及各种成分跨膜运输的关键环境参数[28]。初始pH 对酶活力的影响如图5(a)所示,pH在5~7范围内时酶活力较高,pH小于5时酶活力大幅降低,培养基过酸可能会使酶蛋白变性失活。当pH等于5时酶活力最高(1 207.40 U/mL),因此最适初始pH 为5,偏弱酸性和中性环境更适合T-2毒素降解酶的产生。

图5 不同发酵条件对酶活力的影响
温度影响酶的合成速率与代谢产物的稳定性[29]。不同温度对酶活力的影响如图5(b)所示,随着温度升高,酶活力呈现先升高后降低的趋势,说明低温不适合该菌的生长产酶,而温度过高则可能使酶变性失活。当温度为37 ℃时酶活力最高(1 083.85 U/mL),故选择37 ℃作为最适培养温度,该结果与大多数芽孢杆菌的最佳产酶温度一致[17,27,30]。
接种量影响微生物的生长规律及代谢产物的积累[31]。不同接种量对酶活力的影响如图5(c)所示,较小的接种量更适合Bacillussp.AFJ-3产酶,随着接种量的增大,酶活力略微升高后降低,接种量过高时发酵前期营养物质消耗过快,导致后期营养不足影响酶的产生[31]。当接种量为0.5%时酶活力最大(1 193.01 U/mL),因此选择0.5%作为最适接种量。
摇瓶转速影响培养基的溶氧量,进而影响微生物的生长情况[32]。不同转速对酶活力的影响如图5d所示,随着转速的升高,酶活力缓慢增大,当转速为200 r/min时酶活力最大(1 084.12 U/mL),超过200 r/min后酶活力开始下降,因此最适转速为200 r/min。转速低时溶氧量小,无法满足细胞生长需求;转速升高剪切力增大,会对菌体产生一定伤害[32]。
2.2 Plackett-Burman试验
根据单因素试验结果,通过PB试验筛选显著影响酶活力的关键因子,结果见表3。利用Design Expert 8.0.6 软件对表3 中的试验数据进行方差分析,结果如表4所示,模型是显著的(P=0.02<0.05),说明模型拟合较好。X3(MgSO4·7H2O)、X4(pH)、X6(温度)的P值小于0.05,表明对酶活力具有显著影响,因此选择这三个因素进行响应面试验设计。为降低发酵成本,对酶活力影响不显著的因素X1(酵母提取物)、X2(黄豆饼粉)的添加量均调整为5 g/L进行后续优化。

表3 Plackett-Burman试验结果
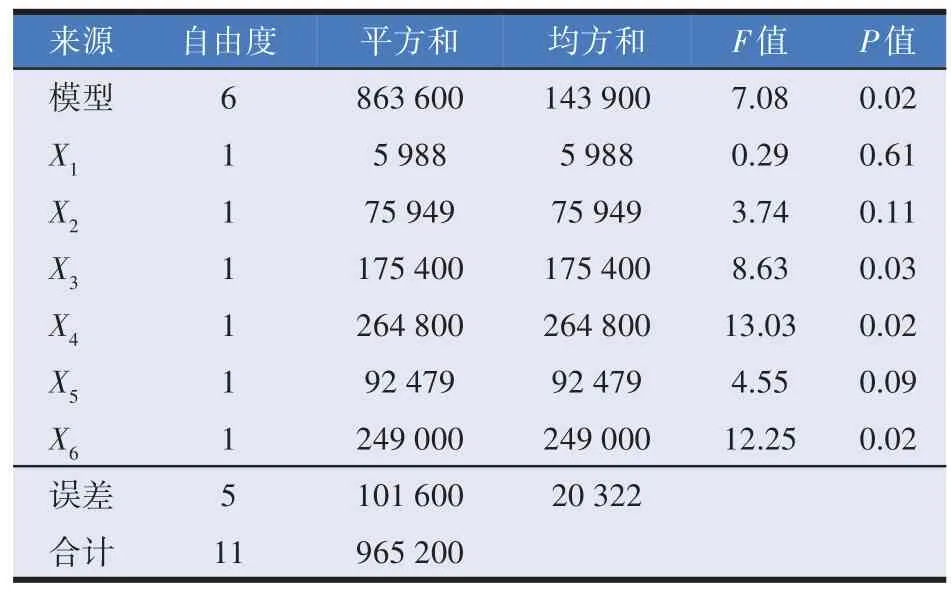
表4 Plackett-Burman试验方差分析
2.3 响应面分析
2.3.1 Box-Behnken试验结果与方差分析
将MgSO4·7H2O添加量(A)、pH(B)、温度(C)三个因素作为变量,以酶活力(Y)为响应值,进行Box-Behnken试验,结果如表5所示。通过软件Design Expert 8.0.6对上述数据进行多元回归拟合,得到二次回归方程。

表5 Box-Behnken试验结果
Y=1 662.77+41.87×A-55.90×B-31.13×C+5.67×AB+29.64×AC-44.35×BC-109.92×A2-119.83×B2-81.01×C2
对回归方程进行方差分析,结果见表6。模型极显著(P<0.01),失拟项不显著(P>0.05),决定系数R2为0.965 0,调整R2为0.920 1,以上数据说明模型拟合性较好,该模型能够解释数据的变化趋势。表中一次项系数A、B、C对酶活力影响极显著(P<0.01);交互项BC对酶活力影响显著(P<0.05),AB、AC不显著;二次项系数A2、B2、C2影响极显著(P<0.01)。基于以上分析,该模型与实际情况拟合较好,可用该模型对酶活力进行分析和预测。

表6 Box-Behnken试验方差分析
2.3.2 各因素交互作用分析
由回归方程得到的响应曲面图和等高线图如图6所示,反映了MgSO4·7H2O 浓度(A)、初始pH(B)和温度(C)两两之间的交互作用对酶活力的影响。响应曲面图均开口朝下,说明酶活力存在最大值。响应曲面坡度越陡,表明两因素交互作用对酶活力影响越大[29]。等高线呈椭圆形表示二者交互作用对酶活力影响显著,呈圆形则影响不显著[22]。
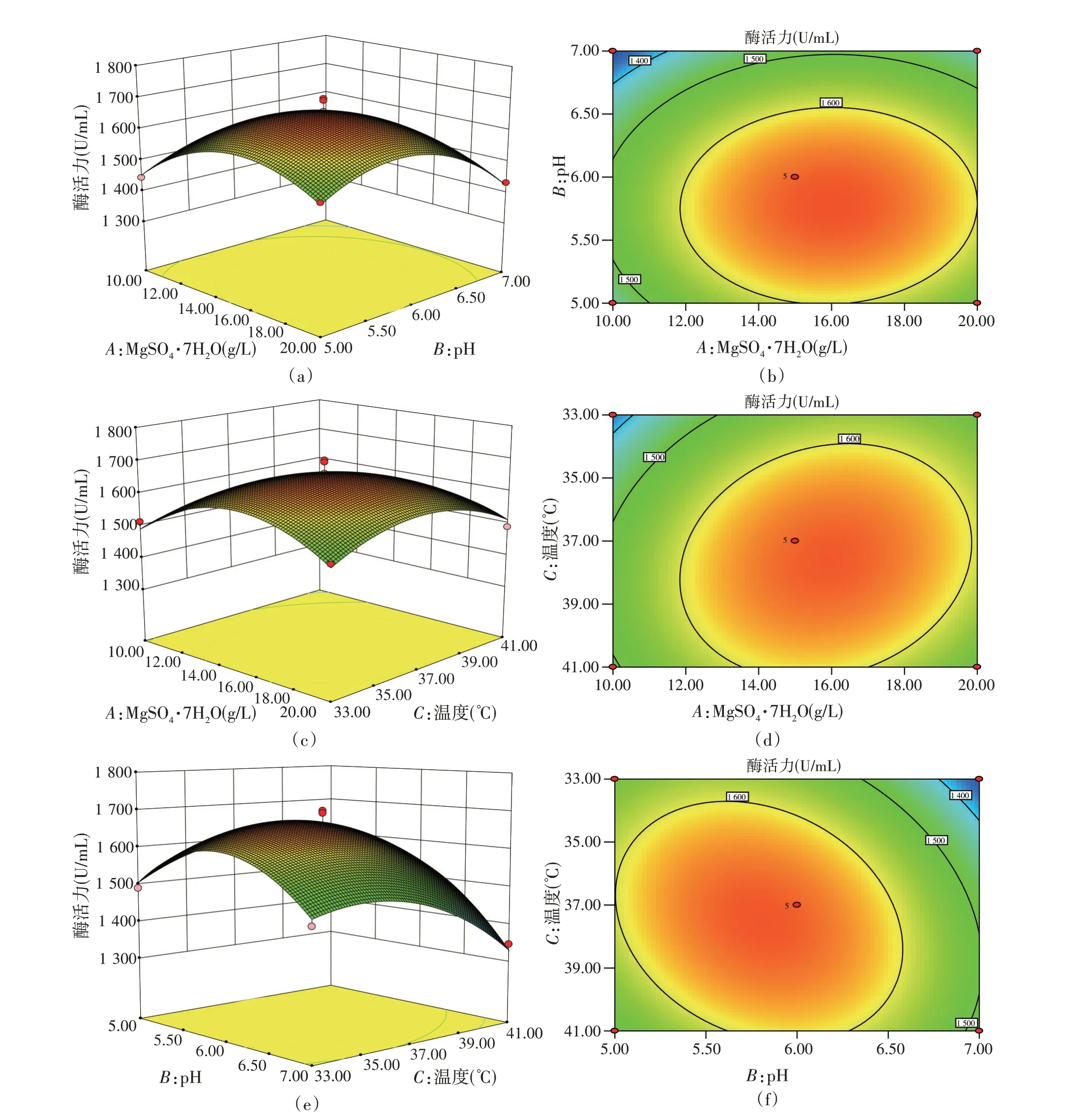
图6 各因素交互作用对酶活力的影响
MgSO4·7H2O 浓度和pH、温度交互的响应曲面坡度较平缓且等高线呈圆形(图6a、6b、6c、6d),温度和pH 交互作用的等高线呈椭圆形且响应曲面坡度较陡(图6e、6f),因此,3 组交互项对酶活力影响的显著性顺序为:BC>AC>AB,与方差分析结果一致。随着MgSO4·7H2O 浓度、pH 和温度的增大,酶活力均呈现先增大后下降的趋势,与单因素结果保持一致。
2.3.3 模型预测与验证
利用回归方程求得酶活力最高时各因素的最优值:MgSO4·7H2O 15.86 g/L,初始pH 5.79,反应温度36.59 ℃,在此条件下酶活力最大值为1 673.84 U/mL。考虑实际情况后作出适当调整:MgSO4·7H2O 16 g/L,初始pH 5.8,反应温度36.5 ℃。其余条件为酵母提取物5 g/L,黄豆饼粉5 g/L,接种量0.5%,转速200 r/min。使用上述参数,独立重复3 次试验,得到最大酶活力平均值1 674.68 U/mL,与模型预测值基本吻合,说明此模型可靠,能够有效预测T-2 毒素降解酶的酶活力。与初始酶活力(1 136.19 U/mL)相比,优化后酶活力提升了47.39%。
3 讨论
T-2 毒素具有高毒性和污染广泛性,给粮食与畜牧业造成了巨大的经济损失,严重威胁着人畜的健康和社会的发展。生物脱毒法因其高效、绿色、环保等优点而展现出强大优势,从自然环境中筛选降解微生物并挖掘其中的降解酶是当前研究的主要方向。而野生菌产酶水平低与酶活性不稳定等问题,限制了降解酶的分离纯化与酶制剂的开发应用。利用基因工程或发酵工程技术提高酶的产量和催化活性,使微生物中的降解酶能够进行大规模生产,真正地从“实验”走向“实际”,具有广阔的发展前景。
T-2 毒素降解酶的挖掘仍停留在初级阶段。吴娱[14]对黑曲霉中的T-2 降解酶进行分离纯化,仅推断出该酶分子量为50 ku 左右,此外,Mg2+能激活该酶的活性,这与本研究结果一致。向雨珂[13]对氧化微杆菌产生的T-2 毒素降解酶进行纯化,仅得出该酶能在pH=8.0、10.00%的盐浓度条件下,通过阴离子柱在AKTA 上被分离出来的结论。Ueno 等[12]、Beeton 等[16]、Fuchs 等[33]、施崎[15]发现了多种T-2 毒素降解微生物,但未对其产生的降解酶进行深入研究。本试验在获得T-2 毒素降解菌的基础上,通过优化其发酵工艺,成功地提高了T-2 毒素降解酶的产量。后续还将进行发酵罐放大优化,进一步提高其产量,为该酶的分离纯化提供一定技术支撑。
响应面法具有试验次数少、周期短、考虑多个因素交互作用的优点。迄今为止,该方法已成功应用于优化一系列微生物降解真菌毒素的研究中。熊科等[34]通过响应面法优化米曲霉降解赭曲霉毒素的条件,优化后降解率达94%,产酶周期缩短62.5%;张铭[35]利用该法建立了短黄杆菌3J2MO 降解花生粕中黄曲霉毒素固态发酵的工艺条件;孙标等[36]通过该法使枯草芽孢杆菌QR-015 对黄曲霉毒素B1 的降解率提升至97.5%。本试验同样通过该法使T-2毒素降解酶酶活力提升了47.39%,进一步证明利用响应面法优化微生物产真菌毒素降解酶是一种科学合理、行之有效的优化方法。
4 结论
本研究对Bacillussp.AFJ-3 产T-2 毒素降解酶的发酵工艺进行优化,以酶活力为考察指标,首先通过单因素试验确定了最适碳源、氮源、无机盐、初始pH、温度、接种量和转速;再利用Plackett-Burman 试验筛选出MgSO4·7H2O浓度、初始pH和温度三个因素对酶活力影响显著(P<0.05);最后通过响应面设计确定了最佳产酶条件为:酵母提取物5 g/L,MgSO4·7H2O 16 g/L,黄豆饼粉5 g/L,初始pH 5.8,温度36.5 ℃,接种量0.5%,转速200 r/min。在此条件下,酶活力达到最大值1 674.68 U/mL,较优化前提升47.39%,大幅提高了T-2 毒素降解酶的产量,并在一定程度上降低了发酵生产成本,对T-2 毒素脱毒酶制剂的开发应用具有重要借鉴意义。

