lncRNA Miat通过miR-182/Nogo-A调控氧化应激所致心肌细胞凋亡的机制
薄洪臣,谢鲁寒,刘赵放,韩冰洁,刘 珊,倪玮钰,李连宏
心血管疾病(cardiovascular disease, CVD)是我国国民死亡的主要原因之一[1],从2005年开始,急性心肌梗死的病死率呈快速上升趋势[2]。心肌梗死过程中的氧化应激是导致细胞凋亡的重要因素之一,氧化应激也成为医学界研究的重点问题。LncRNA被认为是可能解决众多医学难题的重要分子之一,2006年心肌梗死相关转录物Miat首次被鉴定为lncRNA,位于22号染色体[3]。miR-182是位于人类7号染色体,在进化上保守的一个miRNA,其在癌症、神经系统病变等多种疾病[4-5]的发病过程中具有重要的调控作用;miR-182在氧化应激和细胞凋亡进程中也发挥着重要作用;miR-182可以通过PI3K/Akt信号通路抑制白内障大鼠晶状体中的氧化应激和上皮细胞凋亡[6],且miR-182在大鼠心肌细胞可见表达[7],故假设其与氧化应激所致的心肌细胞凋亡相关机制有所关联。Nogo-A蛋白在阿尔兹海默病、癌症、视觉和眼部疾病等多种系统生理病理过程中发挥作用[8-10],其在神经系统氧化应激过程具有调控作用[11];Nogo-A在心肌细胞中也有表达,文献报道Nogo家族蛋白可作为心力衰竭的标志物[12]。本研究通过生物预测软件RNAhybrid预测Miat与miR-182之间,生物信息网站Targescan预测miR-182与Nogo-A之间存在结合位点,探究Miat通过miR-182调控Nogo-A的表达和机制,阐释了心肌梗死过程中因氧化应激所致的细胞凋亡的分子调控机制。
1 材料与方法
1.1 主要试剂与耗材DMEM高糖培养基(Gicbo公司),澳洲胎牛血清(FBS)(Gicbo公司),PBS缓冲液(Seven公司),兔抗Nogo-A、兔抗BCL-2抗体(Abclone公司),兔抗Bax抗体(Proteintech公司),兔抗Caspase-3、兔抗β-Tubulin抗体(Coolaber公司),兔荧光二抗、胰蛋白酶、si-RNA合成、miRNA mimics合成(上海吉玛公司),Hanks’Solution(Coolaber公司),脂质Lipofectamin 2000(Invitrogen公司),CCK-8(Med Chem Express公司),全蛋白提取试剂盒(中国碧云天公司),BCA蛋白浓度测定试剂盒(中国全式金公司),6×Loading Buffer、蛋白Marker(上海雅酶生物公司),30%Acrylamide(丙烯酰胺)、APS(过硫酸铵)粉末、青霉素-链霉素溶液(100×)(Seven公司),Tirs-HCl(pH 8.8)、Tirs-HCl(pH 6.8)(中国乐柏生物公司),SDS粉末、TEMED(Coolaber公司),Hoechst 33342染色试剂盒(BD公司),Glycine(甘氨酸)(中国碧云天公司),台盼蓝(Coolaber公司),抗荧光淬灭剂(Beyotime公司),Trizol试剂(Beyotime公司),cDNA反转录试剂盒(Invitrogen公司),qPCR试剂盒(中国艾科瑞生物),DEPC水(中国艾科瑞生物),引物合成(Sigma公司),甘氨酸粉末(Invitrogen公司),氯化钠(Biotal公司),无水甲醇(BD公司),Tris(Biotal公司),30%H2O2(大连医科大学)。
1.2 细胞培养大鼠胚胎心室肌细胞系H9c2来源于中国细胞系资源库(中国北京)。使用10%FBS(胎牛血清)+1%青霉素/链霉素配成的完全培养基在无菌培养皿中培养心肌细胞,待细胞铺均匀后放入37 ℃、5%CO2恒温培养箱中进行无菌培养,6 h后观察细胞贴壁情况,24~36 h换液。
1.3 细胞计数待计数培养皿中细胞加入0.25%胰蛋白酶消化,800 r/min离心5 min,弃去上清液,加入1 mL完全培养基,轻轻吹打混匀,将细胞吹打成单个细胞存在的细胞悬液,移液枪吸取20 μL置于0.5 mL EP管中,加入60 μL台盼蓝染液,吹打混匀,吸取混合液打入计数板,显微镜下计算细胞数量,每1 mL细胞悬液所含细胞数=4大格细胞总数÷4×104×稀释倍数。
1.4 CCK-8实验将细胞以1×104个/孔铺到96孔板中,加入适量培养基铺匀,置于37 ℃孵箱培养24 h。对细胞进行相应处理后,弃去孔中培养基,PBS清洗2次,加入预混的10 μL CCK-8试剂及90 μL无血清培养基,放入孵箱孵育2~6 h。取出96孔板,酶标仪上检测450 nm处的OD值,记录保存数据进行分析,处理组OD450 nm=平均OD450 nm-空白孔OD450 nm。
1.5 转染将细胞铺至6孔板中,待细胞密度达70%时运用Lipofectamine 2000与稀释的si-RNA轻轻混合形成si-RNA-转染试剂混合物,加入孔中轻轻摇晃孔板混均。置于细胞培养箱中培养,6 h后弃掉培养基,更换为无双抗的完全培养基。24~72 h检测mRNA的表达,48~96 h检测蛋白的表达。
1.6 Western blot检测加入适量RIPA裂解液,水平放置摇床上裂解30 min,细胞用刮子刮下并吸入相应的管中,振荡离心后取上清,参照说明书运用BCA法测定蛋白浓度,运用SDS-PAGE凝胶电泳分离蛋白,而后转到PVDF膜上,5%脱脂牛奶室温封闭2 h。加入稀释的一抗,放入湿盒中4 ℃过夜,回收一抗,用TBST在摇床上洗膜15 min×3次。洗完后的膜用稀释好的二抗37 ℃孵育1 h,TBST摇床上洗膜15 min×3次,操作过程全程避光。最后将洗完二抗的膜放在Odyssey凝胶成像分析仪上显影,并保存实验数据。
1.7 qRT-PCR采用qRT-PCR测定RNA的表达水平。首先提取细胞总RNA,按照反转录试剂盒说明书操作合成cDNA。得到cDNA后按照艾科瑞生物SYBR Green Pro Taq HS预混型qPCR试剂盒操作步骤进行PCR反应。
1.8 细胞凋亡染色实验使用Hoechst染色法进行细胞凋亡染色。细胞处理后,吸尽培养液,加入Hoechst 33258染液,使其完全覆盖皿底,染色5 min后去染色液,用PBS或0.9%NaCl洗3~5 min×3次,吸尽液体,滴加1滴抗荧光淬灭封片液于皿上,荧光显微镜下观察致密亮蓝色荧光强度,判断细胞凋亡程度。

2 结果
2.1 H2O2诱导对H9c2心肌细胞活力的影响分别用100、200、400、600、800、1000、1200 μmol/L的H2O2处理H9c2心肌细胞18 h。CCK-8实验检测细胞活力结果显示,使用800 mmol/L H2O2处理心肌细胞达到半抑制浓度(IC50),可作为实验模拟的最佳浓度(图1)。
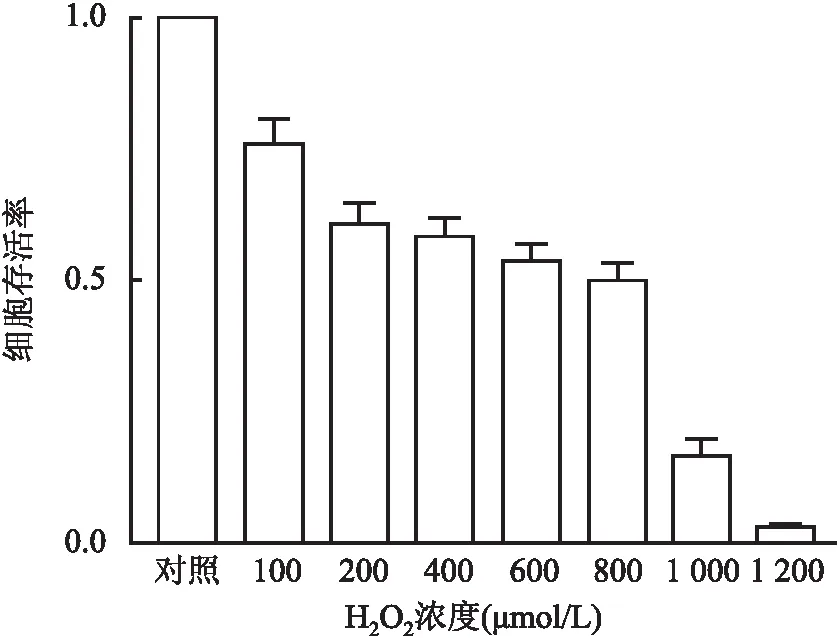
图1 CCK-8检测心肌细胞H9c2在不同浓度H2O2处理下的细胞活力:800 μmol/L H2O2处理心肌细胞的细胞活力约为50%
2.2 H2O2诱导对H9c2心肌细胞凋亡的影响为了解H2O2处理后心肌细胞凋亡情况,应用Western blot检测凋亡相关蛋白Bax、BCL-2、Caspase-3的表达量变化:与对照组相比,H2O2处理后细胞促凋亡相关蛋白Bax(P<0.05)、Caspase-3表达增加(P<0.01),抗凋亡蛋白BCL-2表达降低(P<0.01,图2)。

图2 Western blot检测Bax、BCL-2、Caspase-3蛋白表达水平:*P<0.05,**P<0.01
2.3 Hoechst染色检测心肌细胞凋亡情况为了更直观的观察细胞凋亡情况,本实验对对照组和H2O2处理组进行Hoechst33242凋亡染色,结果显示:与对照组相比,H2O2处理组的细胞致密亮蓝色荧光强度增高(P<0.001,图3)。
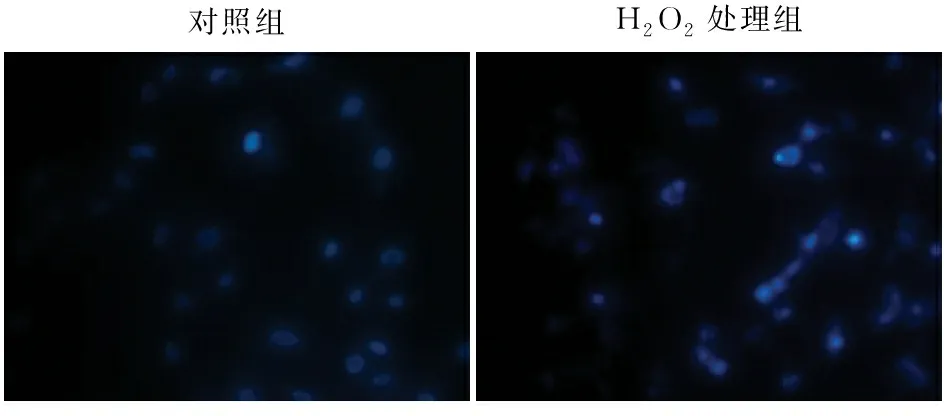
图3 Hoechst染色检测各组凋亡情况:致密亮染的为凋亡细胞
2.4 H2O2处理后Miat、miR-182以及Nogo-A表达水平qRT-PCR检测显示:与对照组相比,H2O2处理后心肌细胞中Miat表达量升高(P<0.01),Nogo-A mRNA表达量升高(P<0.01),而miR-182表达显著下降(P<0.01,图4A~C);Western blot检测显示:H2O2处理组Nogo-A蛋白表达量较对照组升高(P<0.05,图4D)。
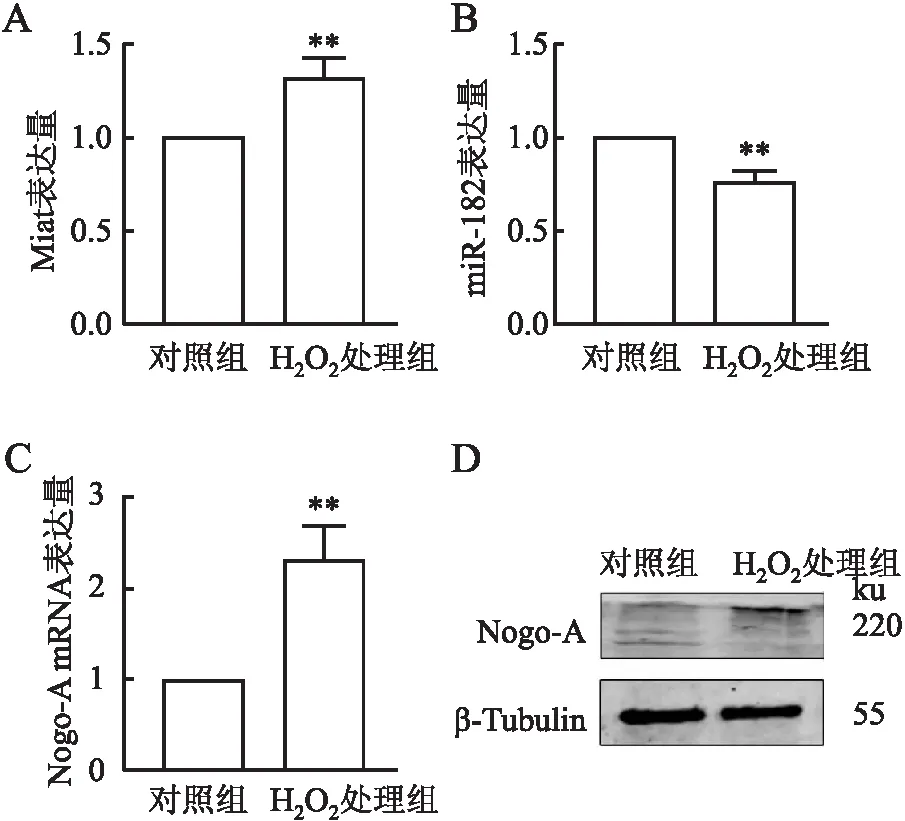
图4 A~C. qRT-PCR检测H2O2处理后心肌细胞Miat(A)、miR-182(B)及Nogo-A(C) mRNA的相对表达量;D.Western blot检测Nogo-A蛋白的表达水平:*P<0.05,**P<0.01
2.5 Miat通过miR-182调节H2O2引起的心肌细胞凋亡
2.5.1验证Miat对miR-182的调控 利用miRNA结合位点预测软件RNAhybird预测发现:Miat与miR-182之间存在靶向结合位点(图5)。验证si-Miat的转染效率:对细胞转染了3条si-Miat,下调效率均良好(P<0.01,图6A);将si-Miat转染进细胞后,与对照组相比,下调组miR-182表达升高(P<0.01,图6B),Nogo-A mRNA表达下降(P<0.005,图6C)。
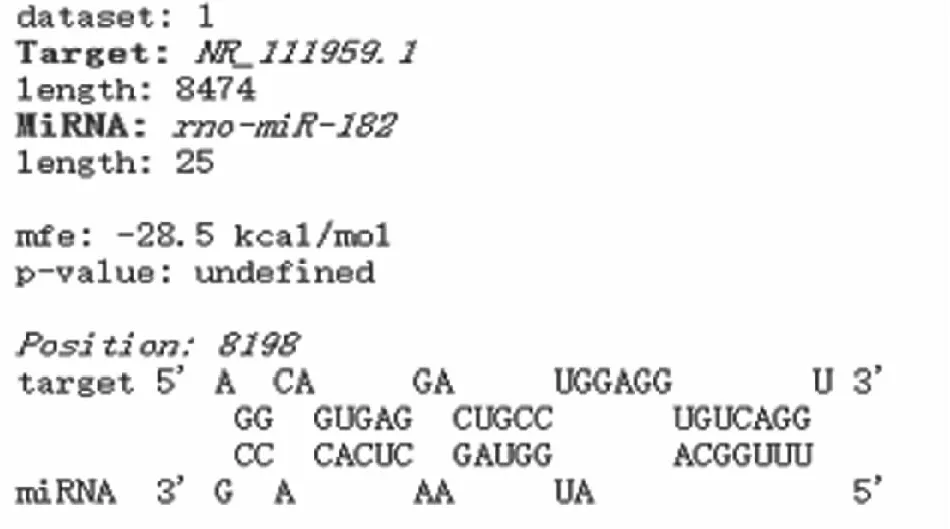
图5 Miat与miR-182存在靶向结合位点
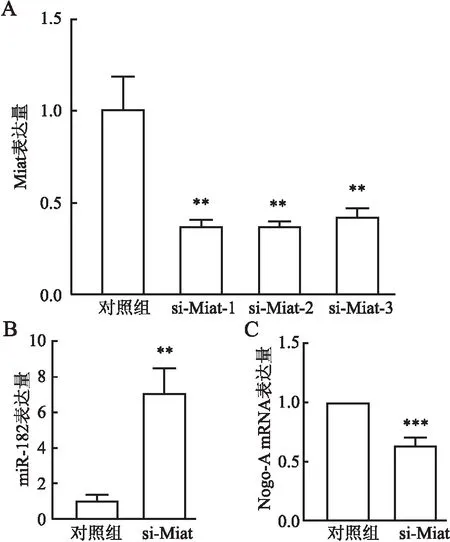
图6 A. qRT-PCR检测si-Miat转染效率;B. qRT-PCR检测转染si-Miat后miR-182的表达;C.qRT-PCR检测转染si-Miat后Nogo-A mRNA的表达;与对照组相比,**P<0.01,***P<0.001
2.5.2下调Miat对H2O2引起心肌细胞凋亡的影响 为进一步研究Miat在H2O2引起的细胞凋亡过程中的调控作用,将实验分为对照组、H2O2处理组、H2O2处理+NC、H2O2处理+si-Miat四组,应用Western blot检测下调Miat后Nogo-A及凋亡相关蛋白的表达变化:与对照组相比,H2O2处理组Nogo-A蛋白表达增加(P<0.05),Bax、Caspase-3表达增加(P<0.05),BCL-2表达降低(P<0.01);与H2O2处理+NC组相比,H2O2处理+si-Miat组Nogo-A蛋白表达下降(P<0.05),Bax、Caspase-3表达下降(P<0.05),BCL-2表达增加(P<0.05,图7)。
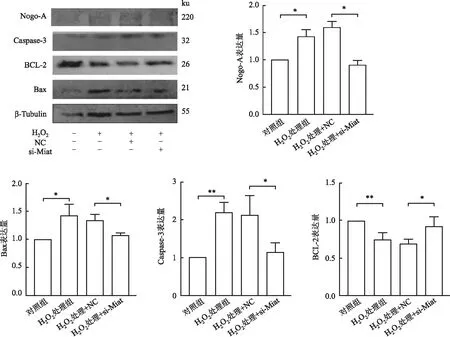
图7 Western blot检测对照、H2O2处理、H2O2处理+NC、H2O2处理+si-Miat各组中Nogo-A蛋白及凋亡相关蛋白Bax、Caspase-3、BCL-2的表达水平:*P<0.05,**P<0.01
2.5.3Hoechst染色情况 为更直观观察Miat对H2O2引起的细胞凋亡的调控作用,应用Hoechst染色观察各组细胞凋亡情况:结果显示,与对照组相比,H2O2处理组细胞致密亮蓝色荧光强度增高,表明细胞凋亡率增高(P<0.000 1,图8);与H2O2处理+NC组相比,H2O2处理+si-Miat组可明显观察到细胞致密亮蓝色荧光强度降低,即凋亡率降低(P<0.01)。
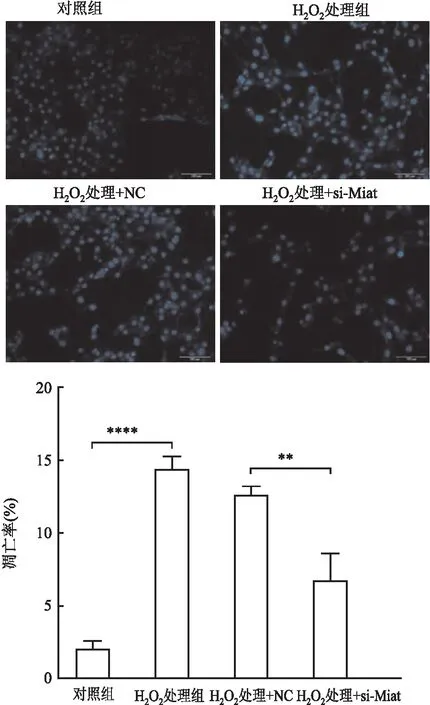
图8 Hoechst染色检测对照、H2O2处理、H2O2处理+NC、H2O2处理+si-Miat四组细胞的凋亡情况:**P<0.01;****P<0.000 1
2.6 miR-182通过Nogo-A调控心肌细胞凋亡
2.6.1验证miR-182对Nogo-A表达的调控 利用TargetScan预测显示miR-182与Rtn4 mRNA的3′-UTR存在结合位点(图9A)。验证miR-182 mimics的转染效率:与NC组相比,miR-182 mimics组miR-182的表达量明显升高(P<0.01,图9B),表明转染有效。在H9c2细胞中转染miR-182 mimics后qRT-PCR检测Nogo-A mRNA的表达量,与NC组相比,miR-182 mimics组Nogo-A mRNA表达降低(P<0.001,图9C)。
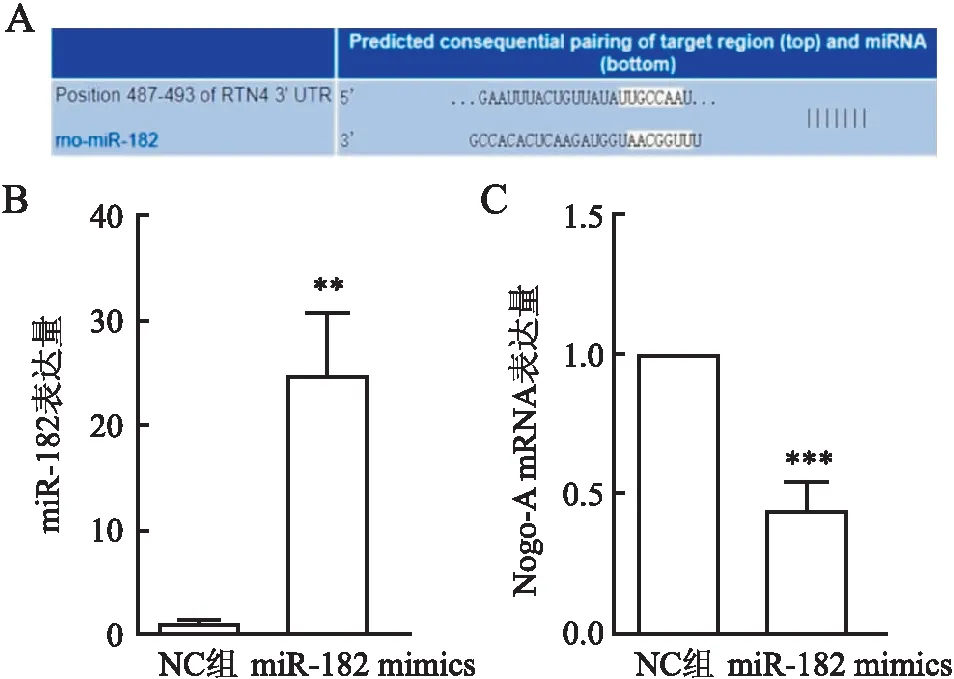
图9 A.生物信息网站TargetScan预测miR-182与Nogo-A mRNA的3′-UTR存在结合位点;B.qRT-PCR检测转染miR-182 mimics后miR-182的表达;C. qRT-PCR检测转染miR-182 mimics后Nogo-A mRNA的表达:**P<0.01;***P<0.005
2.6.2上调miR-182对H2O2引起心肌细胞凋亡的影响 为探索miR-182对H2O2引起的细胞凋亡的调控作用,应用Western blot检测上调miR-182后各组凋亡相关蛋白的表达,结果显示:与对照组相比,H2O2处理组Bax(P<0.01)、Caspase-3表达升高(P<0.01),BCL-2表达降低(P<0.000 1);与H2O2处理+NC组相比,H2O2处理+miR-182 mimics组Bax(P<0.05)、Caspase-3表达降低(P<0.05),BCL-2表达升高(P<0.05)。
Western blot检测上调miR-182后Nogo-A表达变化,结果显示:与对照组相比,H2O2处理组Nogo-A蛋白表达升高(P<0.000 1);与H2O2处理+NC组相比,H2O2处理+miR-182 mimics组Nogo-A蛋白表达量降低(P<0.05),H2O2处理+NC组与H2O2处理组Nogo-A蛋白表达变化差异无统计学意义(图10)。

图10 Western blot检测对照、H2O2处理、H2O2处理+NC、H2O2处理+miR-182 mimics四组凋亡相关蛋白Bax、Caspase-3、BCL-2及Nogo-A蛋白的表达:*P<0.05;**P<0.01,****P<0.000 1
2.6.3Hoechst染色情况 为更直观观察miR-182对H2O2引起的细胞凋亡的调控作用,对各组细胞进行Hoechst凋亡染色。结果显示:与对照组相比,H2O2处理组细胞致密亮蓝色荧光强度增高(P<0.000 1);与H2O2处理+NC组相比,H2O2处理+miR-182 mimics组细胞致密亮蓝色荧光强度降低(P<0.000 5),H2O2处理+NC组与H2O2处理组Hoechst染色情况无明显变化(图11)。
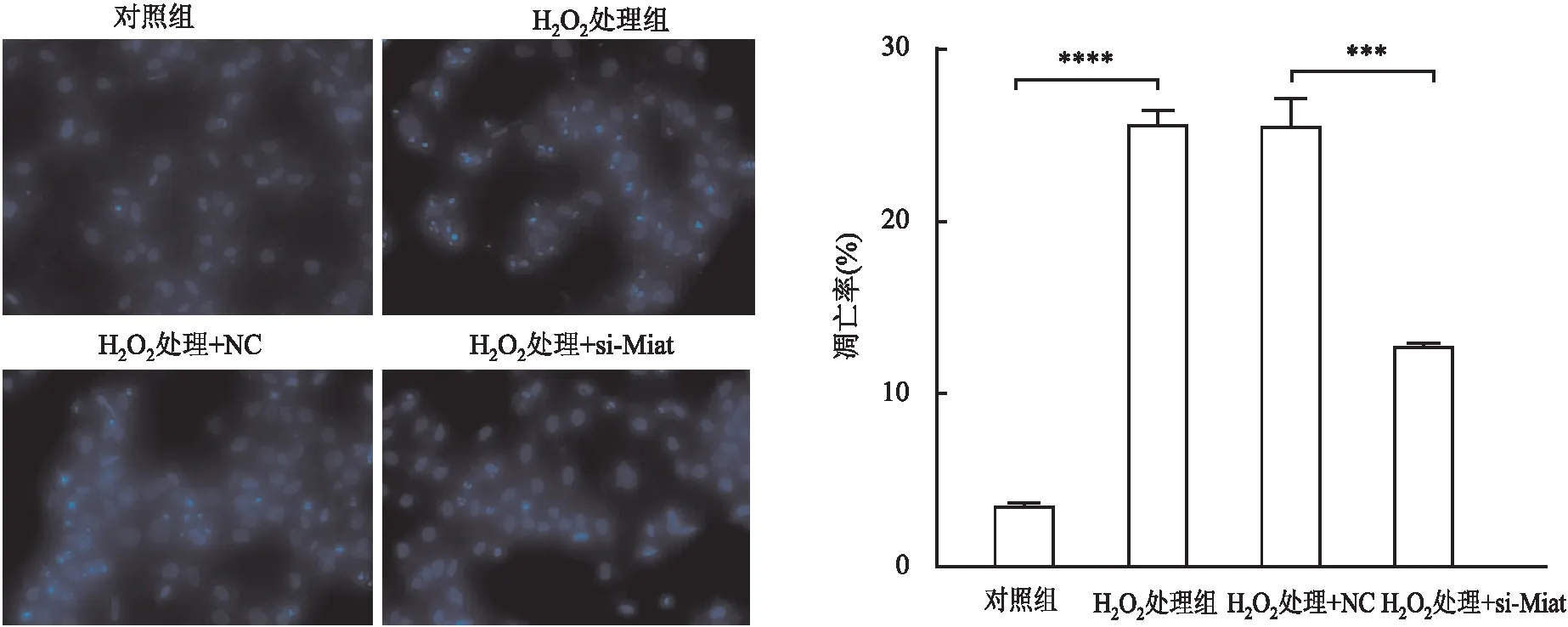
图11 Hoechst染色检测对照、H2O2处理、H2O2处理+NC、H2O2处理+miR-182 mimics四组凋亡情况:***P<0.001,****P<0.000 1
2.7 上调Nogo-A逆转上调miR-182所缓解的心肌细胞凋亡为探究miR-182/Nogo-A轴对心肌细胞凋亡的调控作用,进行补救实验验证两者之间的互相作用以及两者对心肌细胞凋亡的影响。
2.7.1上调Nogo-A与miR-182后细胞凋亡相关蛋白表达的变化 对miR-182和Nogo-A分别上调以及两者共上调,后对相应分组进行H2O2处理,检测Nogo-A蛋白表达变化,结果显示:与对照组相比,H2O2处理组Nogo-A表达升高(P<0.05);与H2O2处理+NC相比,H2O2处理+miR-182 mimics组Nogo-A表达降低(P<0.01);与H2O2处理+miR-182 mimics+Nogo-A NC组比较,H2O2处理+miR-182 mimics+Nogo-A组的Nogo-A表达升高(P<0.05,图12)。

图12 Western blot检测对照、H2O2处理、H2O2处理+NC、H2O2处理+miR-182 mimics、H2O2处理+miR-182 mimics+NC、H2O2处理+miR-182 mimics+Nogo-A各组中凋亡相关蛋白Bax、Caspase-3、BCL-2及Nogo-A的表达水平:*P<0.05,**P<0.01,***P<0.001
应用Western blot检测各组中Nogo-A蛋白表达变化,结果显示:与对照组相比,H2O2组Bax(P<0.001)、Caspase-3(P<0.01)表达升高,BCL-2表达下降(P<0.05);与H2O2+NC组相比,H2O2+miR-182 mimics组Bax低、Caspas-3表达降低(P均<0.05),BCL-2表达升高(P<0.01);与H2O2+miR-182 mimics+Nog-A NC组相比较,H2O2+miR-182 mimics+Nogo-A组Bax、Caspase-3表达升高(P均<0.05),BCL-2表达降低(P<0.05,图12)。
2.7.2Hoechst凋亡染色情况 为更直观观察Nogo-A与miR-182间的互相作用以及两者对心肌细胞凋亡的影响,应用Hoechst染色观察各组细胞凋亡情况。结果显示:与对照组相比,H2O2处理组凋亡率升高(P<0.001);与H2O2处理+NC相比,H2O2处理+miR-182 mimics组凋亡率降低(P<0.05);与H2O2处理+miR-182 mimics+Nogo-A NC组相比,H2O2处理+miR-182 mimics+Nogo-A组凋亡率升高(P<0.05,图13)。
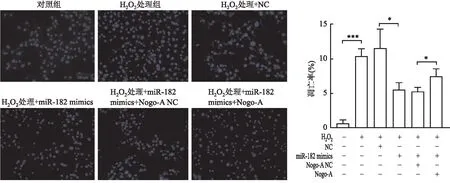
图13 Hoechst染色检测对照、H2O2处理、H2O2处理+NC、H2O2处理+miR-182 mimics、H2O2处理+miR-182 mimics+Nog-A NC、H2O2处理+miR-182 mimics+Nogo-A六组细胞凋亡情况:*P<0.05,***P<0.001
2.8 Miat通过miR-182/Nogo-A调控心肌细胞凋亡为研究Miat和miR-182/Nogo-A的调控关系,对心肌细胞进行si-Miat与miR-182 inhibitor共转染后进行H2O2处理,观察心肌细胞的各指标的变化。
2.8.1Miat与miR-182双下调后凋亡相关蛋白及Nogo-A表达的变化 Western blot检测显示:与对照组相比,H2O2处理组Nogo-A表达升高(P<0.01);与H2O2处理+NC相比,H2O2处理+si-Miat组Nogo-A表达降低(P<0.05),H2O2处理+NC组与H2O2处理组的Nogo-A表达差异无统计学意义;与H2O2处理+si-Miat+inhibitor NC组相比,H2O2处理+si-Miat+miR-182 inhibitor组的Nogo-A表达升高(P<0.05);H2O2处理+si-Miat+inhibitor NC组与H2O2处理+si-Miat组Nogo-A表达无明显变化。
Western blot检测结果显示:与对照组相比,H2O2处理组Bax(P<0.05)、Caspase-3(P<0.01)表达升高,BCL-2表达下降(P<0.001);与H2O2处理+NC组相比,H2O2处理+si-Miat组Bax(P<0.01)、Caspase-3(P<0.05)表达降低,BCL-2表达升高(P<0.01);与H2O2处理+si-Miat+NC组相比,H2O2处理+si-Miat+miR-182 inhibitor组Bax、Caspase-3表达升高(P均<0.05),BCL-2表达降低(P<0.05,图14)。
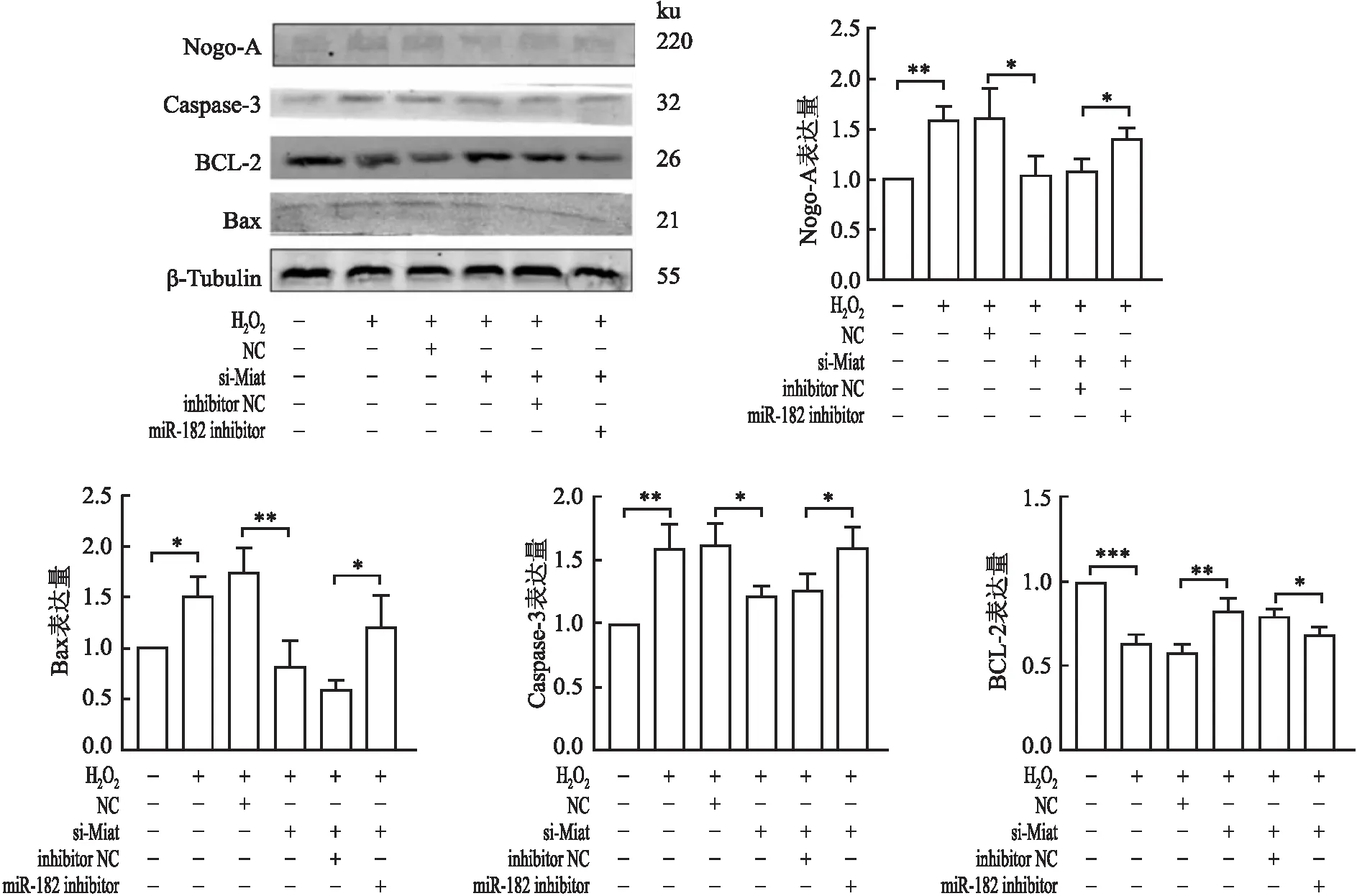
图14 Western blot检测对照、H2O2处理、H2O2处理+NC、H2O2处理+si-Miat、H2O2处理+si-Miat+inhibitor NC、H2O2处理+si-Miat+miR-182 inhibitor各组细胞凋亡相关蛋白Bax、Caspase-3、BCL-2及Nogo-A的表达水平:*P<0.05,**P<0.01,***P<0.001
2.8.2Hoechst染色情况 利用Hoechst染色更直观观察各组细胞凋亡情况,结果显示:与对照组相比,H2O2处理组凋亡率升高(P<0.000 1);与H2O2处理+NC组相比,H2O2处理+si-Miat组凋亡率降低(P<0.000 1),H2O2处理+NC组与H2O2处理组相比凋亡率变化无统计学意义;与H2O2处理+si-Miat+inhibitor NC组相比,H2O2处理+si-Miat+miR-182 inhibitor组凋亡率升高(P<0.05,图15)。

图15 Hoechst染色检测对照、H2O2处理、H2O2处理+NC、H2O2处理+si-Miat、H2O2处理+si-Miat+inhibitor NC、H2O2处理+si-Miat+miR-182 inhibitor六组细胞凋亡情况:*P<0.05,****P<0.000 1
3 讨论
随着社会的不断进步,我国居民生活水平逐步提高,从而衍生出一系列健康问题,其中CVD严重影响着人们的身体健康,近年来CVD的发病率和病死率呈逐渐上升态势。因此,CVD的相关研究成为医学研究的重点和热点,同时因CVD导致的损伤和死亡的相关鉴定也是法医学研究的重点内容。CVD中病死率较高、发生较为迅速的是心肌梗死。心肌梗死即动脉粥样硬化或血栓形成堵塞冠状动脉导致心肌发生坏死的病理变化,氧化应激在心肌梗死过程中占据着重要地位。
LncRNA是长度超过200 nt的RNA分子,分布广泛,在转录、转录后和翻译的水平发挥重要的调控功能[13]。LncRNA虽然不具有编码蛋白的功能,但是其可以在转录、转录后和翻译等多水平调控生物活动进程。LncRNA与CVD、癌症、神经系统疾病等多种疾病或损伤的发生进展有着密切联系[14-16]。研究表明,lncRNA可以通过靶向miRNA来调节心肌梗死的进展,lncRNA APF通过直接结合miR-188-3p来调节心肌梗死中心肌细胞的自噬过程,从而调控心肌梗死进程的发展[17]。本实验通过运用H2O2处理模拟心肌细胞氧化应激损伤,qRT-PCR检测表明H2O2处理后H9c2细胞中Miat表达升高;Western blot检测促凋亡蛋白Bax、Caspase-3表达升高,抑凋亡蛋白BCL-2表达降低,且Hoechst凋亡染色发现凋亡率上升,这些结果表明存在细胞凋亡。与H2O2+NC组相比,下调Miat后促凋亡蛋白Bax、Caspase-3表达降低,抑凋亡蛋白BCL-2表达升高,凋亡染色显示凋亡率降低,表明下调Miat可抑制H2O2处理心肌细胞的凋亡。检测Miat与Nogo-A的关系发现,与H2O2处理+NC组相比,下调Miat后Nogo-A mRNA和蛋白表达量均降低,说明Miat可能对Nogo-A具有正向调控作用。
miRNAs是一类由内源基因编码、长度约22 nt的单链非编码RNA分子,miRNAs可通过与下游的mRNA 3′-UTR区域结合,从而诱导mRNA降解或通过抑制翻译的方式发挥作用。本实验结果显示,H2O2处理后心肌细胞miR-182表达量降低;上调miR-182后促凋亡蛋白Bax、Caspase-3表达降低,抑凋亡蛋白BCL-2升高,且凋亡染色发现凋亡率降低,说明下调miR-182可减轻细胞凋亡。文献报道lncRNA可作为miRNAs的海绵,竞争性结合miRNA,从而对下游的靶基因发挥调控作用[18]。故推测Miat可能通过作为miR-182海绵吸附miR-182发挥作用,因此运用生物预测软件RNAhybrid预测Miat与miR-182可能存在靶向结合关系。通过si-Miat与miR-182 inhibitior共转染后发现,与si-Miat+inhibitior NC组相比,si-Miat+miR-182 inhibitior组促凋亡蛋白Bax、Caspase-3表达升高,抑凋亡蛋白BCL-2表达降低,凋亡染色显示凋亡率升高,表明si-Miat与miR-182 inhibitior共转染组凋亡情况高于si-Miat+inhibitior NC组,即下调miR-182后抵消了部分下调Miat对细胞凋亡的抑制作用。说明Miat可能通过miR-182调控H2O2处理所致心肌细胞凋亡。
Nogo-A是位于真核细胞内质网的跨膜蛋白,属于网状蛋白家族成员,由Rtn4基因编码。网状蛋白分为Nogo-A、Nogo-B、Nogo-C三种亚型,其中Nogo-A是网状蛋白质家族成员中最大的蛋白[19]。本实验探究Nogo-A与氧化应激所致心肌细胞凋亡的关系,结果发现H2O2处理后Nogo-A表达升高,与促凋亡相关指标变化趋势一致,提示Nogo-A高表达与凋亡可能具有联系。运用生物预测网站TargetScan预测miR-182与Nogo-A可能存在靶向结合关系;探究miR-182与Nogo-A的关系发现,miR-182 mimics与上调Nogo-A共转染后,与miR-182 mimics+Nogo-A NC组相比,miR-182 mimics+Nogo-A组促凋亡蛋白Bax、Caspase-3表达升高,抑凋亡蛋白BCL-2表达降低,凋亡染色显示凋亡率升高,表明miR-182 mimics+Nogo-A组凋亡情况高于miR-182 mimics+Nogo-A NC组,即上调Nogo-A后解除了部分miR-182 mimics对心肌细胞凋亡的抑制作用。说明miR-182可能通过Nogo-A调控H2O2处理后心肌细胞凋亡。关于Miat、miR-182与Nogo-A之间的关系,si-Miat与miR-182 inhibitior共转染后发现,与si-Miat+inhibitior NC组相比,si-Miat+miR-182 inhibitior组Nogo-A蛋白表达升高,与凋亡情况变化趋势表现一致,表明si-Miat+miR-182 inhibitior组凋亡情况高于si-Miat+inhibitior NC组,即下调miR-182后解除了部分下调Miat对Nogo-A表达的抑制作用,表明Miat可能通过miR-182/Nogo-A轴调控H2O2处理所致的心肌细胞凋亡。
综上,lncRNA Miat可以通过miR-182/Nogo-A调控H2O2处理后的心肌细胞凋亡,表明Miat在心肌细胞氧化应激过程中具有重要的调控作用。

