气相色谱–离子迁移谱分析微囊藻的挥发性成分
虞锐鹏 王怡淼 吴胜芳 宋启军 王婵 周海权

摘要:建立顶空–气相色谱–离子迁移谱(headspace-gas chromatography-ion mobility spectrometry, HS-GC-IMS)方法,比较了不同生长时期的微囊藻挥发性物质差异。根据离子迁移谱图结果,结合化学计量学方法对比挥发性有机化合物,通过其指纹谱图观察挥发性物质相对含量的变化规律。结果表明,挥发性成分的 GC-IMS 谱图存在明显差异,前 2 个主成分累计贡献率达到 78.4%。从微囊藻水华样品中共鉴定出 91 种挥发性成分,其中包括醛类 23 种、醇类 21 种、酯类 16 种、酮类 10 种、硫醚类 7 种、酸类 2 种、萜烯类 2 种,其中 1-丁醇、(E,E)–2,4–癸二烯醛、乙酸、二甲基硫醚、(E)–3–己烯–1–醇、 1–辛烯–3–酮等是微囊藻水华特征挥发性差异物。本方法操作简便快速,灵敏度高,可用于藻类水华时挥发性代谢物的筛查及确证,为环境监测提供数据支持。
关键词:气相色谱–离子迁移谱;微囊藻;挥发性成分
中图分类号: R 994.4 文献标志码: A
Analysis of volatile components of Microcystis based on gas chromatography-ion mobility spectrometry
YU Ruipeng1,2,WANG Yimiao2,WU Shengfang2,SONG QiJun1,WANG Chan1,ZHOU Haiquan3
(1. School of Chemical and Material Engineering, Jiangnan University, Wuxi 214122, China;2. State Key Laboratory of FoodScience and Technology, Jiangnan University, Wuxi 214122, China;3. Zhejiang Beyondsun Green Energy Technology Co., Ltd.,Huzhou 313008, China)
Abstract: Aheadspace-gaschromatography-ionmobilityspectrometry (HS-GC-IMS) methodwas established to compare the difference of volatile substances of Microcystis at different growth periods. Accordingtotheionmobilityspectrum,thevolatileorganiccompoundswerecomparedby using chemometrics. The change patterns in the relative content of volatile compounds were observed by its fingerprint spectrum. The results show that there is obvious distinction in GC-IMS spectrum of volatile components, with the cumulative contribution rate of first two principal components being 78.2%.91 volatilecomponentsareidentifiedfromMicrocystisbloomsamples,including 23 aldehydes, 21 alcohols, 16 esters, 10 ketones, 7 thioethers, 2 acids and 2 terpenes. Among them characteristic volatile componentsduring Microcystisbloominclude1-butanol, (E,E)-2,4-decadienal,aceticacid,dimethylsulfi-de, (E)-3-hexene-1-alcohol,1-octene-3-one. This method is simple, rapid and sensitive. It can be used as a screening and confirmation method of volatile metabolites in water during algal bloom, thus providing data support for environmental monitoring.
Keywords: gas chromatography-ion mobility spectrometry;Microcystis; volatile components
近年来,随着快速城镇化及过度的农业行为,湖泊富營养化加重,造成水体中蓝藻异常生长,导致蓝藻水华频繁发生[1-2]。藻类死亡时将细胞内大量次生代谢物释放到水中[3],严重恶化水质,散发的异味引起人们对水质是否达标产生恐慌[4]。另一方面,藻类大量繁殖生长,会进一步消耗水体中的营养物质,从而诱导挥发性有机化合物(volatile organic compounds ,VOCs)大量产生与释放[5]。这些 VOCs往往有利于藻类在激烈的竞争环境中生存和繁殖[6-7],其主要为醛类、醇类、酯类、萜烯类和硫化合物[8]。藻类富含的甲硫氨酸可能是含硫 VOCs形成的前体物质,硫化物往往是藻华爆发期乃至死亡期常见的化合物,从水体扩散到大气中后,进而影响空气环境[9]。萜烯类 VOCs 具有化感抑制及帮助藻细胞抗逆胁迫作用,有效抑制其他水生生物生长[10]。如何将藻类生长繁殖过程中产生的挥发性代谢物同传统水体表征指标相结合,建立合理评价指标及水华预测模型,需要深入探究。
挥发性有机物作为大气重要污染物,受到环境监测领域的广泛关注。目前对水体中 VOCs 的监测方法主要为嗅觉鉴定方法和仪器分析法,前者存在精密度较差、难以准确划分异味类型等缺点。仪器分析法多采用三维荧光光谱、吸收光谱、气相色谱法、气质联用法并结合微波蒸馏萃取法、吹扫捕集法、固相微萃取法等新型的前处理方法[11],提高了定性定量分析效率。气相色谱–离子迁移谱( gaschromatography-ionmobility spectrometry, GC-IMS)方法利用气相离子在电场迁移速率不同而对离子进行检测,结合了气相色谱高分离度和离子迁移谱高灵敏度的优势,无需任何特殊的样品前处理,即可快速检测样品中的痕量挥发性有机物。其结果以直观可视化的指纹图谱呈现不同样品差异,目前已广泛应用于食品品控[12]、医疗诊断[13-14]等领域。
藻类挥发性成分含量低、组成复杂、不稳定,现有的分离与检测技术存在各自的局限,而采用 GC-IMS 方法对藻类挥发性风味成分的研究较少。本研究利用顶空–气相色谱–离子迁移谱( headspace-gaschromatography-ionmobility spectrometry, HS-GC-IMS)技术对藻类生长的不同阶段产生的挥发性有机化合物进行检测和分析,利用特征指纹图谱分析微囊藻的衰亡过程,结合主成分分析及聚类分析等多元統计方法分析微囊藻衰亡初期的特异性化合物,探究该方法在水华预警指标细化及早期预警中应用的可行性。
1 实验
1.1 仪器与试剂
Eclipse E100生物显微镜(日本 NIKON 公司);FlavourSpec风味分析仪(德国 GAS 公司);TalboysVortex 涡旋混合器(美国 Henry Troemner公司)。
1.2 样品前处理
藻样收集及处理:2020年9月于太湖梅梁湾采集微囊藻水华藻水并室外培养,混合均匀后分配到铝膜包裹的白色水桶内。实验组水桶上方覆盖白色透明薄膜。监测细胞密度,待其稳定后,每隔3 d 取样:分为 Y1, Y2, Y2, Y4, Y5共5 个实验组(后同),每组各取3只平行样,迅速冷冻,?20℃保存。进样前单独解冻10 min 并充分混匀,恢复到室温[11]。
1.3GC-IMS 测试方法
顶空进样条件:分别称取上述解冻后的样品2.0 g 放于20 mL 顶空瓶内,在温度60℃、转速 u500 r/min 下培育30 min,在不分流进样模式下于65℃进样500μL。
GC-IMS 仪器条件: WAX 毛细管气相色谱柱(30 m×0.53 mm×1μm,美国 RESTEK 公司),柱温为60℃, 载气为高纯氮气(纯度≥99.999%),漂移气载气流速为150 mL/min,气相载气流速为初始2 mL/min,保持2 min ,在8 min 内线性增至 10 mL/min,之后在10 min 内线性增至100 mL/min,并保持20 min 不变,分析时间为40 min。
1.4 数据分析
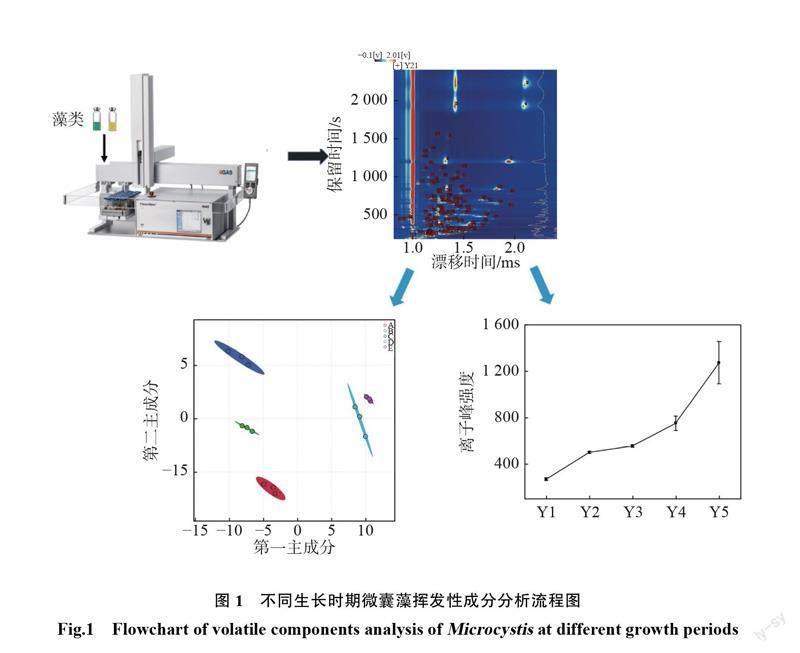
使用仪器配套的VOCal分析软件及 Reporter、 Gallery Plot 和 Dynamic 插件对样品进行主成分分析(principal component analysis ,PCA)和偏最小二乘判别分析(partial least squares-discriminant analysis,PLS-DA)等多元统计分析及含量分析。采用 GraphPad Prism 和OriginPro 2012b进行数据处理。通过自建的 IMS 数据库、国家标准与技术研究院( NationalInstituteofStandardsandTechnology, NIST)数据库及保留指数对样品中挥发性化合物进行分析,分析流程图见图1。
2 结果与讨论
2.1 微囊藻挥发性成分的谱图分析
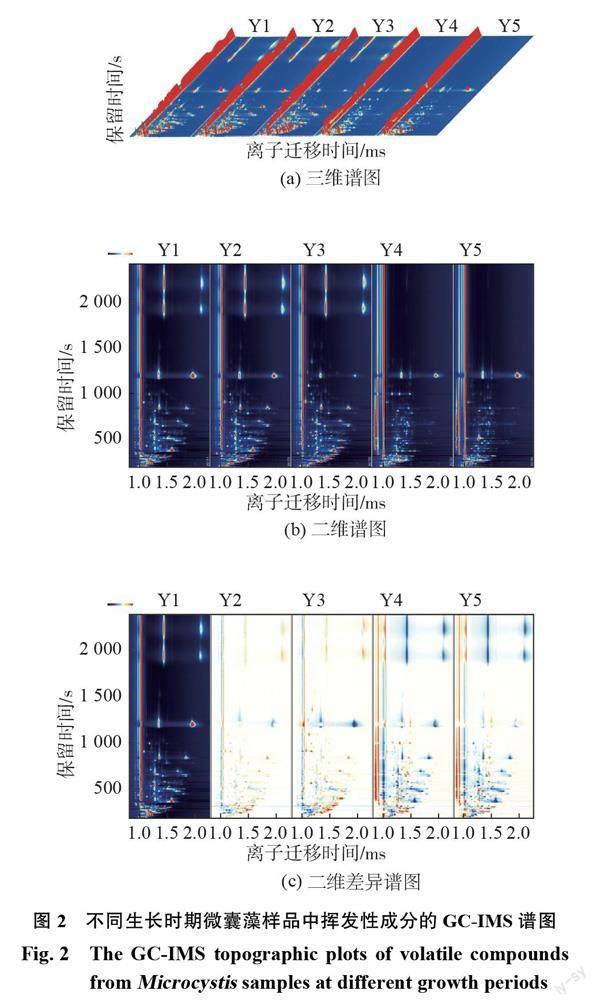
选择在9月份采样是因为该时期微囊藻为水体优势藻种,且气温、光照使藻生长达到高峰。室外培养条件模拟自然水体环境,当无额外营养物质的加入,微囊藻在较短时间内大量衰亡,容易发现差异明显的挥发性代谢物。微囊藻生长过程中会消耗许多营养物质,产生 VOCs,实验中后期微囊藻生长空间不足,溶解氧缺乏,微囊藻死亡加剧。5组实验组(Y1~Y5)平均藻密度分别为1.48×10,6.35×10,9.54×10,1.40×10,6.44×107个/L,相对应的生长期为稳定期Ⅰ、稳定期Ⅱ、稳定期Ⅲ、衰亡期Ⅰ、衰亡期Ⅱ。使用 GC- IMS 对不同时期的微囊藻样品进行分析,得到 VOCs 总峰体积(平均值)分别为:4.99×105,5.28×105,4.91×105,4.61×105,4.42×105,相关检验值 R =0.672,显著性检验值 P 为0.0061。结果说明两者存在中度正相关关系,且差异极显著(P<0.01),这符合 Li 等[15]得出的结论,即微囊藻同其产生气味具有相关性。探究其特异挥发性有机化合物,微囊藻不同生长阶段(不同采样时间节点)样品图片和挥发性有机化合物三维可视化图谱如图2所示。
利用 HS-GC-IMS 对不同生长时期的微囊藻样品的挥发性化合物进行分析,探究影响微囊藻气味的特异性挥发物质。IMS 检测基于β电离产生的空气簇离子与分析物发生快速离子反应,因此更适合用于痕量物质的分析检测,该技术不仅可以准确鉴定样品中的挥发性物质,还可以建立样品的指纹图谱[16]。图2给出了微囊藻不同生长阶段(不同采样时间节点)挥发性有机化合物的可视化图谱。其中,图2(a)为三维谱图,从图中可以直观看出不同样品中的挥发性有机物种类和峰体积都有明显不同,但是由于观察不便,因此取俯视图进行差异对比。
图2(b)为不同生长时期的微囊藻样品中挥发性化合物的二维谱图。横纵坐标分别为离子迁移时间和保留时间,反应离子峰(reaction ion peak, RIP)(1.0处)两侧的点代表挥发性有机物。其中,颜色代表物质的浓度,红色到白色代表浓度逐渐降低。由图2(b)可以看出,随着微囊藻生长时期的变化,样品挥发性化合物产生了明显差异。为了能更直观地比较不同生长时期的微囊藻挥发性物质之间的差异,以原浆 Y1的谱图作为参考谱图,利用软件自带的差异模式比较不同生长时期的微囊藻谱图和参考谱图之间的差异,结果如图2(c)所示。红色表明该化合物的浓度高于参考样品,蓝色则意味着该化合物的浓度低于参考样品。从图中可以看出,样品组 Y2,Y3红框中圈出的物质浓度高于对照样品,而样品组 Y4,Y5红框中圈出的物质浓度明显低于对照样品,那么这些化合物可能成为鉴定不同生长时期的关键差异物。
2.2GC-IMS 挥发性成分定性及指纹图谱分析
对不同生长时期的微囊藻样品进行挥发性化合物定性分析,共检测到155种化合物,利用 IMS 迁移时间数据库和 NIST 库共定性出115种挥发性化合物(包括单体和二聚体)。为了更直观地比较微囊藻在生长过程中挥发性化合物的差异,利用软件内置的 Gallery Plot 插件生成不同生长时期的微囊藻的 VOCs指纹图谱,如图3所示。横坐标代表一个样品中选取的全部信号峰(未标化合物名称的由于所建 GC-IMS 数据库不完善),纵坐标代表同一挥发性化合物在不同样品中的信号峰。从图中可以看出,不同生长时期的微囊藻特征挥发性物质有较大差别,包括醛类23种、醇类 21种、酯类16种、酮类10种、硫醚类7种、酸类2种、萜烯类2种。由于 GC-IMS 对醛酮类化合物检测更为灵敏,因此能够检测到更多的醛酮类物质[17]。其中挥发性有机物较高的醛类有:丁醛、戊醛、壬醛、辛醛、庚醛、(E)–2–己烯醛–单体、(E)–2–辛烯醛-单体、2,4–癸二烯醛-单体;己醛、丙醛;酮类有:1–辛烯–3–酮、环己酮、丙酮、6–甲基–5–庚烯–2–酮、2–辛酮、2–戊酮、环己酮;含硫化合物有:二甲基硫醚、二甲基二硫醚、二甲基三硫醚、二烯丙基硫化物等。
藻類 VOCs 可自发产生, 也可为多种环境因素所诱导产生。光照、温度、营养条件、盐度等环境因子变化会导致藻类次生代谢途径改变, 并诱导新 VOCs产生与释放。微囊藻除释放萜烯类、长链脂肪族烃、樟脑和β-紫罗兰酮等化合物外,还释放大量的芳香族和硫化物,藻类 VOCs 释放到水体中后会改变水质 , 如杂醇土味素具有泥土气味,而己醛、辛醛、壬醛和1–辛烯–3–醇则带有腥味。
2.3 微囊藻挥发性化合物 PCA 及 PLS-DA 分析
为验证是否可以通过挥发性代谢物判断微囊藻生长时期,研究对全部微囊藻样品中鉴定出的挥发性化合物进行主成分分析,对不同生长时期的微囊藻样品进行间差异性分析,结果如图4(a)所示。从图中可以看出第一主成分和第二主成分的贡献率分别为63.2%和15.2%,前两个主成分的累计贡献率达到78.4%,说明前两个主成分就能获取样品的大部分信息。由图4看出,相同生长时间的样品有较好的聚集性,即稳定期Ⅰ、稳定期Ⅱ、稳定期Ⅲ较为接近,而与衰亡期Ⅰ、衰亡期Ⅱ差异较大,因此可以利用 GC-IMS 技术实现不同生长时期的微囊藻样品的区分。
为了能够将高维数据进行可视化降维处理,并且找出不同生长时期的微囊藻的特征化合物,基于上述挥发性物质建立 PLS-DA 模型,结果如图4(b)所示。可以看出,5组样品能够被很好地区分开来,并且第一主成分和第二主成分的累计贡献率达到81.3%,前两个主成分能够反映不同组别的样品挥发性化合物的差异。一般地,对于 PLS-DA 模型可以用预测率 Q2和累积解释能力参数 R2来判断模型的预测性和解释性。该模型的Q2和 R2分别为0.992和0.997,说明模型的拟合度和预测性都较好,可用于辅助差异物的筛选。此外,使用变量投影(variable influence on projection, VIP)值来确定对区分不同组别样品有明显影响的标志化合物,通常认为 VIP 值大于1时,该化合物就可以被认定为特征化合物。图5列出了 VIP 值大于1.2的30种化合物,右侧的方块表示该化合物在不同生长时期的样品中的浓度,蓝色代表浓度最低,红色代表浓度最高。具体信息如表1所示,包括化合物名称、分子式、 CAS 号、迁移时间、保留时间和保留指数。
2.4 挥发性成分含量分析
在不同生长时期,微囊藻释放各类挥发性化合物规律不同。对由 Gallery Plot 得到的指纹图谱峰体积数据进行对比,直观且定量地比较不同样品之间的挥发性有机物差异,结果如图6所示。随着微囊藻的生长,1–丁醇浓度逐渐升高,见图6(a)。二甲基硫醚来源于藻体渗透调节物质硫代甜菜碱的降解,藻类死亡后,硫代甜菜碱被硫代甜菜碱裂解酶分解或经光氧化降解为 DMS[18]。图6(b)表明二甲基硫醚在微囊藻死亡后大量产生,在衰亡期Ⅱ浓度增至稳定期Ⅰ的8倍。藻受到外界威胁或损伤时会通过活化磷脂酶 A2释放脂肪酸,再经脂氧合酶水解生成(E,E)–2,4–癸二烯醛用于防御[19]。由图6(c)可以看出,(E,E)–2,4–癸二烯醛在稳定期保持在较高的水平,衰亡期则明显下降。在稳定期末期检测到较高水平的(E)–2–己烯醛,如图6(d)所示,通常植物或微生物富含α–亚麻酸,其脂氧合酶途径的代谢初产物是(Z)–3–己烯醛,此类挥发物质多源于高等植物,而因微囊藻中的脂氧合酶活性较低,少见于藻类[20]。在此研究中, GC-IMS 对醛类物质的高灵敏度得以体现。
实验未检测到脂肪族烃类, 可能是数据库不全或灵敏度不高的缘故。 GC-IMS 技术在挥发性成分分析中存在的局限性尚需进一步完善。
3 结论
采用 GC-IMS 对不同生长时期的微囊藻挥发性气味物质进行分析,共鉴定出91种挥发性成分,其中包括醛类23种、醇类21种、酯类16种、酮类10种、硫醚类7种、酸类2种、萜烯类2种。稳定期的初期时乙醇、二烯丙基硫醚、丙烯醛等物质的含量较高;稳定期的中期时1–辛烯–3–酮、(E,E)–2,4–癸二烯醛、(E)–2–己烯醛、异松油烯、冰片等物质的含量较高;衰亡期时1–丁醇、2–辛醇、氨、二甲基硫醚等物质的含量较高。不同生长时期的挥发性成分经 GC-IMS 检测存在明显的差异,通过 PLS-DA 可以很好地区分。本研究建立了不同时期微囊藻挥发性物质的指纹图谱和可视化微囊藻挥发性物质的轮廓。本方法操作简便快速,灵敏度高,稳定性好,可用于藻类水华爆发时水体中挥发性代谢物的筛查及确证,并为环境监测提供数据支持。
参考文献:
[1] DOKULIL M T, TEUBNER K. Cyanobacterial dominance in lakes[J]. Hydrobiologia, 2000, 438(1/3):1–12.
[2] YANGSB,CHENXL,LUJZ,etal. Impactsof agricultural topdressing practices on cyanobacterial bloom phenologyinanearlyeutrophicplateauLake,China[J]. Journal of Hydrology, 2021, 594:125952.
[3] SMITH G D, DOAN N T. Cyanobacterial metabolites with bioactivity against photosynthesis in cyanobacteria, algae and higher plants[J]. Journal of Applied Phycology, 1999, 11(4):337–344.
[4] PILOTTOLS,DOUGLASRM,BURCHMD,etal. Healtheffectsof exposuretocyanobacteria (blue –green algae) duringrecreationalwater –relatedactivities[J]. AustralianandNewZealandJournalofPublicHealth, 1997, 21(6):562–566.
[5] WATSON S B, MONIS P, BAKER P, et al. Biochemistry and genetics of taste- and odor-producing cyanobacteria[J]. Harmful Algae, 2016, 54:112–127.
[6] ZUOZJ,ZHUYR,BAIYL,etal. Volatile communication between Chlamydomonas reinhardtii cells under salt stress[J]. Biochemical Systematics and Ecology, 2012, 40:19–24.
[7] ZUO Z J, ZHU Y R, BAI Y L, et al. Acetic acid-induced programmedcelldeathandreleaseofvolatileorganic compoundsinChlamydomonasreinhardtii[J].Plant Physiology and Biochemistry, 2012, 51:175–184.
[8] WALSH K, JONES G J, DUNSTAN R H. Effect of high irradianceandirononvolatileodourcompoundsinthe cyanobacterium microcystis aeruginosa[J]. Phytochemistry, 1998, 49(5):1227–1239.
[9]甘麗平, 徐庆欢,杨王庭, 等. NaNO3胁迫对两种微囊藻 VOCs 释放的影响 [J].水生生物学报 , 2015, 39(4):782–788.
[10] J?TTNER F, WATSONS B, VON ELERT E,et al.β- cyclocitral,agrazerdefencesignaluniquetothe cyanobacteriumMicrocystis[J].JournalofChemical Ecology, 2010, 36(12):1387–1397.
[11]虞锐鹏, 王利平, 赵晨凯, 等.基于固相微萃取箭型-气相色谱-质谱法测定铜绿微囊藻中挥发性代谢物[J].分析化学, 2020, 48(6):750–756.
[12]谢玉芬, 张昆明, 杨文丽, 等.采用 GC-IMS 对4个薄荷品种不同组织部位挥发性物质的研究[J].食品与生物技术学报, 2021, 40(12):88–98.
[13] VAUTZW,SEIFERTL,MOHAMMADIM,etal. Detectionofaxillaryperspirationmetabolitesusingion mobilityspectrometrycoupledtorapidgas chromatography[J].AnalyticalandBioanalytical Chemistry, 2020, 412(1):223–232.
[14] DAURIZ M, MORICI N, GONZINI L, et al. Fifteen-year trends of cardiogenic shock and mortality inpatients with diabetes and acute coronary syndromes[J]. The American Journal of Medicine, 2020, 133(3):331–339.
[15] LI X, YU J W, GUO Q Y, et al. Source-water odor during winter in the Yellow River area of China: occurrence and diagnosis[J].EnvironmentalPollution,2016,218:252–258.
[16] GARRIDO-DELGADO R, DEL MAR DOBAO-PRIETO M, ARCE L, et al. Determination of volatile compounds by GC-IMS to assign the quality of virgin olive oil[J]. Food Chemistry, 2015, 187:572–579.
[17] JIN J Y, ZHAO M Y, ZHANG N, et al. Stableisotope signaturesversusgaschromatography-ionmobility spectrometry to determine the geographical origin of Fujian Oolong tea (Camellia sinensis) samples[J]. European Food Research and Technology, 2020, 246(5):955–964.
[18] MORAN M A, REISCH C R, KIENE R P, et al. Genomic insightsintobacterialDMSPtransformations[J]. Annual Review of Marine Science, 2012, 4:523–542.
[19] POHNERTG. PhospholipaseA2activitytriggersthe wound-activatedchemicaldefenseinthediatom Thalassiosirarotula[J]. PlantPhysiology, 2002, 129(1):103–111.
[20] HATANAKAA. Thebiogenerationofgreenodourbygreen leaves[J]. Phytochemistry, 1993, 34(5):1201–1218.
(编辑:董伟)

