老年阿尔茨海默病患者血清中TNF-α、M-CSF及miR-181a的表达水平及临床应用价值
付 丹,梁洪波,孙东鹏,李 斌
(1.江苏省徐州市东方人民医院老年精神科,江苏 徐州 221000;2.江苏省徐州市东方人民医院心理科,江苏 徐州 221000;3.江苏省徐州市东方人民医院精神科,江苏 徐州 221000)
阿尔茨海默病(Alzheimer′s disease,AD)是常见的中枢神经系统退行性疾病,不仅影响患者身体健康及生活质量,还给患者及家庭带来沉重的经济负担[1]。AD的发病机制尚不明确,目前认为其发生与基因(如淀粉样前体蛋白基因突变等)和环境因素(如生活习惯、慢性病等)有关[2]。深入研究影响AD发生的因素,寻找早期诊断AD的血清生物标志物,对AD的早期诊治具有重要意义。研究表明,AD的发生发展过程中涉及多种炎症细胞及炎症介质如肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)等的大量分泌[3]。TNF-α、M-CSF作为具有广泛生物活性的细胞因子,参与炎症和免疫应答的调控,但过度分泌时会导致炎症平衡失调,造成神经元组织的损伤,参与AD的发生发展[4-5]。微小RNA(microRNA, miR)是长度为20~24 nt的调控因子,研究表明,miR-181a通过海马及杏仁核α-氨基羟甲基恶唑丙酸受体调控突触可塑性,促进β淀粉样蛋白(Amyloid-beta peptide,Aβ)诱导的神经炎症反应,影响AD的发生发展过程,可作为AD早期诊断的分子标志物[6-7]。本研究观察AD患者血清TNF-α、M-CSF及miR-181a表达,探讨三者的临床意义。
1 资料与方法
1.1一般资料 选取自2017年1月—2019年1月期间我院诊治的140例AD患者为研究对象(AD组),男性55例,女性85例;年龄58~80岁,平均(70.15±7.27)岁;病程l~8年,平均病程(5.36±1.52)年。并根据临床痴呆量表评分[8],将AD组分为轻度组(1分)52例,中度组(2分)49例,重度组(3分)39例。病例纳入标准:①结合患者临床症状,体格检查及脑CT等检查,采用美国精神病学、语言障碍和卒中-老年痴呆和相关疾病学会制定的标准明确AD诊断;②临床资料完整;③患者家属对本研究知情同意并签字。排除标准:①血管性痴呆;②伴有抑郁,精神分裂症等精神障碍;③近3个月有急性炎症性疾病,代谢性疾病病史。以同期健康查体的50例健康者为对照组,男性25例,女性25例;年龄59~79岁,平均(68.58±6.25)岁。
本研究经医院伦理审核批准通过。
1.2方法
1.2.1采用实时荧光定量PCR法检测 血清miR-181a相对表达量留取AD组入院后即刻药物治疗前,对照组健康体检时清晨空腹静脉血5 mL,4 ℃、5 000 r/min离心5 min,取上层血清-80 ℃保存。应用Trizol试剂提取血清总RNA,应用Nanodrop 2 000c分光光度计 (美国,赛默飞公司)检测RNA浓度,OD260/OD280比值介于1.8~2.0。将总RNA反转录为cDNA,然后进行实时荧光定量PCR。miR-181a及内参U6引物序列由华大公司设计合成,miR-181a上游序列为5′-ACACTCCAGCTGGGAACATTCAACGCTGTC-3′,下游序列为5′-GTGTCGTGGAGTCGGCAA-TTC-3′;U6上游序列为5′-CTCGCTTCGGCAG-CACATA-3′,下游序列为5′-AACGATTCA-CGAATTTGCGT-3′。总体系:MasterMIX 5 μL,上、下游引物各0.5 μL,模板cDNA 1 μL,双蒸水补足至3 μL。条件:95 ℃ 2 min,95 ℃变性15 s,60 ℃退火 30 s,70 ℃延伸30 s,变性退火延伸共35个循环。采用2-△△CT法计算miR-181a的相对表达量。
1.2.2血清TNF-α、M-CSF水平检测 采用酶联免疫吸附实验检测血清TNF-α、M-CSF水平,试剂盒购自上海江莱生物公司,实验步骤严格按试剂盒说明书进行。简要步骤:微量反应板每孔加入标本50 μL。每孔加酶结合物50 μL,充分混匀,封板,37 ℃恒温箱中孵育30 min。洗涤液100 μL注满各孔洗涤5次。每孔加显色剂A液、B液各50 μL,充分混匀,封板,置37 ℃恒温箱孵育15 min。加终止液50 μL,充分混匀。用酶标仪读数,取波长450 nm,读取各孔OD值。根据标准品浓度的OD值,对应计算每孔样品的浓度值。
1.3统计学方法 应用SPSS 22.0统计软件进行数据分析。计量资料2组间比较采用t检验、F检验和SNK-q检验。计数资料比较采用χ2检验。Pearson相关分析AD患者血清TNF-α、M-CSF及miR-181a表达的相关性。受试者工作曲线(receiver operating characteristic, ROC)曲线分析血清TNF-α、M-CSF及miR-181a表达对AD的诊断价值。P<0.05为差异有统计学意义。
2 结 果
2.1AD组和对照组一般资料比较 AD组和对照组之间在性别、年龄、文化程度、人际活动、高血压史、冠心病史、糖尿病史、脑卒中史、吸烟史、饮酒史、TC、TG、HDL-C和LDL-C之间比较差异无统计学意义(均P<0.05)。见表1。

表1 AD组和对照组一般资料比较
2.2各组血清TNF-α、M-CSF及miR-181a水平比较 AD组血清TNF-α、M-CSF及miR-181a表达水平均明显高于对照组(t=49.291、30.485、28.313,均P<0.05)。对照组、轻、中、重度组间血清TNF-α、M-CSF及miR-181a表达差异有统计学意义(F=846.924、600.930、449.211,均P<0.05)。见表2。
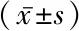
表2 各组血清TNF-α、M-CSF及miR-181a水平比较
2.3AD患者血清TNF-α、M-CSF及miR-181a表达的相关性 Pearson相关分析结果显示,AD患者血清TNF-α与M-CSF、miR-181a表达呈显著正相关(r=0.524、0.610,均P<0.05),M-CSF与miR-181a表达呈显著正相关(r=0.498,P<0.05)。
2.4影响AD发生的多因素Logistic回归分析 对影响AD的单因素进行多因素非条件 Logistic 回归分析,将血清TNF-α、M-CSF及miR-181a引入回归方程,结果提示血清TNF-α>27.18 ng/L、血清M-CSF>635.81 ng/L及血清miR-181a>1.83为影响AD发生的危险因素。见表3。
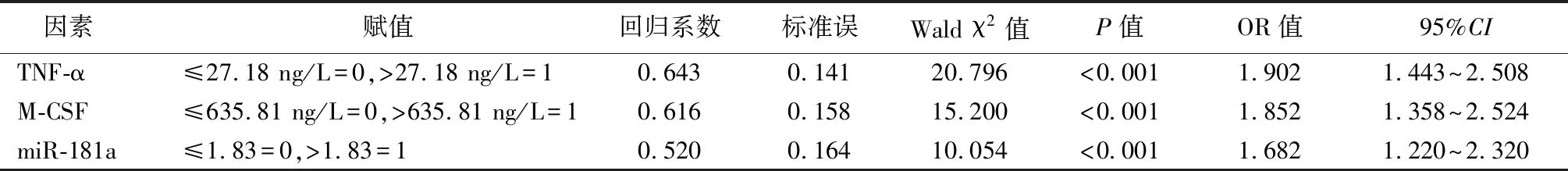
表3 影响AD发生的多因素Logistic回归分析
2.5血清TNF-α、M-CSF及miR-181a对AD的诊断价值 血清TNF-α、M-CSF及miR-181a的曲线下面积分别为0.741(95%CI:0.684~0.789)、0.693(95%CI:0.630~0.757)、0.727(95%CI:0.682~0.774)及0.862(95%CI:0.818~0.899),联合检测诊断AD的曲线下面积大于TNF-α、M-CSF及miR-181a单独诊断(Z=3.357、5.894、4.911,均P<0.05)。见表4,图1。
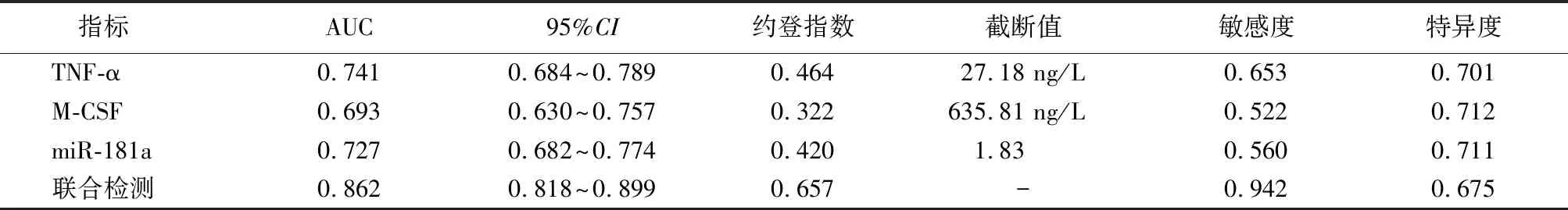
表4 血清TNF-α、M-CSF及miR-181a及联合检测对AD的诊断效能
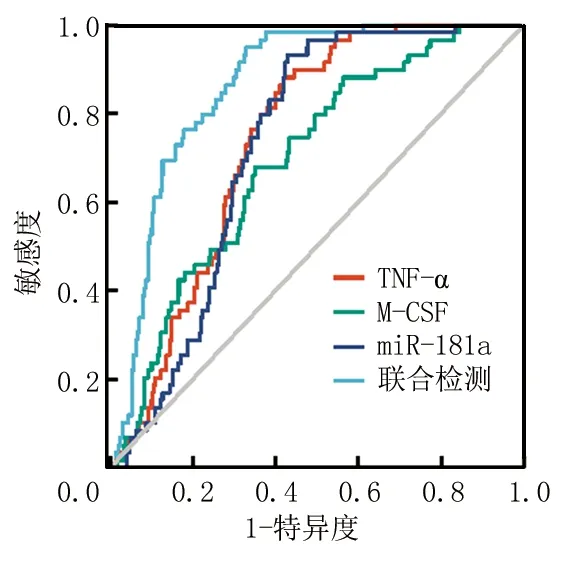
图1 ROC曲线分析血清TNF-α、M-CSF及miR-181a及联合检测对AD的诊断效能
3 讨 论
AD是一种渐进性的中枢神经系统变性疾病,表现为认知功能障碍、日常生活能力下降和行为改变,是造成老年痴呆的最主要原因[9]。AD的确切病因及机制尚不清楚,药物治疗只能延缓认知障碍的进程。因此,AD的早期诊断十分重要。目前对AD 的诊断主要依赖于临床症状、体格检查以及心理精神量表等,但对早期或非典型病例的诊断往往会存在偏倚[10]。近年来,通过影像学检查以及脑脊液检测也获得一些有价值的生物标志物,但由于价格昂贵、有创以及部分有辐射等原因,而限制其在临床的应用[11]。因此,探寻一种简便易得且能准确反映AD病理进程的外周血清标志物成为目前研究的热点。
淀粉样前体蛋白等基因的突变导致β前体样蛋白主要经β、γ分泌酶裂解为Aβ,Aβ大量聚集形成神经毒性的原纤维,促进AD的病情发展。Aβ沉积会诱发炎症反应,同时伴有如TNF-α、白细胞介素1及M-CSF等细胞因子的释放,加重炎性反应,促进AD患者神经元细胞凋亡[12]。炎性因子TNF-α、M-CSF在AD发生过程中发挥神经元毒性作用[13]。本研究中,AD 组血清TNF-α、M-CSF水平均高于对照组,并且TNF-α、M-CSF的表达与AD患者病情程度有关,是影响AD发生的危险因素,提示血清TNF-α、M-CSF表达升高可能通过激活体内炎性反应,促进AD疾病的发生及发展。分析其原因,一方面是AD发生时淀粉样蛋白的神经纤维缠结激活小胶质细胞并激活补体产生TNF-α、M-CSF等炎症因子,促进炎症反应的同时,通过其神经毒性促使神经元发生凋亡[14]。另一方面,淀粉样蛋白Aβ的沉积与氧自由基的产生密切相关,Aβ可诱发氧化应激,诱导超氧阴离子、羟自由基等活性氧物质的产生,促进活性氧自由基产生,产生氧化损伤,进而激活小胶质细胞和星形胶质细胞释放TNF-α、M-CSF等细胞因子,而TNF-α、M-CSF等能够损伤神经元,加重神经元炎症损伤,导致AD患者疾病程度加重[15]。此外,M-CSF是一个重要的促进增殖的造血生长因子,其可通过刺激骨髓来源的CD34+造血干细胞分化和激活,促进微环境中单核细胞、巨噬细胞和树突状细胞的扩增,分泌促炎性细胞因子,抑制脑组织中Aβ的清除,促进AD的疾病进展[5]。因此,血清TNF-α、M-CSF水平越高,反映AD患者神经元炎症性损伤更为严重,可能是评估AD疾病严重程度的血清标志物。
miRNA是短的非编码RNA,参与基因表达的转录后调控,与肿瘤、中风、糖尿病等疾病的发生发展关系密切。近年来发现,AD患者血清微小RNA存在异常表达的现象,可作为新的AD诊断的血清标志物[11]。miR-181a是啮齿类动物海马中丰富的微小RNA,可以调节多种与突触可塑性相关蛋白,如cAMP反应元件结合蛋白1、沉默信息调节因子1等的表达,影响学习和记忆功能[16]。本研究中,AD组血清miR-181a明显较高,与AD疾病严重程度有关,是影响AD发生的危险因素,提示miR-181a参与AD的疾病发生发展过程。既往研究表明,miR-181a在AD小鼠模型中的海马组织中以病理依赖的方式显著增加,并与可塑性相关蛋白水平降低相关[17]。miR-181a在调节活动依赖的突触可塑性和记忆形成中发挥着关键作用,其表达升高可能导致功能突触的加速丧失和认知功能衰退。笔者分析,血清miR-181水平升高能够通过促进tau蛋白的过量表达和异常过度磷酸化,导致AD疾病严重程度加重。研究发现,在AD小鼠模型中miR-181a能够促进了海马中可溶性和突触体富集的tau蛋白的形成,突触中tau蛋白的积累能够诱导NMDA受体N-甲基-D-天冬氨酸受体亚基2B亚基的磷酸化,引起神经元的兴奋性毒性损伤,导致AD疾病的发生发展[18]。尚有研究表明,miR-181a可以负向控制蛋白激酶AMP激活的催化亚基α1的表达,降低腺苷酸活化蛋白激酶的活性,抑制哺乳动物雷帕霉素信号通路,促进神经退行性小鼠模型大脑中tau蛋白的总量和磷酸化水平,导致AD的进展[19]。因此,miR-181a在控制突触可塑性中的潜在机制使其成为潜在的AD的标记物和治疗靶点。
相关性分析发现,AD患者血清miR-181a与TNF-α、M-CSF表达呈显著正相关,笔者分析其原因,可能是miR-181a的表达升高促进tau的异常磷酸化激活,造成神经元兴奋性毒性损害,激活局部微环境中免疫细胞,造成继发性的炎症反应,促进TNF-α、M-CSF的分泌[20]。此外,TNF-α作为重要的细胞因子,亦能调控细胞内miR-181a的表达。研究表明,TNF-α能够通过激活细胞表面的胰岛素受体,促进细胞内miR-181a及miR-23a-3p的表达,参与胰岛素抵抗的形成[21]。但AD中三者的具体作用机制仍有待深入研究。通过对血清中TNF-α、M-CSF、miR-181a及联合检测的敏感度、特异度和曲线下面积进行分析,血清TNF-α、M-CSF、miR-181a联合检测的敏感度、特异度及曲线下面积较高,提示,联合三者检测可以作为早期诊断AD的重要指标,不仅为AD的早期诊断提供了更有意义的生物标志物,也为其早期诊断依据提供了新的思路。
综上所述,AD患者血清TNF-α、M-CSF及miR-181a表达升高,与疾病严重程度有关,三者联合检测对AD具有较高的诊断价值。血清TNF-α>27.18 ng/L、血清M-CSF>635.81 ng/L及血清miR-181a>1.83为影响AD发生的危险因素。但本研究样本量较小, TNF-α、M-CSF及miR-181a在AD发病中的具体作用机制尚需扩大样本量进一步研究。

