QTRT1表达与肾透明细胞癌预后及肿瘤免疫的相关性
王天云,奎 翔,赵春梅,王 燕
(昆明医科大学第二附属医院病理科,云南 昆明 650032)
肾细胞癌(renal cell carcinoma,RCC)是高发的泌尿系统肿瘤,相关报告显示,2020年RCC的新发病例共计431 000例,并有179 000例因RCC死亡[1],其中KIRC是肾细胞癌发病率最高的亚型[2]。由于对化疗药物耐药和对放疗不敏感,KIRC仍以手术切除作为主要的治疗方式[3]。该病早期无特异性临床表现,因此其早期诊断率较低,约1/3的患者在初诊时已发生扩散或转移;即使在手术切除后,仍有近1/3的患者出现复发或转移[4]。队列tRNA-核糖基转移酶1(queuine tRNA-ribosyl transferase 1,QTRT1),有时也称为tRNA-鸟嘌呤转糖基酶 (tRNA-guanine trans glycosylase,TGT),位于染色体19p13[5],包含10个外显子,大约为12 kb。QTRT酶由基因QTRT1编码,其分子功能是鸟嘌呤与34位的Q碱交换,从而产生超修饰的转运RNA(transfer RNA,tRNA)[6]。QTRT1是参与 tRNA转录后修饰的关键酶,这些tRNA是蛋白质合成和细胞信号网络的核心组成部分,它们的调节可以影响肿瘤进展[7]。研究[8-10]显示,QTRT1可能通过调节 tRNA参与人结肠腺癌的癌变过程,并且在肺腺癌中显示了QTRT1的预后价值。然而,QTRT1在KIRC中的作用价值仍然未知,与之相关的研究尚未见报道,现通过数据挖掘探讨其在KIRC中的潜在作用,对QTRT1与KIRC之间的关系进行研究,本研究的主要方法是基于Cancer Genome Atlas database(TCGA)数据库,联合多个在线数据库进行数据挖掘,以生物信息学的方法探索QTRT1对KIRC预后以及免疫的影响。
1 资料与方法
1.1分析数据来源 TCGA中KIRC表达谱及表型数据于2022年2月5日下载 (https://xenabrowser.net/datapages/)。验证的转录组数据GSE40435[11]来自于GEO数据库(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi )。
1.2数据处理 所有下载的数据都经过R软件进行标准化(版本为4.1.2 https://www.r-project.org/ )。
1.3QTRT1蛋白表达分析 R软件中的“dplyr”包用于对QTRT1与患者临床病理参数间的联系进行分析。
使用人类蛋白质图谱(The Human Protein Atlas HPA, http://www.proteinatlas.org/ )在线数据库进行QTRT1蛋白在KIRC中表达的分析。
1.4QTRT1与KIRC患者的预后 使用R软件的“survival”包研究QTRT1表达对KIRC患者预后的影响,并利用“rms”包构建与预后有关的列线图模型。
1.5基因,蛋白相互作用网络分析 联合使用STRING(https://cn.string-db.org/),GENEMAIN(http://genemania.org)2个在线数据库构建蛋白及基因相互作用网络。
1.6QTRT1的基因富集分析 利用基因集富集分析(Gene Set Enrichment Analysis,GSEA)软件进行京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析(版本4.2.1 http://www.gsea-msigdb.org/gsea/index.jsp)。
1.7QTRT1与KIRC免疫间的关系 联合使用Sangerbox 3.0(http://vip.sangerbox.com/home.html)、Gene Expression Profiling interactive Analysis 2(GEPIA2,http://gepia2.cancer-pku.cn/#index)和TIMER2.0(timer.cistrome.org)等3个在线平台进行免疫相关分析。
1.8辅以实时荧光定量多聚核苷酸链式反应(real-time quartiative polymerase chain reaction,qRT-PCR)法检测KIRC细胞和正常肾小管上皮细胞中的表达情况 试验所用的KIRC细胞包括786-O细胞以及Caki-2细胞,正常肾小管上皮细胞为HK2细胞,以上细胞购于武汉普诺赛细胞库。786-O细胞以10%胎牛血清+1%青霉素和链霉素的1640完全培养基培养,Caki-2细胞以10%胎牛血清+1%青霉素和链霉素的McCoy′s完全培养基培养,HK2细胞以10%胎牛血清+1%青霉素和链霉素的DMEM完全培养基培养。在细胞长满一个T25培养瓶后提取RNA进行qRT-PCR试验(试剂为Takara体系)。使用引物:QTRT1:上游-5′ GAAGGGCATCACGACCGAA-3′,下游-5′ CCCGGCCTTAGACCCAGAT-3′;内参引物β-actin:上游-5′-CTCGCCTTTGCCGATCC-3′,下游-5′-TTCTCCATGTCGTCCCAGTT-3′。所得结果使用2-△△Ct法进行数据转化。
1.9统计学方法 使用R软件分析数据。计量资料比较采用秩和检验、t检验、单因素方差分析和SNK-q检验,计数资料比较采用χ2检验,生存预后分析使用Kaplan-Meier(K-M)生存分析中的log-rank法。P<0.05为差异有统计学意义。
2 结 果
2.1QTRT1的转录组水平表达 通过对TCGA的535例癌和72例正常组织进行秩和检验显示,KIRC组织中QTRT1的表达显著高于正常组织,差异有统计学意义(P<0.05),见表1。为了排除同一数据集的干扰,GSE40435数据集被用于对结论进行验证,结果与TCGA数据一致(P<0.05),见表2。KIRC细胞780-O和Caki-2中QTRT1的mRNA表达强度明显强于正常肾小管上皮细胞HK2,差异有统计学意义(P<0.05),见表3。
2.2QTRT1的表达与KIRC临床病理参数的关系及该蛋白的表达 将KIRC患者按QTRT1 mRNA表达量的中位数分为QTRT1高表达组和低表达组,并利用卡方检验研究QTRT1表达与KIRC临床病理参数的相关性。QTRT1的mRNA表达在T分期和临床分期的不同组别间比较差异有统计学意义(P<0.05),见表4。HPA数据库中收录了QTRT1的免疫组化染色结果,通过检索HPA数据库,显示QTRT1蛋白呈现胞浆阳性表达,同时在KIRC组织中检测到中等强度表达,在正常肾组织中检测到低强度表达,见图1。

表1 TCGA统计数据比较

表2 TCGA统计数据比较
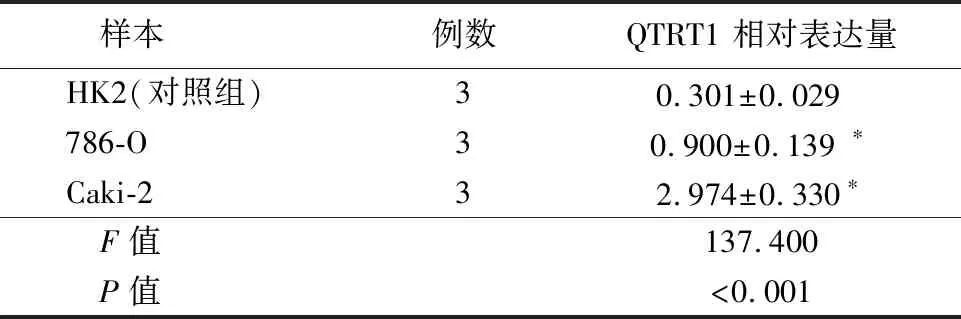
表3 细胞统计数据比较

表4 QTRT1 mRNA表达在临床病理特征组间的比较
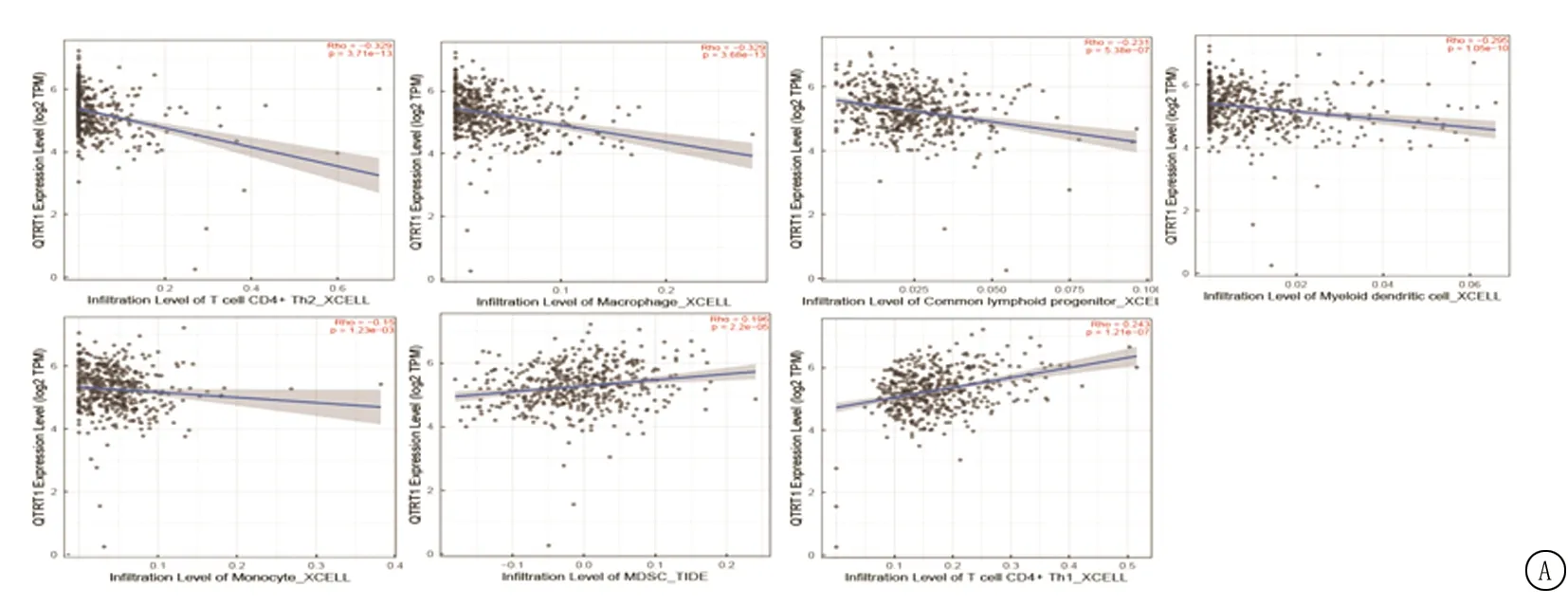
2.3KIRC预后模型 首先在生存分析中,按QTRT1 mRNA表达量的中位数将患者分为高表达组和低表达组,结果显示,QTRT1的基因表达与患者总生存期(overall survival,OS),无进展生存期(progression-free survival,PFS)均为正相关(P<0.05),见图2。以 临床分期(Ⅰ+Ⅱ=0,Ⅲ+Ⅳ=1)、年龄(<65岁=0,≥65岁=1)、分级(<3级=0,3+4级=1)、M 分期(非M1分期=0,M1分期=1)、T 分期( 图1 QTRT1蛋白在正常肾组织和KIRC组织中的表达 图2 QTRT1mRNA表达与预后 图3 多因素Cox分析森林图 基于对TCGA数据,本研究构建了预后相关列线图,利用该图,可以估算KIRC患者的1年、3年和5年OS(图4A)。该列线图的曲线下面积(area under curve,AUC)分别为1年0.84、3年0.81、5年0.78(图4B);C-指数为0.77,说明列线图具有较合适的预测强度。如图4C所示的列线图校准曲线进一步验证该模型的使用效能。 表5 多因素Cox分析 图4 预后列线图 2.4基因-基因相互作用(gene-gene interaction,GGI)网络及蛋白质-蛋白质相互作用(protein-protein interaction,PPI)网络构建 GeneMANIA被用于构建与QTRT1有关的GGI网络,网络中包含的相互作用形式包括物理相互作用(physical interactions),共表达(co-expression),预测(predicted),共定位(co-localization),遗传相互作用(genetic interactions),通路(pathway),见图5A,共有19种与QTRT1最具相互作用关系的基因被展示。同时利用STRING平台构建PPI网络,并显示了与QTRT1相互作用的10种蛋白质,见图5B。 图5 基因、蛋白相互作用网络 2.5GSEA富集分析和肿瘤突变负荷(tumor mutation burden,TMB) 通过GSEA软件得到了赖氨酸降解(KEGG_LYSI NE_D EGRADATION), 甘油脂代谢(KEGG_GLYCEROLIPID_METABOLISM),溶酶体(KEGG_LYSOSOME),泛酸和辅酶A 生物合成(KEGG_PANTOTHENATE_AND_COA_BIOSYNTHESIS)等4种与QTRT1表达有关的信号通路(图6A,表6)。利用Sangerbox得到了QTRT1与肿瘤突变负荷Tumor Mutation Burden(TMB)间的关系,在KIRC中QTRT1与TMB呈现正相关(P<0.05,R>0,图6B)。 图6 GSEA富集分析 表6 QTRT1富集分析结果。 2.6QTRT1与免疫之间的关系 利用TIMRE2.0网站,并使用其中的XCell算法,探究QTRT1mRNA表达同免疫细胞浸润之间的关系。在众多的免疫细胞中,CD4阳性的Th1细胞(P<0.001,r=-0.329)、巨噬细胞(P<0.001,r=-0.329)、淋巴样祖细胞(P<0.001,r=-0.231)、树突状细胞(P<0.001,r=-0.295)、单核细胞(P<0.001,r=-0.15)等5种免疫细胞的浸润程度与QTRT1表达呈现负相关,而CD4阳性的Th2细胞(P<0.001,r=0.243)呈现正相关。并且,还用TIDE算法研究QTRT1与髓源抑制性细胞(myeloid-derived suppressor cells MDSCs)间的联系,显示MDSCs与QTRT1正相关(P<0.001,r=0.196如图7A所示)。此外,QTRT1与多个免疫检查点基因和免疫细胞途径均具有强相关性(P<0.001),见图7B,C。在Stromal Score评分模式下,KIRC中QTRT1的表达与免疫微环境显著负相关,见图7D。最后使用GEPIA2网站进行了QTRT1与3个常用的免疫检查点基因相关性的研究,见图7E,QTRT1与PTCD1(PD1)、CD152(CTLA4)免疫检查点分子显著正相关(P<0.05,r>0)。以上结果都说明QTRT1与KIRC的免疫密切相关。 图7 QTRT1与肿瘤免疫的关系 TCGA、GEO等众多生物医学数据库的建立,使得分子生物数据得以共享,加之计算机科学和统计学的迅猛发展,生信分析技术日趋成熟。通过生信分析得出初步结论,再进行实验和临床研究验证,大大节省了研究资金和时间,也为科学研究带来了更多的思路和方向[12-13]。如前所述,已有研究报告了QTRT1与结直肠癌、肺腺癌等肿瘤的联系,但该基因与KIRC间关系的研究尚未见报道。生信分析显示QTRT1在KIRC中显著上调,并且肿瘤的分期愈高该基因的表达也愈高。同时在Caki-2和786-O肾癌细胞系中,QTRT1 mRNA的表达水平明显强于正常肾小管上皮细胞HK-2。而在HPA数据库中,通过检索显示QTRT1蛋白在KIRC中为胞浆阳性表达,并且其在癌和正常组织中表达强度差异有统计学意义。K-M曲线显示,高表达的QTRT1是KIRC患者的不良预后因素。Cox回归分析进一步提示QTRT1和年龄、分级、M 分期可以作为KIRC患者OS的独立预后因素。根据现有数据可以构建以QTRT1和年龄、分级、M分期等参数为基础的列线图预后模型;当已知KIRC患者的上述参数时,根据模型计算出总分数,就能得出患者的1年、3年、5年OS的概率。因此,本研究构建了基于QTRT1表达的列线图模型,该模型可以更加精确地指导KIRC患者的预后。 在GSEA富集分析中,QTRT1高度富集的4个信号通路被筛选出来,这些通路可以帮助我们更好地理解KIRC致病的病理生理机制。GGI和PPI相互作用网络的构建呈现了多个与QTRT1有关的生物分子,这些生物分子的显示给KIRC的研究带来了更多的思路和切入点。 恶性肿瘤的高发病率和高病死率是现代医学无法回避的问题,而在抗击肿瘤的道路上,人类取得了斐然的成绩,先后创立了多种治疗方式。其中免疫治疗是近30年来发展壮大的临床治疗方法,已经在多种肿瘤中运用,并取得了理想的治疗效果,如运用于恶性黑色素瘤、肺癌和淋巴瘤[14-16]。免疫治疗对患者正常细胞的影响较小,是一种相对安全的方法,免疫治疗也是当下的研究热点。本研究QTRT1与TMB免疫治疗效果预测因子联系紧密,猜测后者可以在预测KIRC患者免疫治疗反应中发挥作用。此外,在KIRC中QTRT1与CD4阳性的Th1、巨噬细胞、淋巴样祖细胞、树突状细胞、单核细胞负相关,同时其表达与MDSC的浸润程度正相关,可能导致肿瘤免疫微环境的抑制。MDSCs来源于骨髓,对免疫系统有抑制作用。MDSC可以产生一氧化氮和活性氧,后者可以硝酸化趋化因子并阻止CD8+T细胞进入肿瘤[17]。MDSC会产生免疫抑制细胞因子,包括 IL-10和TGF-β,会诱导T细胞生成。研究[18-21]表明,MDSCs 与肝细胞癌、胰腺癌、乙型肝炎、尿路上皮癌等疾病的预后和治疗密切相关。因此QTRT1可能参与塑造了KIRC中免疫抑制的微环境,这很可能造成该肿瘤的进一步发展并影响患者预后(QTRT1作为预后不良因子的佐证),免疫抑制状态也是一把双刃剑,当消除其干扰时,也可能使肿瘤摆脱免疫抑制并激活免疫系统的抗肿瘤作用。同时,在KIRC中QTRT1还与多个免疫检查点(如PD1和CTLA4等)具有显著相关性。 本研究不仅通过TCGA数据集和GEO数据集分析了QTRT1 mRNA在人体组织中的表达,还通过qRT-PCR实验在细胞水平上进行基因表达验证,同时通过HPA数据库探寻其蛋白质表达,从基因到蛋白全面分析了该因子的表达情况。 此外,还分析了KIRC中QTRT1的多种元素,包括列线图、GSEA、TMB、PPI、GGI、肿瘤免疫浸润、免疫细胞通路和检查点分子。 综上所述,QTRT1是KIRC的潜在预后因子,与4种信号通路相关,还与免疫治疗密切相关。但是,本研究同样存在不足之处。由于是回顾性数据,来自TCGA的临床信息有限,无法获得各种重要数据,包括潜在的慢性疾病、免疫疗法的使用、肾切除术后复发等。研究主要基于生信分析,缺少基础实验验证。TCGA中正常肾组织(N = 72)的样本量相对较小,这可能会导致一些偏差。






3 讨 论

