M/Co3O4(M=Fe、Ni)的简易制备及其催化NaBH4水解制氢
吴龙祥 杨茂 张浩东 赵国栋 刘永辉 王小炼

摘 要:为提高硼氢化钠水解放氢速率,采用简单易操作的微波辐射—多元醇法制备低成本负载型非贵金属催化剂M/Co3O4(M=Fe、Ni)催化硼氢化钠水解制氢.研究发现,M/Co3O4对硼氢化钠水解具有显著的催化作用,且Fe/Co3O4具有更好的催化性能.在催化剂添加量为12.5 wt.%,水料比为50 mL/g和水解温度为40 ℃的条件下,Fe/Co3O4催化硼氢化钠在10.3 min内的放氢量达2 445.4 mL/g,对应的放氢速率和产氢率分别为237.4 mL/(min·g)和94.1%.
關键词:硼氢化钠;水解制氢;Fe/Co3O4;Ni/Co3O4
中图分类号:O643.3;TQ116.2;TK91
文献标志码:A
文章编号:1004-5422(2023)03-0298-09DOI:10.3969/j.issn.1004-5422.2023.03.012
0 引 言
固体储氢材料水解制氢是较为成熟和环保的制氢技术[1].硼氢化钠(NaBH4)凭借其储氢密度大、反应条件温和[2],以及反应产物对环境无害[3]等优点在众多储氢材料中脱颖而出.然而,NaBH4在25 ℃条件下的产氢率仅有2.17 wt.%[4],故需要高效率的催化剂来加快反应速率.以往的研究表明,含钌(Ru)[5-6]、铂(Pt)[6-7]和钯(Pd)[6,8-9]等贵金属的催化剂对NaBH4水解具有优异的催化效果,其放氢速率分别可达18 600、29 600和3 641.4 mL/(min·g),但贵金属成本高和储量稀少等问题使得其缺乏实用价值[10].
贵金属催化剂的昂贵与稀缺促使科研人员加快了寻找替代材料的步伐[11],钴(Co)和镍(Ni)等非贵金属催化剂因其显著的催化性能成为了研究重点[12-13].大量研究发现,基于Co和Ni等非贵金属的催化剂在催化NaBH4水解方面同样表现出良好的催化性能[14-15].Bozkurt等[16]采用四氧化三钴(Co3O4)负载Co制备的Co-Co3O4催化剂催化NaBH4水解的产氢速率可达2 823 mL/(min·g),大于使用贵金属复合材料催化剂Ni35Fe35Pd30时1 556 mL/(min·g)的产氢速率[17];Dnmez等[18]在10 wt.%的NaBH4溶液中加入5 mL NaOH,添加50 wt.%的催化剂Ni/TiO2,并在60 ℃温度下反应,最终测定的产氢率可达100%.Nie等[2]利用NiCl2、FeCl3和NaBH4的混合溶液,通过化学还原法制备了Ni-Fe-B催化剂,并探究其对NaBH4水解的影响,最终的产氢速率为2 910 mL/(min·g),但制备过程使用了强碱,具有危险性.目前,还鲜有具体探究非贵金属Fe和Co3O4的直接相互作用对NaBH4水解制氢的影响.为探究Co3O4与非贵金属Fe和Ni直接的相互作用对NaBH4水解制氢的影响,同时降低催化剂制备的成本和危险性,在本研究中,采用微波辐射—多元醇法[19]制备的负载型M/Co3O4催化剂用于催化NaBH4水解制氢,并采用控制变量法系统研究催化剂添加方式、催化剂添加量、水料比和水解温度等反应影响因素对NaBH4水解制氢性能的影响.
1 材料与方法
1.1 仪 器
DX-2700B型X射线衍射仪(XRD)(丹东浩元仪器有限公司),FEI Inspect F50型场发射扫描电子显微镜(SEM)(赛默飞世尔科技公司),KQ-3200DE型超声均质器(昆山市超声仪器有限公司),M1-L213C微波炉(美的集团),DHG-9030A型电热恒温鼓风干燥箱(上海鸿都电子科技有限公司),LD3100-1型电子天平(沈阳龙腾电子有限公司).
1.2 材 料
NaBH4(98.0%),购自上海提坦科技有限公司;六水合氯化镍(NiCl2·6H2O,98.0%),购自成都市科龙化工试剂厂;Co3O4(99.5%),购自阿拉丁试剂有限公司;氯化铁(FeCl3,98.0%),购自上海山浦化工有限公司;丙酮(CH3COCH3,99.5%)、乙二醇((CH2OH)2,99.5%),均购自成都长联化工试剂有限公司.所有试剂均为分析纯,在实验中未经进一步纯化原样使用.
1.3 催化剂的制备
本研究采用微波辐射—多元醇法[20]制备负载型催化剂M/Co3O4.其中,Fe/Co3O4催化剂的制备是先将FeCl3溶于100 mL去离子水中配置浓度为0.1 mol/L的FeCl3溶液,然后加入50 mL(CH2OH)2和2.234 g(调控Fe元素的质量分数为20%)载体材料Co3O4,并使用超声均质器将配好的混合物均质0.5 h.超声结束后,放入微波炉中加热90 s取出,冷却至室温后继续搅拌至均匀,接着分别使用CH3COCH3和去离子水分别对其进行离心洗涤处理(离心参数设置为1 000 r/min,离心时间为3 min).最后将离心洗涤所得沉淀在100 ℃烘箱中干燥12 h.Ni/Co3O4催化剂的制备采用同样的步骤,不同之处是将FeCl3换成NiCl2·6H2O,并添加2.348 g载体材料配置成浓度为0.1 mol/L的NiCl2·6H2O溶液.
1.4 水解实验
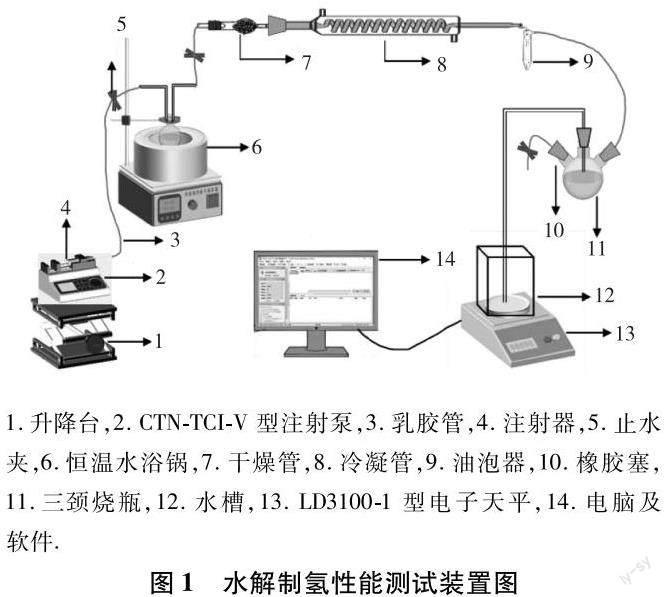
水解实验是在基于排水集气法的实验装置中进行(见图1).称量0.2 g的NaBH4和催化剂的混合物装入圆底烧瓶中,再将圆底烧瓶置于恒温水浴锅中,依次连接好各个器材并检查气密性.调节磁力搅拌的转速为400 r/min,通过注射泵将去离子水以100 mL/h的注射速率加入圆底烧瓶中.当水和反应混合物接触后通过电脑和天平实时观察和记录氢气的体积(即排出水的质量).为确保实验数据的科学性,每组实验至少重复3次,得到的数据平均后作为最终结果.为减小水解过程中气体冷热膨胀带来的数据误差,将持续对产生的气体进行冷却.
1.5 组织结构表征
本研究所用原料、制备的催化剂和水解固相产物的物相采用XRD分析,测试采用CuKα辐射,石墨单色仪,步进角度为0.02°,采样时间为0.5 s,扫描范围为10°~90°;催化剂和水解固相产物的表面形貌采用SEM分析.
2 结果与分析
2.1 水解原料及催化剂的物相分析
图2为Co3O4、Fe/Co3O4和Ni/Co3O4的XRD测试结果.如图所示,在Fe/Co3O4和Ni/Co3O4催化剂中检测到有Fe和Ni元素的特征峰存在,这表明微波辐射—多元醇法成功将非贵金属元素Fe和Ni负载到了载体材料上.进一步分析表明,Fe(PDF#50-1275)在2θ值为44.67°处的特征峰对应其(110)晶面,与Co3O4(PDF#43-1003)在2θ值为44.81°处的特征峰相互叠加,叠加后的特征峰主峰相对于Co3O4的特征峰蓝移约0.10°.同样,Ni(PDF#20-0781)在2θ值为44.50°处的特征峰对应其(011)晶面,与Co3O4在2θ值为44.81°处的特征峰相互叠加,叠加后的特征峰相对于Co3O4的特征峰蓝移约0.30°.
2.2 水解放氢性能研究
2.2.1 催化剂添加方式对NaBH4水解放氢性能的影响
催化剂添加方式对催化剂催化水解制氢的性能有重要影响,因为球磨可以使得原料颗粒更加细化并暴露更多的表面积,有利于水解反应的进行,但有时球磨过后的催化剂催化水解性能并无明显改善,而且长时间的球磨反而增加了制备成本[20].因此,本研究首先探究了M/Co3O4催化剂添加方式对NaBH4水解性能的影响.直接添加是将催化剂与NaBH4直接混合进行反应,球磨添加是将催化剂和NaBH4一起球磨不同时间后再进行反应,图3为对应的放氢曲线.其中,催化剂添加量为10 wt.%,水料比为50 mL/g,水解温度为40 ℃,相对应的数据见表1.
由图3(A)和表1可知,直接添加催化剂Fe/Co3O4制备的Fe/Co3O4-NaBH4混合物的放氢速率为190.0 mL/(min·g),虽然放氢速率相对较低,但放氢量和产氢率分别达到2 489.6 mL/g和97.8%,皆为最佳.由图3(B)和表1可以得到,直接添加Ni/Co3O4催化剂制备的Ni/Co3O4-NaBH4混合物与球磨制备的混合物相比放氢速率略低,但放氢量和产氢率都明显高于其他对照组.
综合对比表1数据可知,直接添加催化剂催化NaBH4水解整体效果最好,说明长时间球磨并不能大幅提高水解放氢性能,且长时间球磨工艺也具有一定的复杂性,生产成本较高,故后续研究将采用直接添加M/Co3O4催化剂催化NaBH4水解的方式.
2.2.2 催化剂添加量对NaBH4水解放氢性能的影响
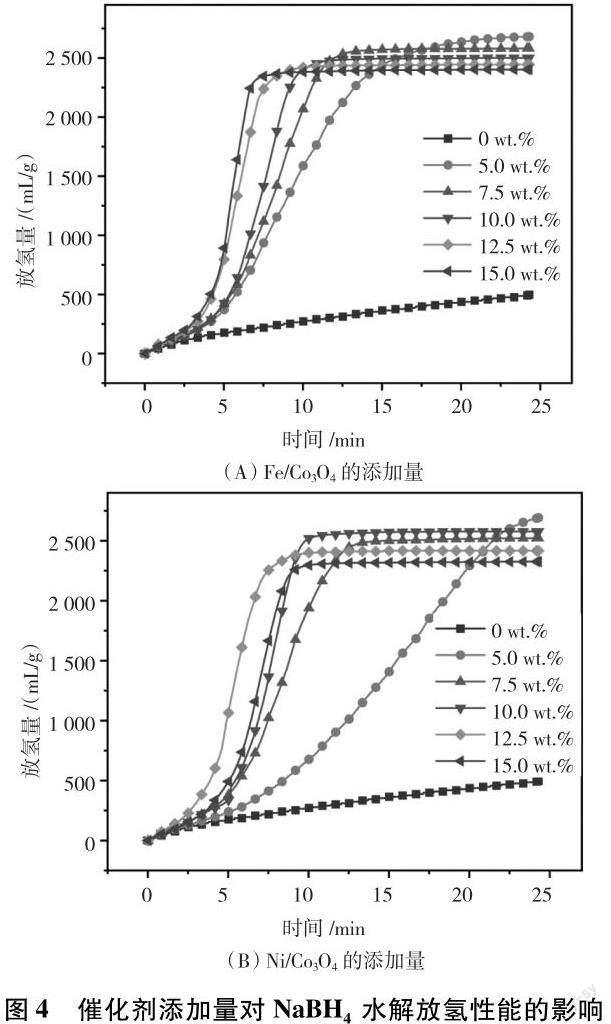
图4为不同含量的催化剂(xM/Co3O4,x=0 wt.%~15 wt.%)催化NaBH4水解的放氢曲线(水料比为50 mL/g,水解温度40 ℃),对应的放氢性能数据见表2.如图4和表2所示,M/Co3O4-NaBH4混合物的放氢速率随着催化剂添加量的增加而逐渐增加,但放氢总量和产氢率却在下降.并且可以进一步观察到,10 wt.%的添加量更适合Ni/Co3O4-NaBH4混合物水解反应的进行,但其产氢率相比于xFe/Co3O4-NaBH4混合物更低,反应时间也更长.可以明显看出,相比于无催化剂NaBH4的水解过程,Fe/Co3O4对NaBH4的水解起着显著的催化作用,但对于Ni/Co3O4催化剂,若添加过多反而会影响放氢量,这可能是因为催化剂过多会产生过量的反应物,导致其浓度过大,影响了催化剂性能[21-22].
为了进一步确定2种混合物的水解性能,对比表2中xFe/Co3O4和xNi/Co3O4(x=7.5 wt.%~15 wt.%)催化剂催化NaBH4水解的放氢性能.可以观察到,xFe/Co3O4的整体催化性能都要优于xNi/Co3O4,再考虑到节约成本和产氢效率高等要求,确定了12.5 wt.%Fe/Co3O4-NaBH4混合物的制氢效果最理想.
2.2.3 水料比对NaBH4水解放氢性能的影响
图5为12.5 wt.%Fe/Co3O4-NaBH4混合物在不同水料比(25、50和75 mL/g)下的水解放氢曲线(水解温度40 ℃).如图5所示,随着水料比从25 mL/g增加到50 mL/g,12.5 wt.%Fe/Co3O4-NaBH4混合物的水解放氢速率先增加后降低,水解放氢量和产氢率虽然保持增加,但时间越长,增长率越小.当水料比为50 mL/g时,12.5 wt.%Fe/Co3O4-NaBH4混合物具有最佳的水解放氢性能,其在12 min内放氢量约为2 405 mL/g,大于采用25 mL/g水料比时的2 266 mL/g放氢量,这可能是因为水料比过低不利于反应物和去离子水的充分接触.虽然采用75 mL/g水料比时的产氢率与50 mL/g时相当,但出于节约环保考虑,并考虑放氢速率较快的同时也获得最大实际放氢量,故选择50 mL/g水料比作为催化NaBH4水解的最佳水料比.
2.2.4 水解温度对NaBH4水解放氢性能的影响
图6为12.5 wt.%Fe/Co3O4-NaBH4且水料比为50 mL/g的混合物在不同水解温度(20~60 ℃)下的水解放氢曲线,相对应的放氢性能数据见表3.由图6可知,随着水解反应温度的升高,NaBH4水解放氢速率显著提高,特別是在30~40 ℃水解温度区间,水解放氢速率的提高特别明显.40 ℃的水解放氢速率(237.4 mL/(min·g))是30 ℃的水解放氢速率(25.8 mL/(min·g))的9.2倍,这是因为水解温度升高,分子运动更加剧烈,反应达到活化能也越容易,反应就越快,但当温度高于40 ℃时,放氢量不再有明显变化.而水解温度为20和30 ℃时,放氢速度
非常缓慢,25 min内实际放氢总量仅为292.5和619.0 mL/g,产氢率仅为11.3%和25.3%,说明低温条件下NaBH4水解性能即使加了催化剂也不佳.
再对比表3内各水解温度下的水解数据可知,在40 ℃时混合物的产氢率为94.1%,为最好性能,且产氢速率和实际放氢量也较理想.综合考虑反应时长、原料利用率和实际生产环境等因素,确定40 ℃的水解温度为最佳反应温度.
2.3 原料与水解产物分析
图7(A)和图7(B)为12.5 wt.%Fe/Co3O4-NaBH4混合物在最佳反应条件下进行充分水解反应后上清液干燥后所得产物的XRD图谱和同样反应条件下水解反应产物沉淀干燥后的XRD图谱.如图7(B)所示,反应产物沉淀的XRD图谱在2θ值为31.27°、36.85°、44.80°和59.35°的衍射峰分别对应于Co3O4(PDF#43-1003)的(220)、(311)、(400)和(511)晶面;同理,2θ值为44.30°的衍射峰对应于FeO(PDF#49-1447)的(101)晶面.
图7(A)所示的XRD图谱中,上清液干燥后所得产物中检测到了以NaBO2·2H2O(PDF#06-0122)为主的化合物存在,同时还检测到了Fe(OH)2(PDF#13-0089)、Fe2O3(PDF#40-1139)和Fe3O4(PDF#26-1136)等化合物成分.进一步分析表明,NaBO2·2H2O在2θ值为16.75°和31.14°的衍射峰对应其(020)和(121)晶面.Fe(OH)2在2θ值为19.29°的特征峰对应其(001)晶面,其可能与Co(OH)2(PDF#02-0925)在2θ值为19.16°的特征峰产生重叠.同时,图7(A)中还出现了Fe2O3和NaBO2的特征峰,并伴随一些Fe、Co、B和Na等元素的复杂化合物,说明水解反应进行正常[3].
图7(C)和图7(D)为Co3O4负载Fe后的SEM图.由图7(C)可知,Co3O4在20 000倍放大倍数下的SEM图中呈现出直径约为5 μm且表面凹凸不平的球状,这能够增大表面积,从而有利于负载其他金属.由图7(D)可知,Fe/Co3O4的表面在100 000倍放大倍数下可观察到存在小孔穴,这些小孔穴可能是水解反应的发生路径.
图7(E)和图7(F)为12.5 wt.%Fe/Co3O4-NaBH4混合物水解反应后的黑色沉淀经过干燥后的SEM图.在20 000倍和50 000倍放大倍数下的SEM图中可以观察到,沉淀仍呈现表面粗糙不平整的球状,还存在瘪缩和团簇现象,这是因为随着反应的进行,部分水解产物吸附在催化剂表面,故发生了瘪缩和团簇,并导致Co3O4表面负载的部分Fe被覆盖,在一定程度上阻碍了NaBH4与催化剂的充分接触,这也是产氢率未能到达100%的原因之一.进一步观察可以看到,沉淀物表面形成了层片状结构,结合XRD图对比,沉积物可能是Fe及其氧化物和偏硼酸盐(NaBO2),且证明了反应产物中仍有Co3O4存在,说明沉淀还可以回收利用.
2.4 不同催化剂催化NaBH4水解性能比较
为了更好地说明Fe/Co3O4催化剂优异的性能,表4给出了相关文献中的NaBH4水解相关数据.从表中可以看出,仅用酸和非Co基催化剂催化NaBH4水解性能并不理想,反应时间过长的同时还
存在放氢速率和产氢率低的问题.同样的,简单的含Co化合物CuCo2O4催化剂催化NaBH4水解性能也不佳,虽然活化能仅有22 kJ/mol,但使用了0.5 g的NaBH4放氢量仍只有1 370 mL/g.最后再与复杂的负载型Co基催化剂比较,Fe/Co3O4催化剂整体仍表现出优秀的性能,只有活化能比碳纳米管Co基催化剂高,但制备方法相比多孔结构催化剂却简易得多,且放氢量较高,具有一定的商业和实用价值.
3 活化能计算
水解反应可以通过阿弗拉米方程来考察水解反应的性能[15],故本研究中用线性拟合来计算不同温度反应下Fe/Co3O4催化剂催化NaBH4水解的活化能.其中,根据阿弗拉米的研究,反应速率常数k与反应温度T(热力学温度)的关系为,
k=Aexp(-Ea/RT)(1)
式中,k是反应速率常数,A为指前因子,Ea为反应激活能;R为摩尔气体常数.
通过对公式(1)进行变形处理(即两边取对数)得到公式(2).
ln k=ln A-(Ea/R)(1/T)(2)
以1/T为横坐标,lnk为纵坐标,采用画图工具作出lnk与1/T的关系图,所得直线的斜率为-Ea/R,代入R值即可获得反应活化能Ea的数值.水解放氢反应活化能模拟图如图8所示.
由图8可以看出,60、50、40、30和20 ℃的拟合点可以线性拟合,且拟合曲线斜率为-10 302.116,拟合得到R2值为0.937 67,计算所得活化能为85.7 kJ/mol.虽然本研究得到的Ea偏高,但Fe/Co3O4催化剂表现出的良好放氢性能(见表4),说明其具有比较理想的氢气释放动力学和实用价值.
4 结 论
本研究以NaBH4作为水解放氢反应的原材料,分别探究非贵金属Fe和Ni负载在Co3O4上制备的催化剂对NaBH4水解反应的催化效果,探究其中产氢性能较好的催化剂与NaBH4混合物在不同物料比、不同水料比和不同水解反应温度等几个水解条件下的水解效果,并利用阿弗拉米方程进行放氢反应活化能计算.综合对比后,最终确定了Co3O4负载Fe催化NaBH4水解制氫比负载Ni时催化水解反应效果好,同时确定了NaBH4水解制氢的最佳条件是直接添加质量比为12.5 wt.%的Fe/Co3O4,且水料比为50 mL/g,水解反应温度为40 ℃,最终10.3 min内放氢总量可达2 445.4 mL/g,产氢率为94.1%.因其反应条件适中的同时产氢性能较好,并且Fe/Co3O4的制备成本更低,故有望推向商业化利用.
参考文献:
[1]Lototskyy M,Tolj I,Klochko,et al.Metal hydride hydrogen storage tank for fuel cell utility vehicles [J].Int J Hydrogen Energ,2020,45(14):7958-7967.
[2]Nie M,Zou Y C,Huang Y M,et al.Ni-Fe-B catalysts for NaBH4 hydrolysis [J].Int J Hydrogen Energ,2012,37(2):1568-1576.
[3]张翔,孙奎斌,周俊波.硼氢化钠水解制氢技术研究进展 [J].无机盐工业,2010,42(1):9-12.
[4]Xu Y,Wu C,Chen Y,et al.Hydrogen generation behaviors of NaBH4-NH3BH3 composite by hydrolysis [J].J Power Sources,2014,261:7-13.
[5]Walter J C,Zurawski A,Montgomery D,et al.Sodium borohydride hydrolysis kinetics comparison for nickel,cobalt,and ruthenium boride catalysts [J].J Power Sources,2008,179(1):335-339.
[6]Bozkurt G,zer A,Yurtcan A B.Development of effective catalysts for hydrogen generation from sodium borohydride:Ru,Pt,Pd nanoparticles supported on Co3O4 [J].Energy,2019,180:702-713.
[7]Bai Y,Wu C,Wu F,et al.Carbon-supported platinum catalysts for on-site hydrogen generation from NaBH4 solution [J].Mater Lett,2006,60(17/18):2236-2239.
[8]Zabielaite· A,Balcˇiūnaite· A,Stalnioniene· I,et al.Fiber-shaped Co modified with Au and Pt crystallites for enhanced hydrogen generation from sodium borohydride [J].Int J Hydrogen Energ,2018,43(52):23310-23318.
[9]Rakap M.The highest catalytic activity in the hydrolysis of ammonia borane by poly(N-vinyl-2-pyrrolidone)-protected palladium-rhodium nanoparticles for hydrogen generation [J].Appl Catal B-Environ,2015,163:129-134.
[10]楊在兴,徐嘉宝,黄起竟,等.Co/C催化剂的制备及其催化硼氢化钠水解制氢性能的研究 [J].沈阳大学学报(自然科学版),2018,30(6):436-440.
[11]Ouyang L,Liu M,Chen K,et al.Recent progress on hydrogen generation from the hydrolysis of light metals and hydrides [J].J Alloy Compd,2022,910:164831-1-164831-8.
[12]Didehban A,Zabihi M,Shahrouzi J R.Experimental studies on the catalytic behavior of alloy and core-shell supported Co-Ni bimetallic nano-catalysts for hydrogen generation by hydrolysis of sodium borohydride [J].Int J Hydrogen Energ,2018,43(45):20645-20660.
[13]Yuan H,Huo W,Hao Y,et al.Hydrogen generation from hydrolysis of sodium borohydride using nanosized NiB amorphous alloy catalysts [J].Nano,2020,15(6):2050081-1-2050081-10.
[14]Yao Q,Ding Y,Lu Z H.Noble-metal-free nanocatalysts for hydrogen generation from boron- and nitrogen-based hydrides [J].Inorg Chem Front,2020,7(20):3837-3874.
[15]Zhang X,Zhang Q,Xu B,et al.Efficient hydrogen generation from the NaBH4 hydrolysis by cobalt-based catalysts:Positive roles of sulfur-containing salts [J].Acs Appl Mater Inter,2020,12(8):9376-9386.
[16]Bozkurt G,zer A,Yurtcan A B.Hydrogen generation from sodium borohydride with Ni and Co based catalysts supported on Co3O4 [J].Int J Hydrogen Energ,2018,43(49):22205-22214.
[17]Bhattacharjee D,Dasgupta S.Trimetallic NiFePd nanoalloy catalysed hydrogen generation from alkaline hydrous hydrazine and sodium borohydride at room temperature [J].J Mater Chem A,2015,3(48):24371-24378.
[18]Dnmez F,Ayas N.Synthesis of Ni/TiO2 catalyst by sol-gel method for hydrogen production from sodium borohydride [J].Int J Hydrogen Energ,2021,46(57):29314-29322.
[19]Liu Z,Guo B,Hong L,et al.Microwave heated polyol synthesis of carbon-supported PtSn nanoparticles for methanol electrooxidation [J].Electrochem Commun,2006,8(1):83-90.
[20]Lai J L,Luo W J,Kuan Y D,et al.The effect of hydrogen production rate of the via different preparation of Co-based catalyst with sodium borohydride [J].Catalysts,2021,11(5):528-538.
[21]Zhong H,Ouyang L Z,Ye J S,et al.An one-step approach towards hydrogen production and storage through regeneration of NaBH4 [J].Energy Storage Mater,2017,7:222-228.
[22]Petit E,Miele P,Demirci U B.By-product carrying humidified hydrogen:an underestimated issue in the hydrolysis of sodium borohydride [J].Chemsuschem,2016,9(14):1777-1780.
[23]Akdim O,Demirci U B,Miele P.Acetic acid,a relatively green single-use catalyst for hydrogen generation from sodium borohydride [J].Int J Hydrogen Energ,2009,34(17):7231-7238.
[24]Boran A,Erkan S,Eroglu I.Hydrogen generation from solid state NaBH4 by using FeCl3 catalyst for portable proton exchange membrane fuel cell applications [J].Int J Hydrogen Energ,2019,44(34):18915-18926.
[25]Baye A F,Abebe M W,Ntiamoah R A,et al.Engineered iron-carbon-cobalt (Fe3O4@C-Co) core-shell composite with synergistic catalytic properties towards hydrogen generation via NaBH4 hydrolysis [J].J Colloid Interface Sci,2019,543:273-284.
[26]Patil K N,Prasad D,Bhanushali J T,et al.Sustainable hydrogen generation by catalytic hydrolysis of NaBH4 using tailored nanostructured urchin-like CuCo2O4 spinel catalyst [J].Catal Lett,2019,150(2):586-604.
[27]Chou C C,Hsieh C H,Chen B H.Hydrogen generation from catalytic hydrolysis of sodium borohydride using bimetallic Ni-Co nanoparticles on reduced graphene oxide as catalysts [J].Energy,2015,90:1973-1982.
[28]Yuan X,Jia C,Ding X L,et al.Effects of heat-treatment temperature on properties of Cobalt-Manganese-Boride as efficient catalyst toward hydrolysis of alkaline sodium borohydride solution [J].Int J Hydrogen Energ,2012,37(1):995-1001.
[29]Wang F,Zhang Y,Wang Y,et al.Co-P nanoparticles supported on dandelion-like CNTs-Ni foam composite carrier as a novel catalyst for hydrogen generation from NaBH4 methanolysis [J].Int J Hydrogen Energ,2018,43(18):8805-8814.
(責任编辑:伍利华)
Abstract:In order to increase the rate of hydrogen liberation by sodium borohydride(SB) hydrolysis,a low-cost supported non noble metal catalyst M/Co3O4 (M=Fe,Ni) was prepared by a microwave-assisted polyol process.The study shows that M/Co3O4 has a significant effect on the hydrolysis of SB,and Fe/Co3O4 has better catalytic performance.Under the conditions when catalyst addition was 12.5 wt.%,water-to-material ratio was 50 mL/g and hydrolysis temperature was 40 ℃,the hydrogen yield of Fe/Co3O4 catalyzed SB in 10.3 minutes reached 2 445.4 mL/g,and the corresponding hydrogen generation rate and hydrogen release efficiency were 237.4 mL/(min·g) and 94.1% respectively.
Key words:sodium borohydride;hydrogen production by hydrolysis;Fe/Co3O4;Ni/Co3O4
基金项目:后续能源材料与器件教育部工程研究中心开放课题(AEMD202203);成都大学人才工程科研启动项目(2081921083)
作者简介:吴龙祥(1998—),男,硕士研究生,从事化学储氢材料研究.E-mail:1097316240@qq.com
通信作者:王小炼(1985—),男,博士,副教授,从事储氢燃料研究.E-mail:wangxiaolian@cdu.edu.cn

