基于Eu-Ni-B稀土-复合电极电催化偏硼酸钠制备硼氢化钠的探索*
张士民,陈必清,高利霞,熊彤彤,杜 婵,朱云娜,赵 静
(青海师范大学 化学化工学院, 西宁 810008)
0 引 言
近年来,由于化石能源的过度开采已被消耗殆尽,不能充分满足未来人类的需求[1],为此科研工作者不断探索环保、高效的新能源。氢能由于是一种清洁环保的绿色能源而逐步走进人们的视野[2-5]。硼氢化钠是一种储氢材料,1 g硼氢化钠含氢量高达0.213 g,硼氢化钠在储氢材料中占据重要的地位[6-8]。但是问题也随之出现,就是生产硼氢化钠的条件较为苛刻,设备要求较高[9]。为此,人们不断探索制备硼氢化钠的新途径。由于电催化偏硼酸钠制备硼氢化钠对环境无毒害,消耗资源少,可以达到资源循环利用的效果,为此一些专家学者对电催化偏硼酸钠制备硼氢化钠进行了探索。美国学者Cooper[10]最早利用电催化还原偏硼酸钠制备了硼氢化钠并申请了专利。Amendola[11]也在2002年申请了硼酸盐在水溶液中电化学还原的专利。王建强[12]、赵家雄[13]同样以电催化的方法,从偏硼酸钠中制备了硼氢化钠。但是,是否可以通过电催化偏硼酸钠的方法制备硼氢化钠的问题依然存在争议,美国学者J.McLafferty等人[14]对一些专利和论文中报道的方法进行重复,表明并没有硼氢化钠存在的证据。周永全[15]对电催化偏硼酸钠制备硼氢化钠的方法进行尝试,也没有发现硼氢化钠存在的证据。为此,本文以化学镀方法制备了稀土-复合电极,并以文献[13,15]为依据再一次建立了定量分析检测方法,以新型Eu-Ni-B稀土-复合电极材料作为工作电极,对电催化偏硼酸钠制备硼氢化钠再次进行尝试。
1 实 验
1.1 试剂与仪器
柠檬酸(AR、上海试剂一厂)、苹果酸(AR、萨恩化学技术有限公司)、己二酸(AR、阿拉丁)、六水硝酸铕(AR、萨恩化学技术有限公司)、氢氧化钠(AR、萨恩化学技术有限公司)、二甲胺基硼烷(AR、萨恩化学技术有限公司)、无水氯化镍(AR、萨恩化学技术有限公司)、无水乙醇(AR、天津市富宇精细化工有限公司)、偏硼酸钠(AR、萨恩化学技术有限公司)、硼氢化钠(AR、阿拉丁)等电子天平(AL-204 型)、电化学工作站(LK2005型)、恒温水浴锅(德国)、H型电解池、SU8010 型扫描电子显微镜(SEM)、X-MAXN型 X 射线能谱仪(EDS)、电吹风等。
1.2 化学镀镀液配方
无水氯化镍10 g/L、二甲胺基硼烷8 g/L、柠檬酸1.3 g/L、氢氧化钠1.0 g/L、硝酸铕3.2 g/L、苹果酸1.5 g/L、己二酸1.5 g/L、装载量10mL、施镀温度37 ℃。
1.3 稀土-复合电极的制备
1.3.1 镀液的制备
使用电子分析天平准确称取10 g无水氯化镍,用无水乙醇溶解,然后定容于 1 L的容量瓶中备用。准确量取10 mL上述备用溶液于25 mL 的比色管中,按化学镀镀液配方准确称取己二酸、苹果酸、柠檬酸、六水硝酸铕依次加入比色管。待上述试剂完全溶解后按化学镀镀液配方加入一定量的氢氧化钠,由于氢氧化钠在该溶液中不易溶解,故需要对其进行超声分散。待其完全溶解后,按上述配方准确称取二甲胺基硼烷并加入比色管,所制备的镀液备用。
1.3.2 基体及其预处理
基体:实验采用的基体材料为铜片(纯度99.99%),实验中的试样尺寸为0.1 mm×10 mm×20 mm。为了取用方便,与一定长度的铜丝焊接。
预处理:(1)采用1000#、5000#砂纸打磨,除去基体表面氧化物及杂质。(2)采用10 %的盐酸溶液对基体进行清洗,以除去基体表面残留氧化物及杂质。(3)采用丙酮对基体进行清洗,以除去基体表面油脂。(4)活化;采用0.2 g/L PdCl2乙醇胶体溶液对基体进行活化,以增加基体表面活性位点。每个过程后,用无水乙醇对试样进行清洗。试样预处理在室温下进行。
1.3.3 化学镀流程
将上述预处理后的基体放入含有镀液的比色管中,用保鲜膜将管口密封,然后将比色管迅速转移至恒温水浴锅,待反应结束后,取出基体并用无水乙醇对其进行清洗,清洗后用冷风吹干就制备了Eu-Ni-B稀土-复合电极。
1.4 镀层表征
在化学镀完成之后,试样直接采用日立公司的 SU8010 型扫描电子显微镜(SEM)对镀层的表面形貌进行分析,加速电压为2.5 kV。镀层成分采用牛津公司的X-MAXN型 X 射线能谱仪(EDS)进行分析。
1.5 电解实验
考虑到影响电解的条件过多,比如氢氧化钠浓度、偏硼酸钠浓度、电位、脉冲时间、电解时间等。本文选取何敏[16-17]等人使用的氢氧化钠浓度和偏硼酸钠浓度探究电位、脉冲时间、电解时间对电催化偏硼酸钠的影响。另外,由于阴极上偏硼酸钠的还原电位为-1.24 V,并且水的还原反应还会与之形成竞争[13],所以实验过程中将电位设置在-1.0~-1.5之间。
BO2-+6H2O+8e-→BH4-+8OH-
E1/2=-1.24 V
(1)
2H2O+2e-→H2+2OH-
E1/2=-0.83 V
(2)
文中的电解实验均在带Nafion-117阳离子隔膜的H型电解槽中进行,其中一侧注入50 mL 1mol/L NaOH溶液,另一侧注入50 mL 0.5 mol/L NaBO2+1 mol/L NaOH混合溶液。以Eu-Ni-B稀土-复合电极作为工作电极,Hg/HgO/OH-作为参比电极,石墨棒作为辅助电极,采用脉冲电解方式对体系进行电解实验。
1.6 电化学测量
采用电化学工作站对体系进行循环伏安测试和线性伏安测试,测试均在三电极体系下进行,采用金盘电极作为工作电极,Hg/HgO/OH-作为参比电极,石墨棒作为辅助电极。其中循环伏安测试区间为-1~0.8,扫描速度为0.1 V/s。线性伏安测试区间为-0.9~-0.1,扫描速度为0.05 V/s。
2 结果与讨论
2.1 镀层中不同稀土含量对镀层形貌的影响
在制备镀层之后,直接使用扫描电子显微镜对镀层的形貌进行表征。在表征过程中发现了一个实验现象,就是镀层中稀土含量会影响镀层的表面形貌,这种影响如图1所示。从图1(a)到图1(d)随着稀土含量的不断增加,镀层的裂隙也逐渐增多,镀层也由平整到了凹凸不平。出现这种现象的原因可能是一方面稀土的加入可以细化晶粒,对镀层起到有益的作用,另一方面,由于稀土元素的内吸附力较强[18-20],导致镀层出现裂纹,这对镀层起到不良的影响。随着稀土含量的增加,内吸附力越强,当不良作用起主导作用时,镀层就会出现裂纹。结果表明,适当的稀土含量对镀层起到了有益的作用,而过量的稀土元素会对镀层起到不良的影响。镀层元素分析结果如表1所示。

图1 镀层中不同稀土含量对于镀层表面形貌的影响

表1 镀层的化学组成(质量分数%)
2.2 检测体系的建立
赵家雄[13]发现硼氢化钠的碱性溶液在金电极上的氧化电位在-0.4附近,并根据这一氧化还原特性建立了硼氢化钠的定量分析检测方法。周永全[15]对该定量分析检测方法进行了研究,研究表明该定量分析检测方法可行并且分析准确度可靠。故本实验以同样的方式建立了定量分析检测方法。采用线性伏安法对对1 mol/L NaOH+0.5 mol/L NaBO2·4H2O+不同浓度的硼氢化钠溶液进行测试,测试中采用金盘电极作为工作电极,Hg/HgO/OH-作为参比电极,石墨棒作为辅助电极,线性伏安测试区间为-0.9~-0.1,扫描速度为0.05 V/s。为了使实验尽可能的准确,将浓度设置在1~9×10-4mol/L之间。从图2(a)可以看出,在不同浓度的硼氢化钠下,硼氢化钠的氧化峰会出现不同程度的偏移,但始终处于-0.5~-0.4 V之间。这与之前的研究基本保持一致[13]。
为了能对硼氢化钠浓度进行检测,图2(b)是采用赵家雄的方法[13]通过峰电流与硼氢化钠浓度建立的线性回归方程y=0.00525x+0.00445。相关系数R2=0.98057,这表明该回归方程的线性关系良好,基本能准确测量溶液中硼氢化钠的浓度。
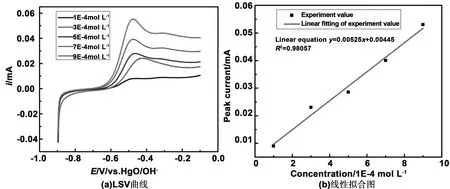
图2 检测体系的建立(a)LSV曲线(b)线性拟合图
2.3 空白实验
为了确保实验的准确性以及严谨性,在电解实验开始前,采用传统三电极体系分别对1 mol/L NaOH溶液和1 mol/L NaOH+0.5 mol/L NaBO2·4H2O混合溶液进行循环伏安测试,采用金盘电极作为工作电极,Hg/HgO/OH-作为参比电极,石墨棒作为辅助电极。其中循环伏安测试区间为-1.0~0.8,扫描速度为0.1 V/s。从图3可以发现,在-0.5~-0.4 V之间没有出现氧化峰,这表明在这两种体系中,不存在硼氢化钠。

图3 循环伏安曲线
2.4 电位和脉冲时间对于电催化偏硼酸钠的影响
为了探究电位和脉冲时间对于电催化偏硼酸钠的影响,分别在不同电位条件下,换用不同脉冲频率对电催化偏硼酸钠进行探究,电催化时间均为1 h,等电催化试验结束后,采用金电极作为工作电极,Hg/HgO/OH-作为参比电极,石墨棒作为辅助电极对电解液进行循环伏安检测。
2.4.1 电位为-1.0 V条件下,脉冲时间对于电催化偏硼酸钠的影响
图4是电位为-1.0 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线。从图4中可以看出,循环伏安曲线的轮廓与图3的空白实验的循环伏安曲线基本一致。根据2.2节中的叙述,如果有硼氢化钠产生,那么会在-0.5~-0.4 V之间出现氧化峰。但是,从图中并没有在-0.5~-0.4 V之间发现氧化峰,这表明,在该电位条件下没有产生硼氢化钠。没有硼氢化钠产生的可能原因是电位达到了析氢副反应的电位,而没有达到偏硼酸根还原的电位,所以电极上发生的主要反应是析氢反应。从图4中还可以看出,在该电位下,不论怎样的脉冲条件都没有检测到硼氢化钠。这表明在电催化偏硼酸钠过程中电位条件为主要影响因素。

图4 电位为-1.0 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线
2.4.2 电位为-1.1 V条件下,脉冲时间对于电催化偏硼酸钠的影响
图5是电位为-1.1 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线。从图5中可以看出,当脉冲频率为TA=2 s、TC=2 s和TA=2 s、TC=3 s时在-0.5~-0.4 V之间产生了氧化峰,并且峰位置、峰型与图2中的峰基本保持一致。为了能明显的看到氧化峰,图中小图是对氧化峰的放大图,再一次确认了在-0.5~-0.4 V之间氧化峰的存在,这表明有微量的硼氢化钠产生。通过2.2节建立的线性方程对硼氢化钠浓度进行计算,计算结果汇总在表2中,其中TA代表阳极时间,TC代表阴极时间。通过表2发现,TA=2 s、TC=2 s时,硼氢化钠浓度为0.83×10-4mol/L,而TA=2 s、TC=3 s时,硼氢化钠的浓度为0.48×10-4mol/L。这表明在该电位条件下,脉冲频率为TA=2 s、TC=2 s时,电催化效果最好。

图5 电位为-1.1 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线
表2 电位为-1.1V条件下,不同脉冲频率下的硼氢化钠浓度
Table 2 Concentration of sodium borohydride at -1.1 V potential at different pulse frequencies

脉冲频率TA=2TC=2TA=2TC=3硼氢化钠浓度/mol·L-10.83×10-40.48×10-4
2.4.3 电位为-1.2 V条件下,脉冲时间对于电催化偏硼酸钠的影响
图6是电位为-1.2 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线。从图6中可以发现,在-0.5~-0.4 V之间出现了不同强度的氧化峰,且峰位置、峰型与图2中的氧化峰基本保持一致。但是这些氧化峰出现了不同程度的偏移,但基本保持在-0.5~-0.4 V之间,这与图2中出现的情况基本一致,那就说明出现这种现象的原因可能与产生硼氢化钠的浓度有关。通过线性方程对硼氢化钠浓度进行计算,计算结果汇总在表3中,从表3我们可以发现TA=2 s、TC=1 s时,硼氢化钠浓度为0.12×10-4mol/L,当脉冲频率为TA=2 s、TC=2 s时,硼氢化钠浓度为1.63×10-4mol/L,当脉冲频率为TA=2 s、TC=3 s时,硼氢化钠的浓度为0.98×10-4mol/L。这表明在该电位条件下,脉冲频率为TA=2 s、TC=2 s时,对于偏硼酸钠的电催化效果最为显著。
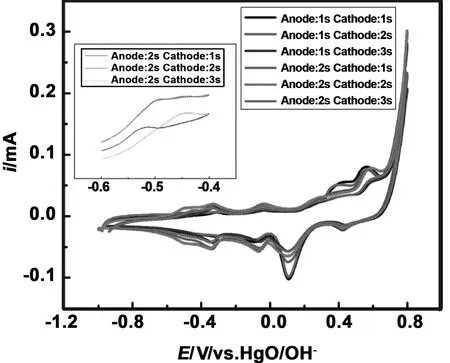
图6 电位为-1.2 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线
表3 电位为-1.2 V条件下,不同脉冲频率下的硼氢化钠浓度
Table 3 Concentration of sodium borohydride at -1.2 V potential at different pulse frequencies

脉冲频率TA=2TC=1TA=2TC=2TA=2TC=3硼氢化钠浓度/mol·L-10.12×10-41.63×10-40.98×10-4
2.4.4 电位为-1.3V条件下,脉冲时间对于电催化偏硼酸钠的影响
图7是电位为-1.3 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线。从图7中可以发现,在-0.5~-0.4 V之间出现了不同强度的氧化峰,且峰位置、峰型与图2中的氧化峰基本保持一致,这表明硼氢化钠的产生。通过线性方程对硼氢化钠浓度进行计算,计算结果汇总在表4中,从表4我们可以发现当脉冲频率为TA=1 s、TC=1 s时,硼氢化钠浓度为1.23×10-4mol/L,当脉冲频率为TA=2 s、TC=1 s时,硼氢化钠浓度为0.6×10-4mol/L,当脉冲频率为TA=2 s、TC=2 s时,硼氢化钠的浓度为0.94×10-4mol/L。这表明在该电位条件下,当脉冲频率为TA=1 s、TC=1 s时,对于偏硼酸钠的电催化效果较好。
表4 电位为-1.3 V条件下,不同脉冲频率下的硼氢化钠浓度
Table 4 Concentration of sodium borohydride at -1.3 V potential at different pulse frequencies

脉冲频率TA=1TC=1TA=2TC=1TA=2TC=2硼氢化钠浓度/mol·L-11.23×10-40.6×10-40.94×10-4

图7 电位为-1.3 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线
2.4.5 电位为-1.4V条件下,脉冲时间对于电催化偏硼酸钠的影响
图8是电位为-1.4 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线。从图8中可以发现,在-0.5~-0.4 V之间出现了氧化峰,这表明有硼氢化钠产生,通过线性回归方程对硼氢化钠的含量计算可知,当脉冲频率为TA=1 s、TC=1 s时,硼氢化钠浓度为1.25×10-4mol/L。

图8 电位为-1.4 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线
2.4.6 电位为-1.5 V条件下,脉冲时间对于电催化偏硼酸钠的影响
图9是电位为-1.5 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线。从图9中可以发现在-0.5~-0.4 V之间出现了氧化峰,这表明电催化产生了硼氢化钠。通过线性方程对硼氢化钠浓度进行计算,计算结果汇总在表5中,从表5我们可以发现TA=1 s、TC=1 s时,硼氢化钠浓度为0.93×10-4mol/L,TA=1 s、TC=2 s时,硼氢化钠浓度为1.17×10-4mol/L,而TA=2 s、TC=1 s时,硼氢化钠浓度为0.79E-4 mol/L。这表明在该电位条件下,脉冲频率为TA=1、TC=2时,电催化效果较好。
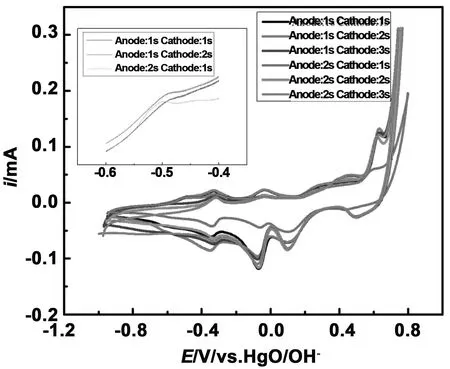
图9 电位为-1.5 V条件下,不同脉冲时间电催化偏硼酸钠后的循环伏安曲线
表5 电位为-1.5 V条件下,不同脉冲频率下的硼氢化钠浓度
Table 5 Concentration of sodium borohydride at -1.5 V potential at different pulse frequencies
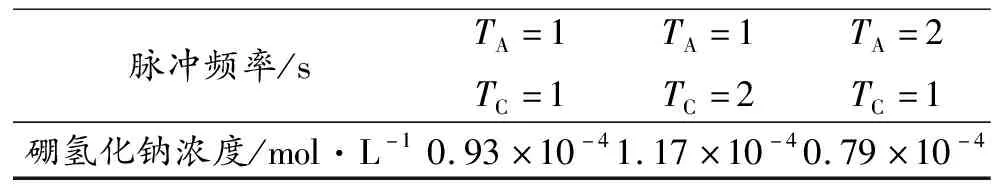
脉冲频率/sTA=1TC=1TA=1TC=2TA=2TC=1硼氢化钠浓度/mol·L-10.93×10-41.17×10-40.79×10-4
2.5 电催化时间对于电催化偏硼酸钠的影响
通过对不同电位下的电催化偏硼酸钠后的循环伏安曲线分析,可以看出,电位为-1.2 V、脉冲频率为TA=2 s、TC=2 s条件下,所得硼氢化钠的浓度最高。所以选用此体系探究电催化时间对于电催化偏硼酸钠的影响。图10是不同电解时间下的电催化偏硼酸钠后的循环伏安曲线,从图10可以看出,随着电催化时间的增加,硼氢化钠的浓度呈现先增加后下降的趋势。通过线性方程对硼氢化钠浓度进行计算,计算结果汇总在表6中,从表6我们可以发现电催化时间为1 h,硼氢化钠的浓度为1.63×10-4mol/L,电催化时间为2 h,硼氢化钠的浓度为2.75×10-4mol/L,电催化时间为3 h,硼氢化钠的浓度为1.82×10-4mol/L。结果表明电催化时间为2 h,产生的硼氢化钠最多,电催化效果最好。引起这种情况的可能的原因是随着电催化时间的增加,硼氢化钠的含量也会增加,但是硼氢化钠在非强碱体系中不稳定,也会随着时间的增加而逐步分解,故硼氢化钠的生成与硼氢化钠的分解形成竞争,当生成速度比分解速度慢时,随着时间的延长,溶液中的硼氢化钠含量自然也下降。综上所述,电催化效果较好的电催化时间为2h,并且溶液中的硼氢化钠浓度也达到了2.75×10-4mol/L。

图10 电解时间对于电催化偏硼酸钠的影响
表6 不同电解时间下的硼氢化钠浓度
Table 6 Sodium borohydride concentrations at different electrolysis times

电解时间/h123硼氢化钠浓度/mol·L-11.63×10-42.75×10-41.82×10-4
3 结 论
(1)稀土对镀层的形貌起着重要的作用,而形貌又是决定镀层耐腐蚀能力的重要因素,所以,如果想得到耐腐蚀性优异的材料,需要控制镀层中稀土的含量,适宜的稀土含量可以明显提升镀层的性能。
(2)在对电位对电催化偏硼酸钠的影响分析中发现,当电位为-1.0 V时,没有硼氢化钠产生,可能原因是电位达到了析氢副反应的电位,而没有达到偏硼酸根还原的电位,所以电极上发生的主要反应是析氢反应。但是当电位更接近或者超过偏硼酸根的还原电位时,电催化产生了硼氢化钠,并且当电位为-1.2 V时,出现了硼氢化钠的最大浓度1.63×10-4mol/L,所以在电催化偏硼酸钠过程中应选用-1.2 V作为电催化偏硼酸钠的电位。
(3)在对在对脉冲时间对电催化偏硼酸钠的影响分析中发现,当脉冲频率为TA=2 s、TC=2 s和脉冲频率为TA=2 s、TC=2 s条件下,电催化出现的硼氢化钠的总次数均为6次,但是考虑到TA=2 s、TC=2 s条件下出现了硼氢化钠的最大浓度1.63×10-4mol/L,故应选用TA=2 s、TC=2 s的脉冲频率对硼氢化钠进行电催化。
(4)电催化时间为2 h,产生的硼氢化钠最多,电催化效果最好。其可能的原因是随着电催化时间的增加,硼氢化钠的含量也会增加,但是硼氢化钠在非强碱体系中不稳定,也会随着时间的增加而逐步分解,故硼氢化钠的生成与硼氢化钠的分解形成竞争,当生成速度比分解速度慢时,随着时间的延长,溶液中的硼氢化钠含量自然会下降。

