FANCD2、PALB2表达水平与非小细胞肺癌临床特征及预后的关系*
涂媛,章培,陈琼,李文琴
(成都市第二人民医院 病理科,四川 成都 610017)
非小细胞肺癌(non-small cell lung cancer,NSCLC)是一种恶性程度高、侵袭力强、病死率高的恶性肿瘤,主要表现为咳嗽、咳血等非特异性临床症状[1]。尽管近年来影像学诊断技术的不断革新,但是NSCLC早期诊断的难度系数仍然较高,大部分患者确诊时病情较严重,疗效不佳[2]。因此,寻找早期诊断NSCLC的潜在生物标志物是目前临床研究的热点。范科尼贫血D2蛋白(Fanconi anemia D2 protein,FANCD2)是范科尼贫血(Fanconi anemia,FA)基因家族的成员之一,在DNA双链断裂后的重组修复过程中发挥重要作用[3],已有研究证实,FANCD2可参与卵巢癌[4]、食管鳞状细胞癌[5]等病情进展。乳腺癌易感基因2定位协作蛋白(partner and localizer of BRCA2,PALB2)是乳腺癌易感基因(breast cancer susceptibility gene,BRCA)超家族成员,可协调BRCA1、BRCA2参与乳腺癌、前列腺癌等疾病的DNA同源重组修复[5]。有研究显示,FANCD2与PALB2基因同时缺失,协同导致乳腺癌化疗耐药性增加[6]。然而NSCLC癌组织中FANCD2、PALB2的表达与临床病理特征及预后关系的前瞻性研究尚未见报道。因此,本研究拟探讨NSCLC癌组织中FANCD2、PALB2表达水平与患者临床特征及预后的关系。
1 资料与方法
1.1 一般资料
选取2017年11月—2019年10月成都市第二人民医院收治的194例NSCLC患者作为研究对象。其中男性116例,女性78例;年龄18~85岁,平均(60.59±9.43)岁。将手术过程中取得癌组织标本作为NSCLC组,将对应的癌旁组织标本作为癌旁组,各194例。纳入标准:①经病理活检确诊为NSCLC,并符合《中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)》[7]诊断标准;②入院前未接受过抗癌治疗;③患者及监护人知情同意。排除标准:①合并其他部位恶性肿瘤;②脑、心、肾等功能异常;③妊娠或产后女性;④精神异常、认知异常、出院后失访及拒绝参与本研究。本研究经医院医学伦理委员会已审核批准。
1.2 主要试剂和仪器
兔抗人FANCD2单克隆抗体、兔抗人PALB2单克隆抗体(天津塞尔生物技术有限公司);羊抗兔二抗免疫球蛋白G(Immunoglobulin G,IgG)(艾美捷科技有限公司);二氨基联苯胺(Diaminobenzidine,DAB)染色试剂盒(北京索莱宝科技有限公司);光学显微镜(深圳西派克光学仪器有限公司)。
1.3 方法
1.3.1 免疫组织化学法FANCD2、PALB2检测 采用免疫组织化学法检测FANCD2、PALB2在NSCLC患者癌组织及癌旁组织中的表达情况。首先将手术取得的组织标本进行固定(4%多聚甲醛,4 h)、石蜡包埋、切片(厚度4 μm)、脱蜡(二甲苯,20 min),然后进行孵育(5%过氧化氢溶液)、梯度乙醇脱水(100%、95%、85%、75%)、磷酸盐缓冲液(phosphate buffer solution,PBS)冲洗3次,3 min/次,加入山羊血清抗体封闭10 min;加入兔抗人FANCD2单克隆抗体(1∶100)、兔抗人PALB2单克隆抗体(1∶150),4 ℃孵育过夜;第2天取出后室温下静置30 min,加入PBS冲洗3次,3 min/次,加入羊抗兔二抗IgG,室温孵育30 min,加入PBS冲洗3次,3 min/次,DAB染色试剂盒显色,苏木精复染,梯度乙醇脱水,二甲苯透明,树胶封片,光学显微镜下观察结果。
1.3.2 结果判定 由2位病理专家采用双盲法对结果进行评定(取均值),阳性细胞在光学显微镜下观察到细胞质或细胞核出现棕黄色或者黄色颗粒。染色指数=染色强度评分×阳性细胞百分比评分,染色指数≤ 4分即可判断为阴性表达,5~12分可判断为阳性表达。染色强度评分:分为无色、浅黄色、黄色、棕黄色,分别计0、1、2、3分;阳性细胞百分比评分:无阳性细胞或阳性细胞占比≤5%、> 5%~25%、> 25%~50%、> 50%~75%、> 75%,分别计0、1、2、3、4分[8]。
1.3.3 随访 NSCLC患者出院后通过电话沟通、门诊复查等方式连续随访3年。术后第1年,间隔3个月复查1次;术后第2年起,间隔6个月复查1次。诊断为复发的患者根据个体情况选择进一步手术、保守治疗等治疗方式(支气管镜取肿瘤组织进行病理检查,或吸取支气管分泌物作细胞学检查出癌细胞为复发)。统计随访期间患者的总生存率,患者出现NSCLC导致死亡则终止,随访截止时间为2022年10月30日。
1.4 统计学方法
数据分析采用SPSS 23.0统计软件。计数资料以构成比或率(%)表示,比较用χ2检验;计量资料以均数±标准差(±s)表示,比较用t检验;相关性分析用Spearman法;采用Kaplan-Meier法绘制生存曲线,比较用Log-rank χ2检验;影响因素的分析用Cox比例风险模型。P<0.05为差异有统计学意义。
2 结果
2.1 FANCD2、PALB2在NSCLC患者癌组织及癌旁组织中的表达情况比较
两组FANCD2、PALB2阳性率比较,差异均有统计学意义(P<0.05),NSCLC组高于癌旁组。见表1和图1、2。
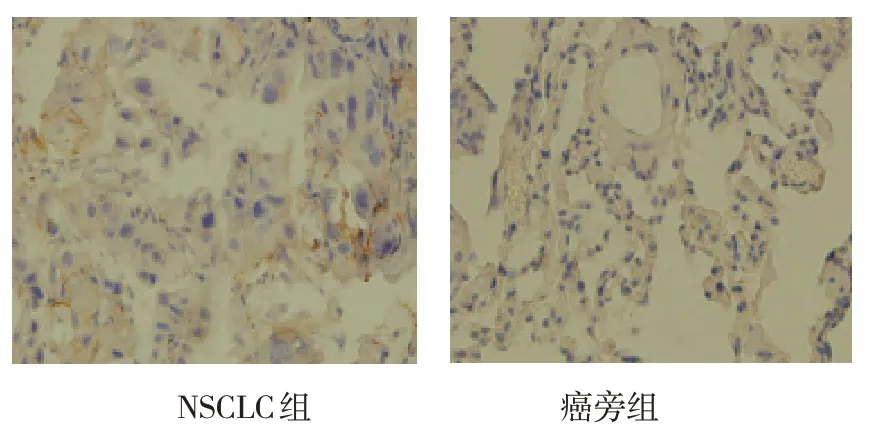
图1 两组FANCD2阳性表达 (×400)
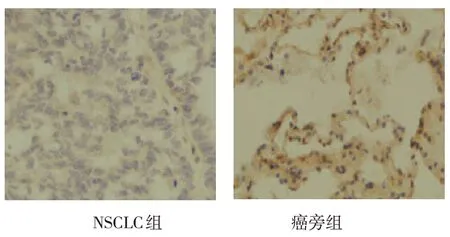
图2 两组PALB2阳性表达 (×400)
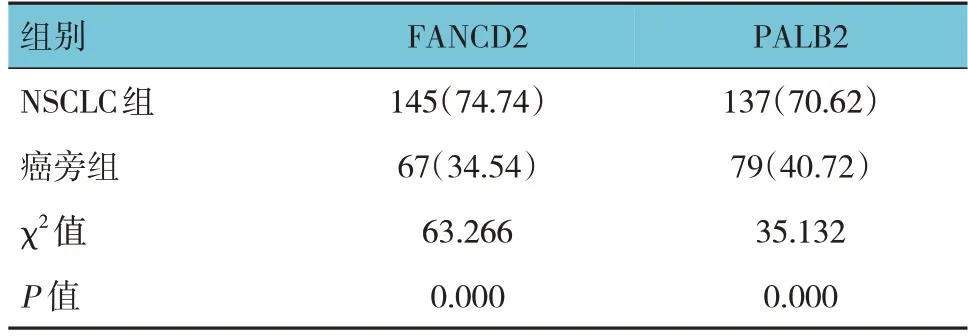
表1 FANCD2、PALB2在NSCLC患者癌组织及癌旁组织中的阳性表达比较 [n =194,例(%)]
2.2 NSCLC患者癌组织中FANCD2蛋白与PALB2蛋白的相关性分析
Spearman相关性分析显示,NSCLC患者癌组织中FANCD2蛋白与PALB2蛋白呈正相关(rs=0.486,P=0.000)。
2.3 癌组织中FANCD2、PALB2阳性表达与NSCLC患者临床病理特征的关系
不同年龄、性别、吸烟、组织学分型、肿瘤直径患者FANCD2、PALB2阳性率比较,经χ2检验,差异均无统计学意义(P>0.05)。不同TNM分期、分化程度和有无淋巴结转移患者FANCD2、PALB2阳性率比较,经χ2检验,差异均有统计学意义(P<0.05),TNM分期Ⅲ、Ⅳ期,低分化,有淋巴结转移患者分别高于TNM分期I、Ⅱ期,中、高分化,无淋巴结转移患者。见表2。
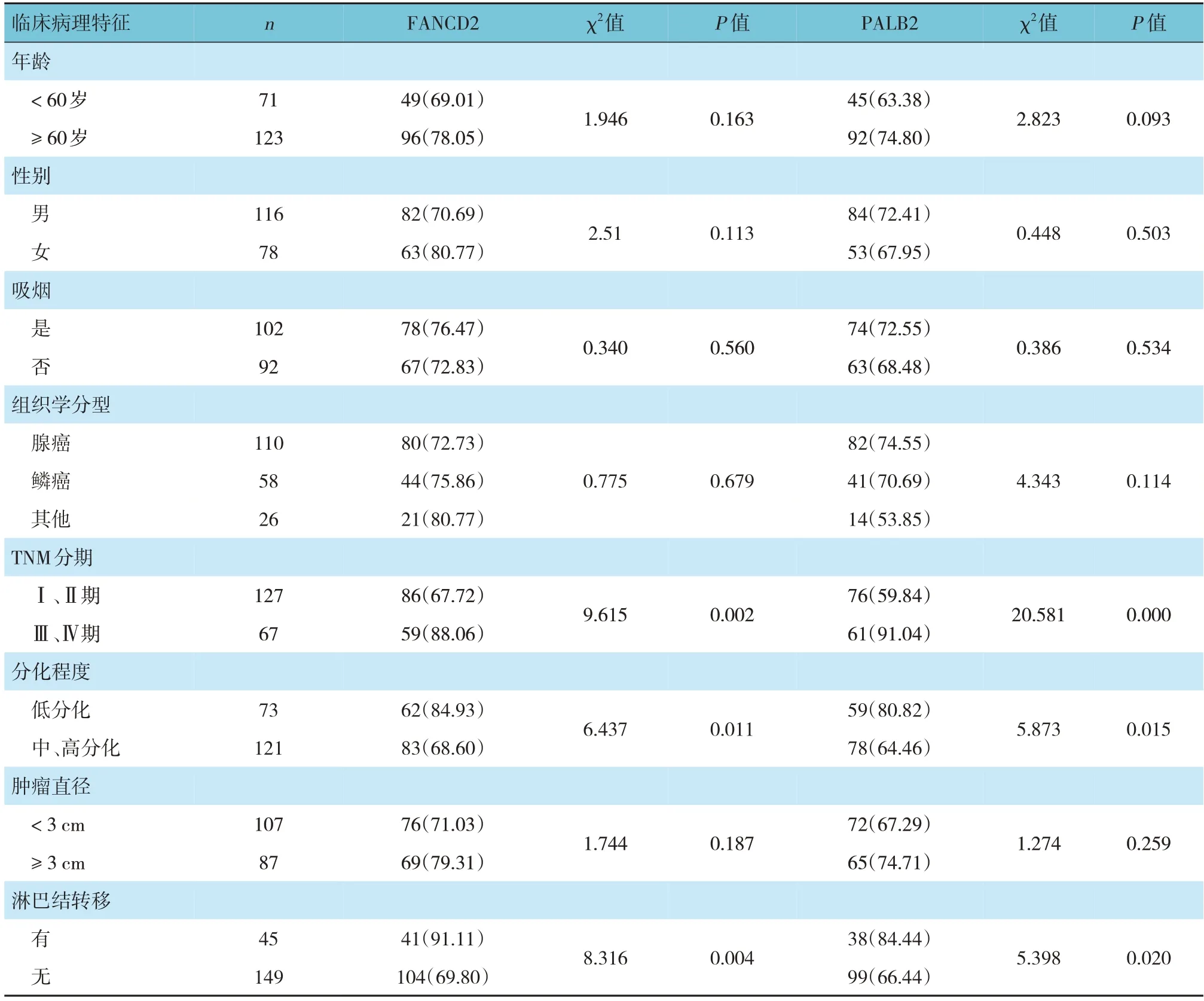
表2 不同临床病理特征NSCLC患者FANCD2和PALB2阳性表达率比较 例(%)
2.4 影响NSCLC患者复发的Cox回归分析
单因素Cox回归分析结果表明,不同TNM分期、分化程度、淋巴结转移、FANCD2阳性表达、PALB2阳性表达是NSCLC患者复发的影响因素(P<0.05)。见表3。
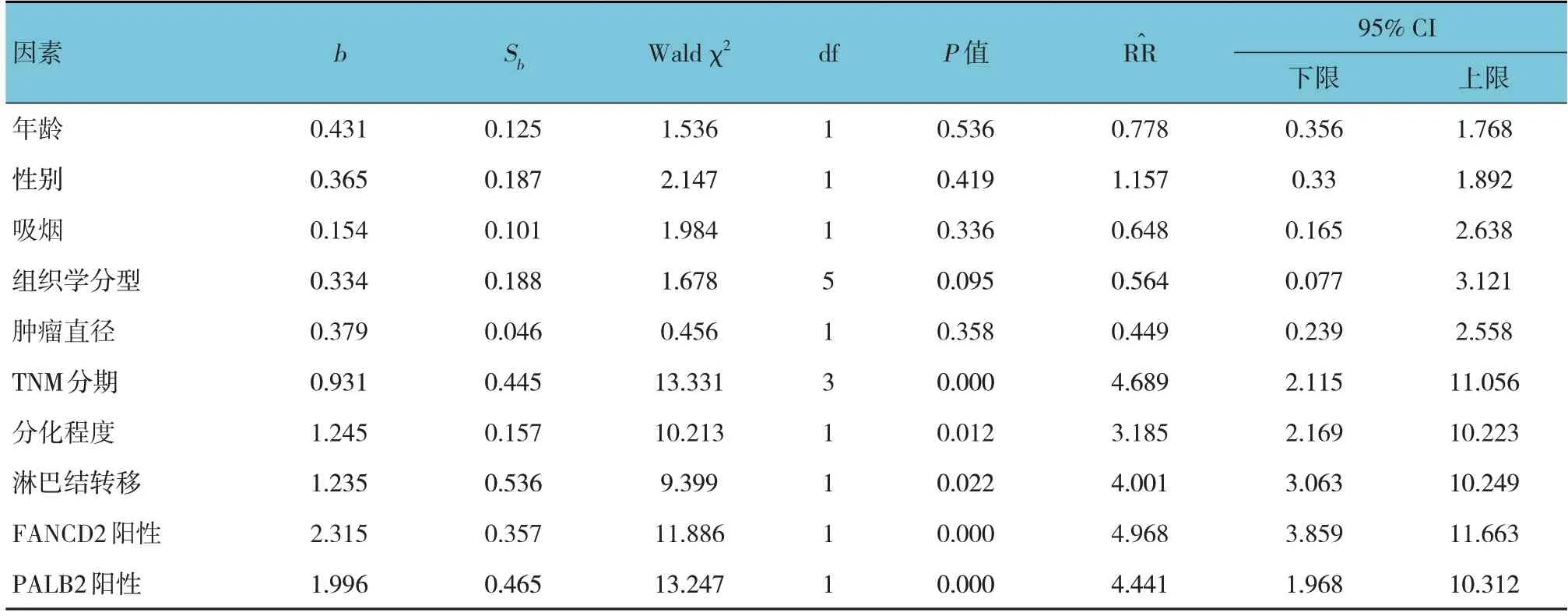
表3 NSCLC患者复发的单因素Cox回归分析参数
将NSCLC患者复发(未复发= 0,复发= 1)作为因变量,将TNM分期(Ⅰ/Ⅱ期= 0,Ⅲ/Ⅳ期= 1)、分化程度(中/高分化= 0,低分化= 1)、淋巴结转移(否=0,是= 1)、FANCD2表达(阴性= 0,阳性= 1)和PALB2表达(阴性= 0,阳性= 1)作为自变量,进行多因素逐步Cox回归分析(α入= 0.05,α出= 0.10),结果显示:TNM分期Ⅲ、Ⅳ期[=4.125(95% CI:2.187,10.035)]、低分化[=3.146(95% CI:3.115,9.264)]、淋巴结转移[=4.124(95% CI:3.005,13.145)]、FANCD2阳性[=5.146(95% CI:3.784,12.689)]、PALB2阳性[=4.563(95% CI:2.845,7.398)]是NSCLC患者复发的影响因素(P<0.05)。见表4。
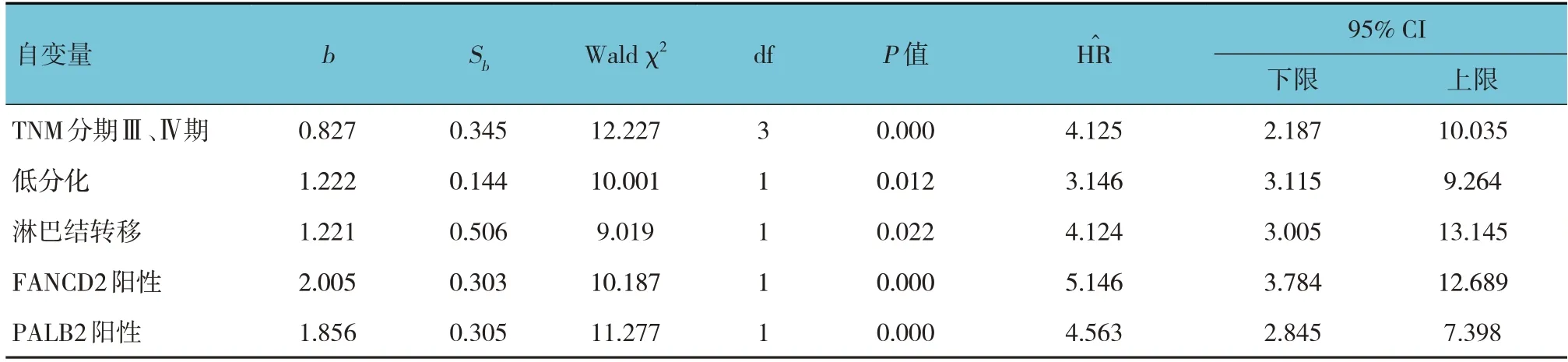
表4 NSCLC患者复发的多因素逐步Cox回归分析参数
2.5 影响NSCLC患者预后的Cox回归分析
单因素Cox回归分析结果表明,不同TNM分期、分化程度、淋巴结转移、FANCD2阳性表达、PALB2阳性表达是NSCLC患者预后的影响因素(P<0.05)。见表5。
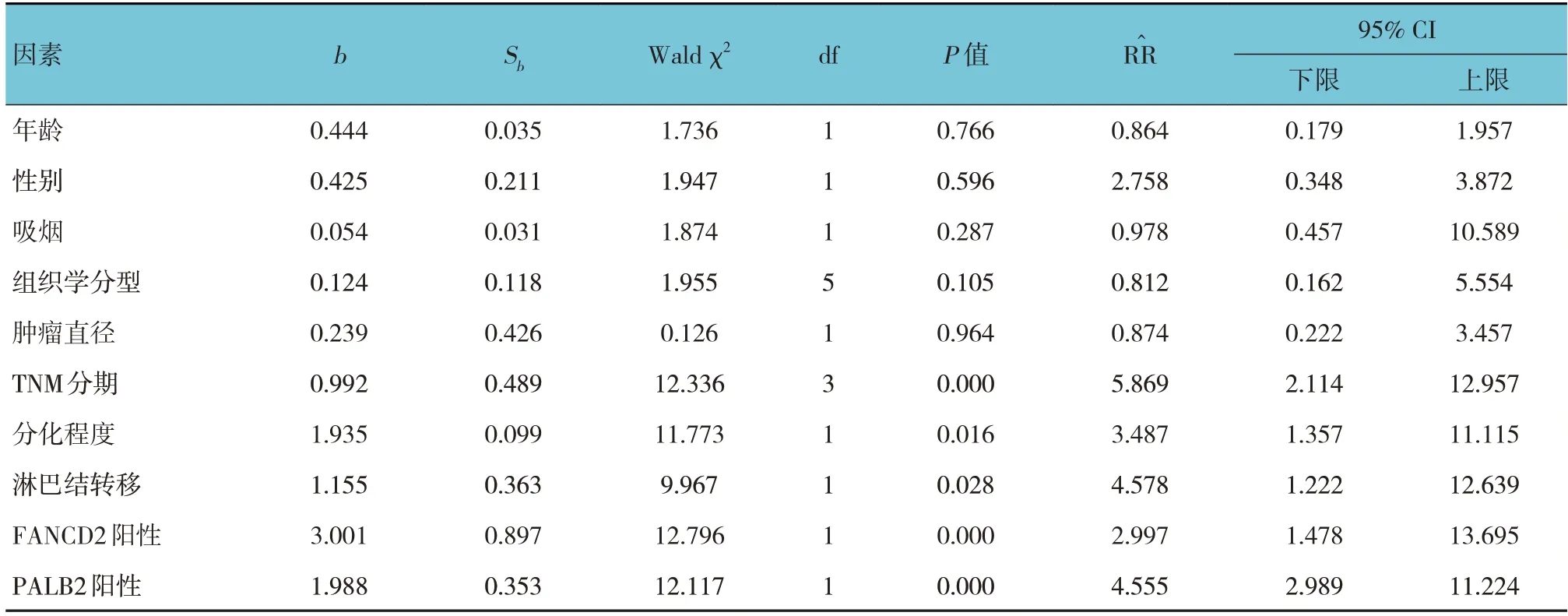
表5 NSCLC患者预后的单因素Cox回归模型分析参数
将NSCLC患者预后(生存= 0,死亡= 1)作为因变量,将单因素分析有意义TNM分期(Ⅰ/Ⅱ期= 0,Ⅲ/Ⅳ期= 1)、分化程度(中/高分化= 0,低分化= 1)、淋巴结转移(否= 0,是= 1)、FANCD2表达(阴性= 0,阳性= 1)和PALB2表达(阴性= 0,阳性= 1)的指标作为自变量,进行多因素逐步Cox回归分析(引入水准=0.05,排除水准=0.10),结果显示:TNM分期Ⅲ、Ⅳ期[=3.689,(95% CI:2.963,11.254)]、低分化[=2.167,(95% CI:1.998,5.996)]、淋巴结转移[=5.648,(95% CI:3.552,12.953)]、FANCD2阳性[=3.886,(95% CI:2.958,12.775)]、PALB2阳性[=4.633,(95% CI:1.968,11.547)]是NSCLC患者预后的影响因素(P<0.05)。见表6。
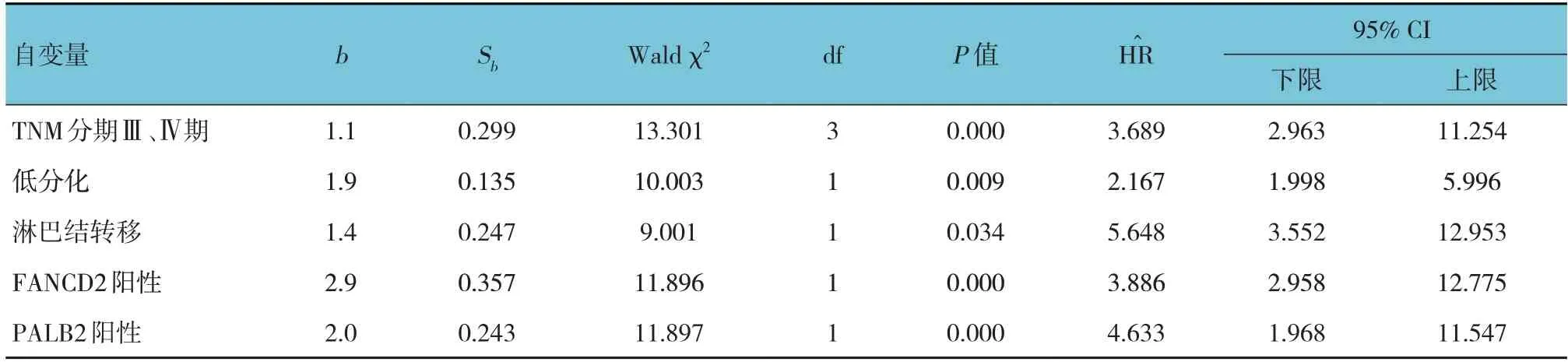
表6 NSCLC患者预后的多因素逐步Cox回归分析参数
2.6 癌组织中不同FANCD2、PALB2表达NSCLC患者的预后分析
截至随访结束,194例患者中102例(52.58%)生存。其中145例FANCD2阳性患者生存64例(44.13%),49例FANCD2阴性患者生存38例(77.55%);137例PALB2阳性患者存活62例(45.26%),57例PALB2阴性患者存活40例(70.18%)。FANCD2阳性患者与阴性患者生存率比较,经Log-rank χ2检验,差异有统计学意义(χ2=35.132,P=0.000),PALB2阳性患者与阴性患者的生存率比较,经Log-rank χ2检验,差异有统计学意义(χ2=36.157,P=0.000)。见图3、4。
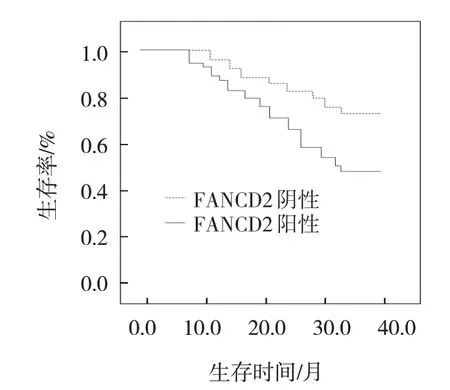
图3 FANCD2阴性和阳性NSCLC患者的生存曲线
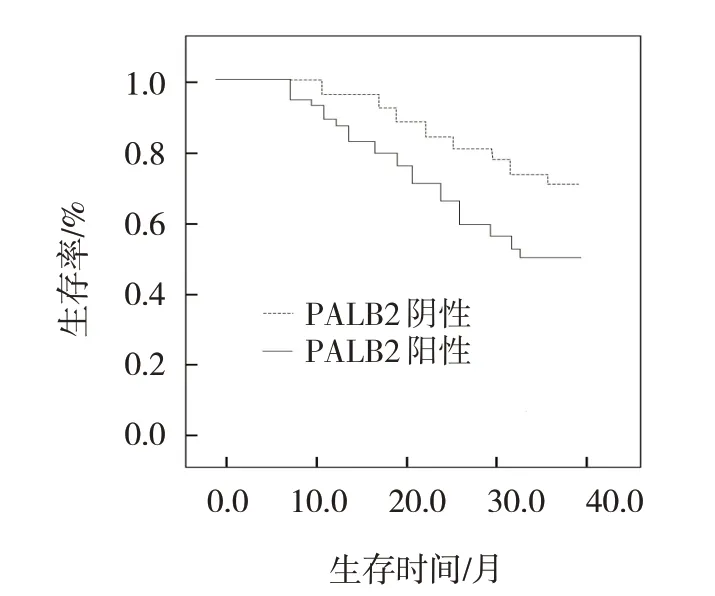
图4 PALB2阴性和阳性NSCLC患者的生存曲线
3 讨论
NSCLC约占肺癌患者的80%~85%,因不易被早期诊断,多数患者确诊时处于中晚期,预后较差[9]。据2020年全球癌症统计报告显示,肺癌的新发病例数高达220万,位居恶性肿瘤的第2位[10]。因此,寻找与NSCLC病情进展有关的标志物,对提高临床疗效及延长预后生存期非常关键。
FANCD2作为FA/BRCA通路的关键蛋白,其单泛素化后可参与恶性肿瘤患者DNA损伤后的同源重组修复过程[11]。朱娇等[12]研究发现,FANCD2基因突变是卵巢上皮癌患者预后的独立危险因素。FENG等[13]研究发现,FANCD2高表达与乳腺癌患者的低生存率有关,可作为预后评估的标志物。本研究结果显示,NSCLC组FANCD2阳性表达率高于癌旁组,提示FANCD2与NSCLC可能存在明显相关性。进一步对FANCD2与NSCLC患者临床特征的关系进行分析发现,TNM分期高、分化程度低、有淋巴结转移NSCLC患者的FANCD2阳性表达率更高,证实了FANCD2可能参与NSCLC的发生、发展。恶性肿瘤患者普遍存在DNA双链断裂现象,DNA断裂后可激活相关信号通路,刺激FANCD2表达并与相关修复蛋白共同移动至DNA断裂部位,协同发挥DNA修复作用[14]。既往相关研究发现,FANCD2低表达可增加DNA损伤和减少S期细胞,进而降低癌细胞的增殖能力[15]。推测FANCD2高表达可能是通过增强癌细胞增殖能力进而参与NSCLC的进展,当然具体联系及作用机制有待下一步进行细胞及动物实验验证。多因素Cox回归模型预后分析表明,TNM分期、分化程度、淋巴结转移、FANCD2表达、PALB2表达是NSCLC患者复发的影响因素,TNM分期、分化程度、淋巴结转移、FANCD2表达、PALB2表达是NSCLC患者预后的影响因素,提示癌组织中FANCD2表达是NSCLC患者复发和预后的影响因素,可作为预后评估的潜在标志物。NSCLC患者癌组织中FANCD2阳性可增加术后癌症复发的风险,减少生存收益。
PALB2是一种癌症易感基因,其基因位于16p12.2,在DNA损伤重组修复、基因组的稳定性维持、细胞周期调控等方面发挥重要作用[16]。既往研究发现,PALB2可使重组酶51移动至DNA损伤部位,从而修复化疗引起的DNA损伤,进而增加化疗药物的敏感性[17]。陆霞娟等[18]报道称,PALB2在胃癌黏膜组织中呈高表达,可作为胃癌患者预后不良生物的标志物。本研究结果显示,NSCLC组PALB2的阳性表达率高于癌旁组,提示PALB2可能在NSCLC发病及病情进展中发挥重要的作用。本研究结果显示,PALB2阳性表达与NSCLC患者TNM分期、分化程度、淋巴结转移显著相关,进一步证实PALB2可能与NSCLC的发生、发展有关。PALB2可通过末端特殊结构域与BRCA1、BRCA2相互作用,参与癌症患者DNA损伤后的同源性重组修复,并介导P53信号转导途径促进癌细胞增殖与分化[19]。相关研究发现,PALB2与BRCA1相关作用后可阻碍环鸟苷酸-腺苷酸合成酶-干扰素基因刺激蛋白途径,进而诱导恶性肿瘤的免疫抑制和T淋巴细胞浸润[20]。因此,推测PALB2可参与NSCLC发病及进展过程,但具体发病机制还需深入研究。
多因素逐步Cox回归模型预后分析表明,TNM分期、分化程度、淋巴结转移、FANCD2表达、PALB2表达是NSCLC患者复发的影响因素,TNM分期、分化程度、淋巴结转移、FANCD2表达、PALB2表达是NSCLC患者预后的影响因素,提示癌组织中PALB2表达是NSCLC患者复发和预后的影响因素,PALB2阳性与NSCLC患者生存率低有关,监测其表达情况可指导临床治疗方案制定。
综上所述,FANCD2、PALB2在NSCLC患者癌组织中呈高表达,与TNM分期、分化程度、淋巴结转移密切相关、可作为辅助评估患者生存和复发的潜在标志物。

