全肝容积灌注CT成像评估兔肝血流灌注及体积对肿瘤坏死率的影响*
刘智俊,罗光华,周宏,蒋孝先,廖华之,伍海彪
(南华大学附属第一医院 放射科,湖南 衡阳 421001)
实体肿瘤坏死程度反映了肿瘤内的缺氧水平,而缺氧与实体肿瘤放化疗敏感性及临床预后密切相关[1]。如何在术前精准评价肿瘤坏死成为肿瘤研究一大挑战之一。病理学检查作为判断肿瘤坏死程度的金标准,自身有较多不足,导致临床应用受限。而CT灌注成像特别是全脏器容积灌注成像具有相对无创性、覆盖广、可重复性高、可实时动态进行,以及与病理有较好相关性等多种优势,逐步成为研究活体肝肿瘤的血流灌注状态的首选影像学评价方法。本研究通过复制兔肝VX2移植瘤动物模型并采用全肝容积灌注CT成像(volume perfusion CT,VPCT),探讨肿瘤的有效血流灌注、肿瘤体积(tumor volume,TV)与肿瘤坏死率(tumor necrosis rate,TNR)的关系,为研究人肝细胞癌(hepatocellular carcinoma,HCC)肿瘤坏死程度的影像学检测提供新思路。
1 材料与方法
1.1 一般资料
55只不限雌雄的成年新西兰大白兔,4~5个月龄,体重2.2~2.8 kg,购自中南大学湘雅三医院动物实验中心[实验动物生产许可证号:SCXK(湘)2020-0002,实验动物使用许可证号:SYXK(湘)2020-0002]。采用随机抽样法选出5只进行开腹手术但不种瘤大白兔作为对照组(手术方法与实验组相同)。其余大白兔则按同一标准、同一开腹直接种瘤法[2](严格无菌手术开腹,将小瘤块直接种植于肝左叶深部并覆盖,关腹)复制兔肝VX2移植瘤动物模型作为实验组。实验组排除经解剖和病理证实为未成功成瘤的、肿瘤种植于肝表面的、后处理图像效果不佳的大白兔,最终共38只大白兔纳入研究。
1.2 方法
1.2.1 VPCT检查 麻醉药物采用3%戊巴比妥钠非挥发性麻醉剂,按1 mL/kg体重经耳缘静脉注射。动物模型复制成功后的第14天采用双源64层螺旋CT机(德国西门子公司)对两组行全肝VPCT,具体扫描方法及扫描参数如下:扫描完定位图像后,设计好扫描野以保证包含了全肝。采用CT机无缝连续动态往复扫描模式来实现容积灌注成像检查,采用双筒高压注射器(美国理博有限公司)注射非离子型对比剂碘佛醇(33.9 g/50 mL)(江苏恒瑞医药有限公司),按1 mL/kg、1 mL/s经留置针注入耳缘静脉,随即按同流率经静脉团注5 mL生理盐水冲洗。静脉团注完后延迟6 s,按80 kVp管电压、50 mAs管电流、1.0 mm螺距、球管每0.33 s旋转1周、48 mm探测器宽度的扫描参数连续扫描61 s,以1.5 mm层厚、1.5 mm层间距、512×512重建矩阵、B30f卷积核值进行图像重建,最终获得30组容积数据(共包含930幅图像)并全部传输至配套的图像后处理工作站(Syngo MuliModality Workplace)。
1.2.2 TV、TNR及灌注后处理 TV、TNR及灌注后处理由2名高年资腹部影像诊断副主任医师亲自指导。同一只大白兔的TV重复处理、测量3次后取平均值,TNR及灌注参数亦按同法求平均值,如有不同意见则加入第三位高年资腹部影像诊断副主任医师讨论确定。选用在全肝VPCT动脉期肿瘤实质达强化峰值且对比最佳的肿瘤最大横截面图像作为目标图像(增强动脉期第6组肿瘤图像多呈显著环形强化且对比度最佳,符合目标图像特点,故第6组最大横截面图像作为首选)。
TV计算公式为:V=1/2ab2。a为肿瘤最大径,两极定义为在目标图像上肿瘤最大横截面上强化的最外缘;b为肿瘤最小径,两极定义为垂直于a的最外缘[3-4]。
TNR定义为在目标图像上无强化的坏死区横截面积与肿瘤最大横截面积的比值。在工作站目标图像上手绘出中央不强化的坏死区域获得肿瘤坏死区横截面积,按同法在同一目标图像上手绘出肿瘤最大横截面上强化的最外缘得到肿瘤最大横截面积。
选择VPCT Body灌注软件中的肝脏灌注应用模块进行灌注后处理,获得肝灌注血流量(blood flow,BF)、灌注血容量(blood volume,BV)、动脉灌注量(arterial liver perfusion,ALP)、门静脉灌注量(portal vein perfusion,PVP)、动脉灌注指数(hepatic perfusion index,HPI)等全肝VPCT参数及彩图。
1.2.3 病理学检查 实验完后立即将实验组安乐死,取出肿瘤标本进行HE染色。染色后,置于低倍镜下(×10)观察切片整体坏死情况,再转至高倍镜(×40)下观察肿瘤实质与坏死的交界区情况。
1.3 统计学方法
数据分析采用SPSS 23.0统计软件。计量资料以均数±标准差(±s)表示。比较用单因素方差分析,两两比较用Dunnett-t检验;相关性分析用Pearson法。P<0.05为差异有统计学意义。
2 结果
2.1 实验组癌组织、癌旁组织及对照组肝组织的全肝VPCT参数比较
实验组癌组织、癌旁组织及对照组肝组织BF、BV、ALP、PVP、HPI比较,差异均有统计学意义(P<0.05)。实验组癌组织与对照组肝组织BF、BV、ALP、PVP、HPI比较,差异均有统计学意义(P<0.05),实验组癌旁组织与对照组肝组织BF、BV、ALP、PVP、HPI比较,差异均无统计学意义(P>0.05)。见表1。
表1 实验组癌组织、癌旁组织及对照组肝组织的全肝VPCT参数比较 (±s)

表1 实验组癌组织、癌旁组织及对照组肝组织的全肝VPCT参数比较 (±s)
组别实验组癌组织实验组癌旁组织对照组肝组织F 值P 值n 38 38 5 BF/[mL/(100 mL·min)]248.15±74.17 200.89±71.44 204.54±2.74 4.403 0.015 BV/[mL/(100 mL·min)]23.72±7.17 20.02±7.08 19.62±2.03 2.943 0.049 ALP/[mL/(100 mL·min)]65.07±9.54 42.19±7.84 40.43±1.45 74.335 0.000 PVP/[mL/(100 mL·min)]14.49±2.40 121.84±9.38 119.39±5.39 2 515.780 0.000 HPI/%82.05±3.22 25.57±2.96 25.30±0.37 3 543.545 0.000
2.2 相关性分析
实验组平均TNR为(22.56±7.10)%。Pearson相关性分析显示,TNR与ALP、HPI呈负相关(r=-0.410和-0.356,P=0.010和0.028),TNR与BF、BV、PVP无相关性(r=-0.016、-0.155和0.256,P=0.924、0.353和0.121)。见图1、2。
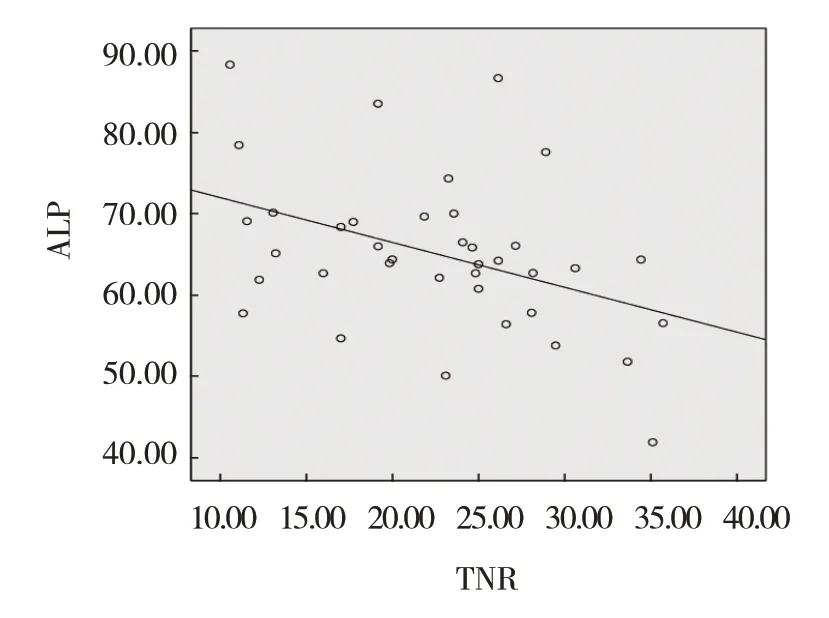
图1 TNR与ALP相关性散点图

图2 TNR与HPI相关性散点图
实验组肝VX2移植瘤TV平均为(1.87±1.61)cm3。Pearson相关性分析显示,TV与BF、BV、PVP、ALP、HPI无相关性(r=0.062、0.292、0.140、0.142和0.014,P=0.709、0.076、0.401、0.396和0.933)。
Pearson相关性分析显示,肝VX2移植瘤TNR与TV无相关性(r=-0.098,P=0.559)。
2.3 CT与病理学检查结果
在图像工作站上发现,实验组肿瘤位于腹中线肝内种瘤位置,各兔肿瘤直径不一,但可见数量均为1个,绝大部分呈类圆形或类椭圆形。与癌旁组织比较,平扫上肿瘤边缘区呈等、稍低混杂密度而中心呈不均匀低密度,边界不清,动态增强上肿瘤边缘区动脉期快速显著环形强化且接近腹主动脉强化程度,接着强化快速减弱,在肝动脉灌注彩图上呈现边缘环形高灌注,而中央一直无明显强化或低灌注状态。
将肿瘤标本置于低倍镜及高倍镜下观察,横截面移植瘤边缘区主要为环形异型性肿瘤细胞并夹杂较多粗细不均的肿瘤血管,中央主要为凝固性坏死。见图3~5。

图3 兔肝VX2移植瘤ALP、BF、BV、PVP、HPI的CT图
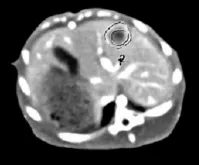
图4 全肝VPCT动脉期肿瘤实质达强化峰值且对比最佳的肿瘤最大横截面CT图
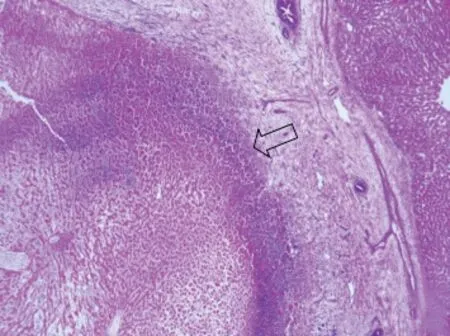
图5 实验组肝VX2移植瘤病理切片 (HE染色×40)
3 讨论
VX2肿瘤是应用非常广泛的恶性肿瘤动物模型,涉及很多研究领域且根据成瘤的部位可分为如肝移植癌、骨移植癌、乳腺移植癌、肺移植癌、脑移植癌、肾移植癌、肌肉移植癌等[2,5-8]。本研究结果发现,实验组兔肝VX2移植瘤边缘区癌组织的BF、BV、ALP、HPI高于癌旁组织及对照组肝组织,而PVP则低于癌旁组织及对照组肝组织。TONG等[2]通过对兔肝VX2移植瘤改良模型行对比增强CT检查,YI等[9]通过超声引导穿刺建立兔肝VX2移植瘤动物模型并行对比增强超声,均实验得出兔肝VX2移植瘤的肝血流灌注发生了显著变化并于增强后肿瘤边缘区实质呈“快进快出”强化模式,且血供主要来自于动脉。梁长华等[10]通过对HCC行CT全肿瘤灌注显示HCC的血供是由门静脉供血为主渐渐过渡到动脉供血为主。这些结果表明,兔肝VX2移植瘤与人HCC之间的血供特征有很好的相似性,因而非常适合用于研究人HCC的动物肝肿瘤模型。
刘晓等[11]研究发现全肝VPCT可替代微血管密度定量,评估兔VX2肝肿瘤经导管动脉化疗栓塞术治疗前后的肝血流动力学变化对肿瘤的预后有重要的指导价值。但该学者未提及对肿瘤预后有着重要影响的肿瘤坏死情况。本研究通过测量计算获得实验组兔肝VX2移植瘤坏死的平均TNR值,并与灌注参数进行相关系分析,发现TNR与ALP、HPI呈负相关,与BF、BV、PVP无相关性,因而提示肿瘤坏死与微血管密度有密切关系,进而影响临床预后。HUGHES等[12]及LUO等[13]指出肿瘤坏死是肿瘤代谢失平衡造成,并且与多种因素有关,但主要原因是由于供血、供氧不足。当肿瘤血管不足可导致肿瘤代谢失平衡,相较于边缘区的肿瘤细胞,中央区域比边缘区的肿瘤细胞承受更为严重的代谢压力,导致肿瘤中央区域出现坏死。而肿瘤边缘区的肿瘤细胞代谢压力较小,这就非常有益于肿瘤血管的生成和血管生成所需的诱导因子的趋化,另外还可以通过血管共择、血供重塑等途径得到供血,因而不难理解,与肿瘤中央区域相比,肿瘤边缘区血管较为丰富[14]。本研究实验组动物种瘤方式、种瘤标准、从种瘤到检查的天数均基本一致,但最终观察到各个体的TV及肿瘤坏死范围均不一致,这从侧面揭示了肿瘤与个体宿主之间相互作用的不一致性。随着反映肿瘤动脉灌注的ALP、HPI越低,TNR就会相应地越高,反之亦然,但反映门静脉灌注的PVP则与TNR无明显关系,说明肿瘤坏死与否可能主要是由肿瘤的动脉灌注多少来决定的,而可能与门静脉灌注量无明显关系。IPPOLITO等[15]在研究中揭示高动脉灌注的肿瘤对抗血管治疗有较好的反应,因此可作为预后因素,而本研究中TNR与代表肿瘤动脉灌注的ALP、HPI负相关,提示肿瘤坏死程度越高,预后可能会越差。
本研究通过分析兔肝VX2移植瘤TNR与TV之间的关系,发现两者之间无相关性,与其他研究的结论一致。如LI等[16]通过对兔VX2移植瘤行动态MRI增强显示,在种瘤后第1周开始出现肿瘤坏死,并且坏死程度随着TV增大而加大,但第2周后,两者的这种线性变化关系就消失了,由此推断出肿瘤的坏死程度与肿瘤快速增长而肿瘤血管形成不足导致血供不足有关。众所周知,肿瘤血管形成是肿瘤发展的标志,SZASZ等[17]指出肿瘤血管形成不足是引起肿瘤坏死的主因,而肿瘤血管形成与多种因素有关,如缺氧、压力、毒素、温度、多种促血管生成因子、抑血管生成因子、pH值降低、肿瘤代谢物、肿瘤的淋巴引流等,这些因素相互作用、相互影响,故所导致的肿瘤坏死情况也错综复杂,因而TNR与TV之间不一定一直会呈明显的相关性。
本研究的不足之处在于,研究样本量及病理学指标相对较少,且未对种瘤后的全过程进行动态的检测,如今后在研究中加大样本量、检测指标并动态检查,可能更能进一步证实本实验结果或发现新的、尚未揭示的与血管生成、肿瘤坏死相关的影像学检查指标。
综上所述,本研究结果表明肿瘤坏死程度可能与全肝VPCT反映的肿瘤动脉灌注不足有关,与TV无明显关联。人HCC肿瘤坏死的全肝VPCT对临床预后有指导价值,并可为靶向血管生成药物治疗的疗效评估、介入栓塞治疗的疗效评估等治疗反应的影像学检测提供思路。

