超声引导下中医内热针治疗腰椎内固定术后腰痛的疗效分析及对血清5-HT、SP、β-EP水平的影响*
黄竞威,郝霞,江顺波,钟妍苑,周林,叶薇,刘海全,谭志宏
(1.惠州市中医医院 骨科,广东 惠州 516001;2.惠城区中医医院 骨科,广东 惠州 516001;3.广州中医药大学,广东 广州 510006)
腰椎内固定术是一种治疗腰椎间盘突出、腰椎骨折、椎体滑脱等腰椎疾病的手术,该手术能够解决患者因神经压迫而出现的疼痛,并恢复患者腰椎功能,但部分患者术后会出现持续性、反复发作的腰痛症状,即腰椎术后综合征(failed back surgery syndrome,FBSS)腰痛[1-2]。FBSS治疗难度较大,易转归为慢性疼痛,影响患者生活质量。目前对FBSS腰痛的治疗以保守治疗为主,西医主要依赖长期服用镇痛药、激素类药物进行干预,但长期服药易发生胃肠道不适、骨质疏松等不良反应[3]。中医内热针是一种结合了现代技术的针刺疗法,其通过恒温加热器加热,可发挥稳定深入的热效应,主要应用于软组织损伤性疼痛的治疗[4-5]。有临床研究报道,内热针可明显减轻颈肩腰痛患者的疼痛,提高其运动功能与生活能力[6]。本研究采用超声引导提高内热针治疗的准确性,并使用红外热成像技术(infrared thermal imaging,IRTI)图像、生活质量量表评估疗效,以便更全面地分析中医内热针对FBSS腰痛的疗效,为临床治疗提供理论依据。
1 资料与方法
1.1 一般资料
选取2021年1月—2022年11月惠州市中医医院收治的80例腰椎内固定术后腰痛患者,脱落后共63例,采取区组随机方法将其分为实验组(32例)、对照组(31例)。实验组男性15例,女性17例;年龄37~79岁,平均(58.04±10.27)岁;病程2~6个月,平均(4.03±1.22)个月;病变节段:L3~4段5例,L4~5段16例,L5~S1段11例。对照组男性14例,女性17例;年龄37~80岁,平均(58.42±10.31)岁;病程2~6个月,平均(4.05±1.20)个月;病变节段:L3~4段4例,L4~5段16例,L5~S1段11例。两组性别构成、年龄、病程等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会审批通过(批号:2021-02号),患者签署知情同意书。
1.2 纳入与排除标准
1.2.1 纳入标准 ①术前腰椎CT或磁共振成像(magnetic resonance imaging,MRI)结果提示相应椎间盘突出;②体格检查有相应棘突及椎旁压痛;③行腰椎内固定术后出现腰部疼痛;④年龄35~80岁。
1.2.2 排除标准 ①经MRI复查提示椎管内存在病理改变、术后残余椎间盘或骨质碎片脱落进入椎管内导致疼痛;②合并骨性椎管狭窄、椎间盘钙化及马尾神经综合征;③合并其他可出现腰痛症状的疾病;④腰椎术后继发感染;⑤因惧怕等原因不配合治疗;⑥合并严重心脑血管疾病;⑦合并肿瘤、炎症等疾病;⑧合并腰椎或骶椎肿瘤、结核;⑨合并凝血功能异常;⑩未按规定接受治疗或未完成术后随访。
1.3 治疗方法
两组均给予五点支撑法训练配合飞燕式训练进行基础治疗,2次/d,每次15~30下。五点支撑法:以头、双肘、双足底为支撑点,臀部抬离床面,深吸气,缓慢复位,如此反复。飞燕式训练:患者取俯卧位,抬头,双手向后伸直相握,头、上肢及背部后伸与床面呈40~45 °,然后深吸气,缓慢回复位,如此反复。对照组在基础治疗前提下给予塞来昔布胶囊。塞来昔布胶囊(美国辉瑞制药有限公司,国药准字J20140072,规格:0.2 g×6粒/盒)0.2 g/次,1次/d,疗程持续2周。实验组在对照组基础上给予超声(美国GE公司,型号LOGIQE11)引导下中医内热针治疗。中医内热针1次/周,共2次。内热针操作步骤:①患者取俯卧位,腰背部消毒铺巾,戴无菌手套,在超声引导下选择双侧肾腧穴、双侧大肠腧穴及阿是穴,避开血管、神经、脏器标记多个进针点,在标记点进行局部麻醉;②麻醉起效后,在超声引导下进行穿刺,穿刺过程中避开内固定装置及神经根等结构,根据超声影像选择直刺或斜刺,深度选择直达肌肉或筋膜等在骨骼上的附着点;③穿刺到位后,连接内热针治疗仪(深圳市百士康医疗设备有限公司,规格型号:NRZ-40R-B型,粤械标准20172271001),通电设置恒温43 ℃,治疗20 min;④结束后,拔除内热针,针孔按压、消毒,以无菌敷料覆盖;⑤叮嘱患者保持敷料干洁,不沾水,3 d后自行拆除。
1.4 观察指标
1.4.1 疗效 痊愈:症状消失,直腿抬高> 70 °,生活工作恢复;显效:症状明显减轻,直腿抬高46~70 °,生活工作基本恢复;有效:症状有一定减轻,直腿抬高30~45 °,生活工作轻度受限;无效:症状无改善,直腿抬高< 30°,生活工作受限较大[7]。总有效率=(痊愈+显效+有效)/总例数×100%。
1.4.2 腰椎活动度 分别于治疗前,以及治疗后2、4、12周测量两组前屈角、后伸角、侧屈角。
1.4.3 疼痛评分及腰椎功能评分 分别于治疗前,以及治疗后2、4、12周采用视觉模拟评分法(visual analog scale,VAS)[8]评估两组疼痛情况,总分0~10分,分值越高提示疼痛越剧烈。采用日本骨科协会(Japanese Orthopaedic Association,JOA)[9]评分评估两组腰椎功能,从临床特征、主观症状、日常生活受限度3个方面进行评估,总分0~29分,分值越高提示腰椎功能越好。
1.4.4 疼痛介质 分别于治疗前,以及治疗后2、4、12周抽取两组患者空腹静脉血5 mL,3 500 r/min离心10 min,取血清。通过酶联免疫吸附试验检测5-羟色胺(5-hydroxytryptamine,5-HT)、β-内啡肽(β-endorphins,β-EP)水平,通过双抗体夹心法检测P物质(substance P,SP)水平。
1.4.5 生活质量 采用健康调查简表(short-form 36 questionnaire,SF-36)[10]评估两组治疗前,以及治疗后2、4和12周生活质量,从健康状况、生理机能等方面进行评估,计算总分,满分145分,分值越高提示生活质量越高。
1.4.6 不良反应 记录两组治疗期间发生的不良反应,包括局部肿胀、发热、腹泻、头痛。
1.4.7 红外热图 分别于治疗前,以及治疗后2、4和12周使用红外热成像仪(武汉迈迪克光电股份有限公司,型号:MDK-M01L)观察两组患者腰背区域温度变化。
1.5 统计学方法
数据分析采用SPSS 22.0统计软件。计量资料以均数±标准差(±s)表示,比较用重复测量设计的方差分析;计数资料以率(%)表示,比较用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组临床疗效比较
实验组与对照组总有效率比较,经χ2检验,差异有统计学意义(χ2=4.510,P=0.034);实验组总有效率高于对照组。见表1。
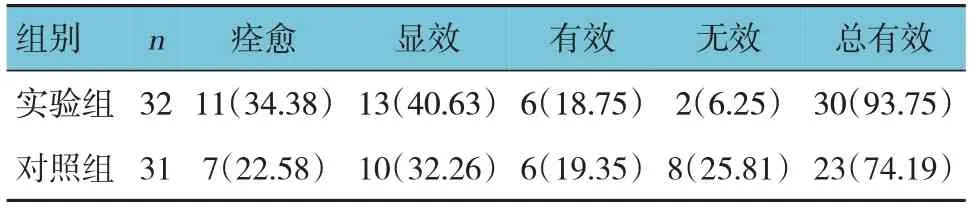
表1 两组临床疗效比较 例(%)
2.2 两组治疗前后腰椎活动度的变化
实验组与对照组治疗前,以及治疗后2、4和12周腰椎活动度比较,经重复测量设计的方差分析,结果:①不同时间点前屈、后伸、侧屈角度比较,差异均有统计学意义(F=25.462、18.351和17.628,均P=0.000);②实验组与对照组的前屈、后伸、侧屈角度比较,差异均有统计学意义(F=11.373、10.428和10.759,均P=0.000),治疗后实验组前屈、后伸、侧屈角度较对照组大;③实验组与对照组前屈、后伸、侧屈角度变化趋势比较,差异均有统计学意义(F=20.469、16.376和14.287,均P=0.000)。见表2~4。
表2 两组治疗前后前屈角度比较 [(°),±s]

表2 两组治疗前后前屈角度比较 [(°),±s]
注:†与治疗前比较,P <0.05。
组别实验组对照组治疗12周87.19±4.08†80.26±3.96†n 32 31治疗前52.36±5.71 53.02±5.85治疗2周82.19±4.05†76.74±4.15†治疗4周85.04±4.16†78.36±4.22†
表3 两组治疗前后后伸角度比较 [(°),±s]
注:†与治疗前比较,P <0.05。
组别实验组对照组治疗后12周27.42±2.71†22.63±2.96†n 32 31治疗前11.87±2.74 12.05±2.81治疗后2周22.46±3.21†18.31±3.42†治疗后4周26.53±3.39†21.17±3.64†
表4 两组治疗前后侧屈角度比较 [(°),±s]
注:†与治疗前比较,P <0.05。
组别实验组对照组治疗后12周28.73±3.04†23.65±2.88†n 32 31治疗前13.57±2.66 13.84±2.72治疗后2周24.86±2.75†20.59±2.36†治疗后4周27.33±2.91†22.24±2.71†
2.3 两组治疗前后VAS、JOA评分的变化
实验组与对照组治疗前,以及治疗后2、4和12周VAS、JOA评分比较,经重复测量设计的方差分析,结果:①不同时间点VAS、JOA评分比较,差异均有统计学意义(F=13.267和21.749,均P=0.000);②实验组与对照组VAS、JOA评分比较,差异均有统计学意义(F=8.964和9.635,均P=0.000),治疗后实验组VAS评分较对照组低,JOA评分较对照组高;③实验组与对照组VAS、JOA评分变化趋势比较,差异均有统计学意义(F=11.068和18.362,均P=0.000)。见表5。
表5 两组治疗前后VAS、JOA评分比较 (分,±s)
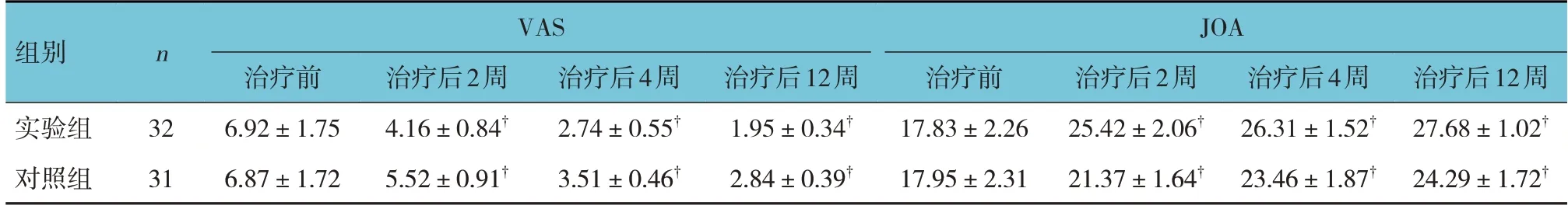
表5 两组治疗前后VAS、JOA评分比较 (分,±s)
注:†与治疗前比较,P <0.05。
VAS JOA组别n 治疗后2周25.42±2.06†21.37±1.64†治疗后4周26.31±1.52†23.46±1.87†实验组对照组治疗后12周27.68±1.02†24.29±1.72†治疗后4周2.74±0.55†3.51±0.46†治疗前6.92±1.75 6.87±1.72治疗后12周1.95±0.34†2.84±0.39†治疗后2周4.16±0.84†5.52±0.91†治疗前17.83±2.26 17.95±2.31 32 31
2.4 两组治疗前后疼痛介质水平的变化
实验组与对照组治疗前,以及治疗后2、4和12周5-HT、SP、β-EP水平比较,经重复测量设计的方差分析,结果:①不同时间点5-HT、SP、β-EP水平比较,差异均有统计学意义(F=21.865、22.482和18.337,均P=0.000);②实验组与对照组5-HT、SP、β-EP水平比较,差异均有统计学意义(F=5.856、7.793和4.862,均P=0.000),治疗后实验组5-HT、β-EP水平较对照组高,SP水平较对照组低;③实验组与对照组5-HT、SP、β-EP水平变化趋势比较,差异均有统计学意义(F=17.339、18.447和13.712,均P=0.000)。见表6~8。
表6 两组治疗前后5-HT比较 (ng/L,±s )
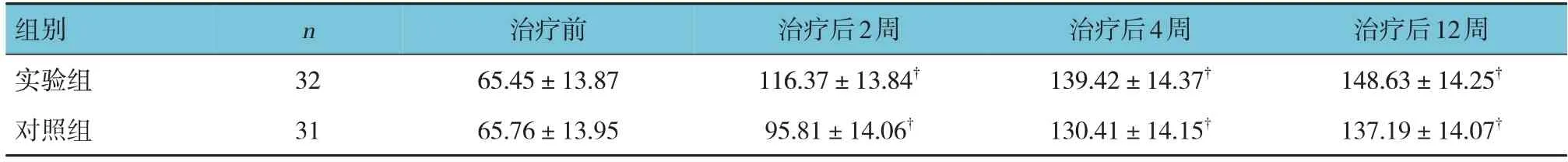
表6 两组治疗前后5-HT比较 (ng/L,±s )
注:†与治疗前比较,P <0.05。
组别实验组对照组治疗后12周148.63±14.25†137.19±14.07†n 32 31治疗前65.45±13.87 65.76±13.95治疗后2周116.37±13.84†95.81±14.06†治疗后4周139.42±14.37†130.41±14.15†
表7 两组治疗前后SP比较 (μg/mL,±s )
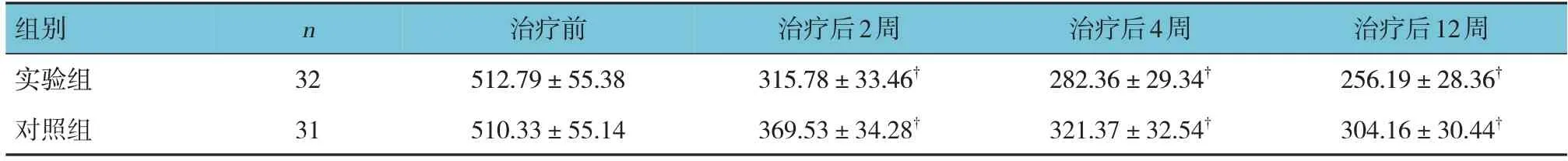
表7 两组治疗前后SP比较 (μg/mL,±s )
注:†与治疗前比较,P <0.05。
组别实验组对照组治疗后12周256.19±28.36†304.16±30.44†n 32 31治疗前512.79±55.38 510.33±55.14治疗后2周315.78±33.46†369.53±34.28†治疗后4周282.36±29.34†321.37±32.54†
表8 两组治疗前后β-EP比较 (ng/mL,±s )
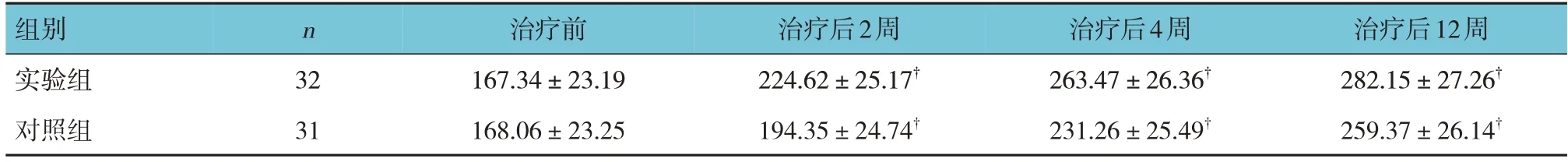
表8 两组治疗前后β-EP比较 (ng/mL,±s )
注:†与治疗前比较,P <0.05。
组别实验组对照组治疗后12周282.15±27.26†259.37±26.14†n 32 31治疗前167.34±23.19 168.06±23.25治疗后2周224.62±25.17†194.35±24.74†治疗后4周263.47±26.36†231.26±25.49†
2.5 两组治疗前后SF-36评分的变化
实验组与对照组治疗前,以及治疗后2、4和12周SF-36评分比较,经重复测量设计的方差分析,结果:①不同时间点SF-36评分比较,差异有统计学意义(F=39.167,P=0.000);②实验组与对照组SF-36评分比较,差异有统计学意义(F=8.395,P=0.000),治疗后实验组SF-36评分较对照组高;③实验组与对照组SF-36评分变化趋势比较,差异有统计学意义(F=24.338,P=0.000)。见表9。
表9 两组治疗前后SF-36评分比较 (分,±s )

表9 两组治疗前后SF-36评分比较 (分,±s )
注:†与治疗前比较,P <0.05。
组别实验组对照组治疗后12周132.44±8.04†120.39±7.22†n 32 31治疗前56.32±4.71 56.63±4.76治疗后2周117.43±7.29†102.35±6.44†治疗后4周125.16±7.81†112.47±6.95†
2.6 两组不良反应比较
实验组与对照组治疗期间不良反应总发生率比较,经χ2检验,差异无统计学意义(χ2=1.059,P=0.304)。见表10。
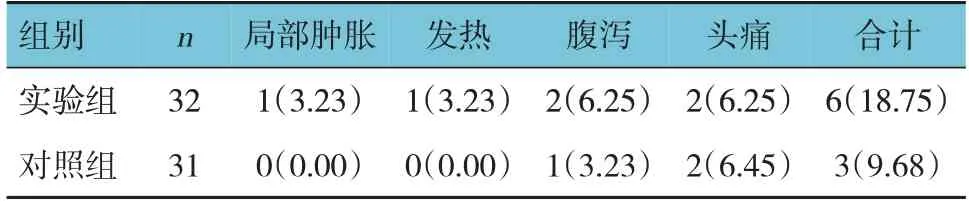
表10 两组治疗期间不良反应比较 例(%)
2.7 两组治疗前后红外热图比较
治疗前,两组肾腧穴、大肠腧穴、阿是穴区域图像无明显差异。治疗后2、4和12周,实验组针刺穴位区域温度图像趋于正常水平,对照组与治疗前无明显变化。见图1。
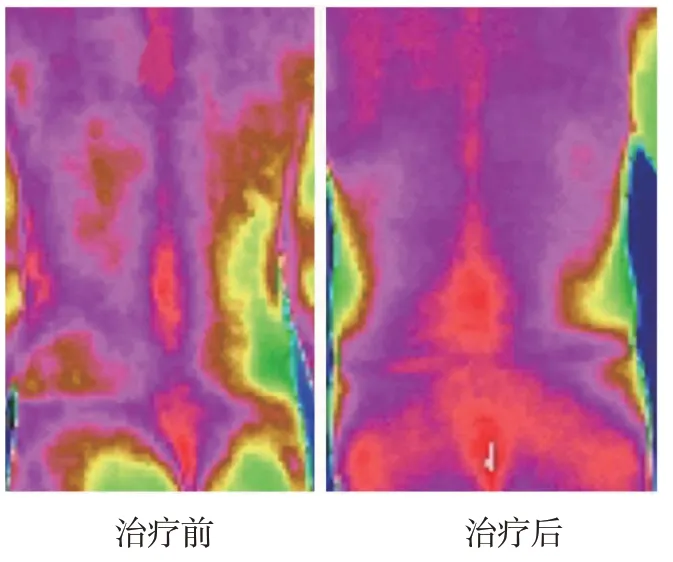
图1 实验组典型病例治疗前后红外热图
3 讨论
西医对FBSS腰痛的发病机制尚无确切定论,认为可能与手术定位失误、术后自身免疫性炎症、硬膜外瘢痕黏连等有关[11]。FBSS腰痛的治疗首选保守治疗,例如给予镇痛药物或功能训练等,对于保守治疗无效者,则可给予微创介入治疗或手术治疗,如脊髓神经电刺激、硬膜外神经根黏连松解术等[12-13]。中医理论中认为FBSS腰痛的基本病因多为肾亏体虚、劳损外伤等,加之外邪侵袭,腰府筋脉气血运行不畅,经脉痹阻,气滞血瘀,不通则痛[14],因此治疗多采用具有疏通经络等效果的药物,以针刺疗法为主,从根本上解决病机[15-16]。
本研究结果显示,实验组总有效率优于对照组,治疗后2、4和12周,实验组腰椎活动度改善程度大于对照组,实验组VAS评分低于对照组,JOA评分高于对照组,SF-36评分高于对照组,提示超声引导下中医内热针对FBSS腰痛患者具有较好疗效,可显著减轻患者疼痛症状,改善腰椎功能,并改善远期生活质量。中医内热针由中医温针灸发展而来,引入了现代可调温式恒温加热技术,深入肌肉或筋膜起止点,使其具有更加稳定、深入的针刺效应及热效应[17]。内热针通过针刺导热,能够改善周围软组织血液循环,从中医角度来看可解决“不通则痛”的病机,减轻疼痛;从西医角度看,可减轻损伤部位无菌性炎症病理基础,消除疼痛[18]。张丽霞等[19]研究显示,内热针针刺腰夹脊穴可减轻腰椎间盘突出症患者腰部疼痛并恢复其活动功能。同时,中医内热针能够活跃椎间盘周围神经肌肉接头终板电位,使这些肌纤维细胞内钙离子浓度上升,强直收缩变短,缓解腰椎神经根周围肌肉痉挛,降低肌肉张力,减轻疼痛,恢复机体功能;还具有营养腰椎神经根及其他微小神经,促进损伤的软组织愈合的作用[20-21]。目前对内热针治疗慢性软组织疼痛的机制尚无定论,多位学者对其治疗机制进行了探讨。段轶轩等[22]认为,内热针通过调节背根神经节及脊髓背角iGluRs的表达,抑制脊髓背角C纤维、Aδ纤维的长期增强作用,促进Aβ纤维的长期增强作用,以缓解中枢敏化,减轻疼痛。骆小娟等[23]的动物实验结果表明,内热针能抑制Akt/NF-κB信号通路,进而减轻炎症水平,缓解疾病。
另外,本研究结果显示,治疗后2、4、12周,实验组5-HT、β-EP水平高于对照组,SP水平低于对照组,实验组针刺穴位区域呈现明显高温图像,对照组与治疗前比较无明显差异,提示超声引导下中医内热针可调节机体疼痛介质水平,改善血液循环。5-HT是一种抑制性神经递质,广泛存在于大脑皮层质及神经突触中,能够通过抑制神经活动达到减轻痛觉的效果。SP是一种传递痛觉的神经递质,其能够兴奋脊髓背角中伤害感受性神经元。当机体发生病理变化时,β-EP水平升高可发挥镇痛效果[24]。IRTI是使用光电技术检测物体热辐射的红外线特定波段信号,并将该信号转换成图像和图形的影像学技术[25]。IRTI具有无辐射、操作简便等优点,其在组织损伤、颈腰腿疼痛等的临床诊断、疗效评价上均有较高价值[26-27]。当组织存在慢性炎症或纤维化时,组织代谢、血液循环出现异常,表现为体表热值异常,因此红外热图与正常组织之间有差异[28]。本研究结果显示,治疗后实验组红外热图趋于正常水平,其原因可能是内热针可减轻炎症反应,改善血液循环,使体表温度趋于正常。
本研究还对两组治疗期间不良反应进行观察,结果显示,两组不良反应总发生率无明显差异,提示超声引导下内热针治疗安全性较高。
综上所述,超声引导下中医内热针可减轻患者疼痛,平衡5-HT、SP、β-EP水平,改善其腰椎功能及生活质量,同时不良反应较少,对腰椎内固定术后腰痛患者具有较好疗效,可临床推广应用。

