MRI联合血清Periostin、SDF-1对前列腺癌的诊断价值研究*
李婷,丁敬宾,辛海贝
(1.宁夏医科大学总医院 放射科,宁夏 银川 750004;2.西安市第九医院 康复医学科,陕西 西安 710054)
前列腺癌(prostate cancer,PCa)是男性发病率较高的癌症,以老年人居多,尽管在治疗方面取得了一定进展,但前列腺癌依旧是影响患者健康生活的重要问题[1]。尤其是对于良性前列腺疾病的过度诊断和对转移性前列腺癌的治疗不足,严重影响患者正常生活甚至危及生命[2]。磁共振成像(magnetic resonance imaging,MRI)是临床常见的前列腺癌诊断手段,效果较好,多参数结合高分辨率T2WI MR成像技术可以提高前列腺癌的检出水平[3]。随着生物技术的发展,血清因子用于癌症诊断的研究越来越多。骨膜素(Periostin)是一种多面细胞外基质蛋白,参与多种生理功能,如骨再生、心脏重塑及炎症过程。这种蛋白质充当许多其他蛋白质的支架,是细胞到基质信号传导和上皮-间充质转化的介质,有利于癌症进展[4-5]。基质细胞衍生因子1(stromal cell-drived factor-1,SDF-1)是CXC趋化因子亚家族的成员,也称为CXCL12,是生长发育过程中的重要细胞因子,介导慢性炎症,可诱发包括前列腺癌在内的肿瘤进展[6]。为更准确地鉴别前列腺癌与前列腺良性疾病(benign prostatic hyperplasia,BPH),本研究分析了经病理学证实的前列腺癌患者与BPH患者的MRI特征及血清Periostin、SDF-1表达水平,以期为前列腺癌准确诊断提供理论依据。
1 资料与方法
1.1 一般资料
选取2019年2月—2021年2月宁夏医科大学总医院收治的144例疑似前列腺癌患者,均行手术病理证实。其中,前列腺癌患者76例作为前列腺癌组,BPH患者68例作为BPH组。前列腺癌组年龄42~80岁,平均(63.21±18.64)岁;平均体质量指数(23.21±3.29)kg/m2。BPH组年龄38~76岁,平均(62.18±17.85)岁;平均体质量指数(23.94±3.67)kg/m2。纳入标准:①影像资料完整;②临床资料完整;③行手术病理检查。排除标准:①其他恶性肿瘤;②MRI检查前进行穿刺或手术;③接受过放疗、化疗。两组患者平均年龄、BMI比较,差异均无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准,患者及家属签署知情同意书。
1.2 方法
1.2.1 MRI检查 采用美国GE公司3.0T超导MR机,腹部线圈,平卧位,轴位T1WI、T2WI扫描后,行动态对比增强磁共振成像(dynamic contrast enhancedmagnetic resonance imaging,DCE-MRI):静脉快速团注对比剂,对比剂用量0.2 mmol/kg,先完成1次LAVA扫描,再团注对比剂,连续扫描30次。肝脏快速容积采集技术(liver acquisition with volume acceleration,LAVA)序列:重复时间(repetition time,TR)/回波时间(time of echo,TE)=3.3 ms/1.5 ms,翻转角12°,矩阵320×320,视野(field of view,FOV) 33 cm×33 cm,层厚4 mm,NEX= 1。弥散加权成像(diffusion weighted imaging,DWI)扫描:TR/TE= 5 200 ms/73 ms,FOV=27 cm×27 cm,矩阵128×160,层厚4 mm,层间隔1 mm,NEX= 6。扩散敏感系数(b值)1 500 s/mm2。人工勾划感兴趣区,以病变中心的实性部分测量病变组织。用系统软件测出以下参数:达峰时间(time to peak,Tmax)、最大增强斜率(maximum slope of increase,MSI)、信号增强率(signal enhancement rate,SER),时间-信号强度曲线(time-intensity curve,TIC)类型:缓慢上升型(Ⅰ型)、平台型(Ⅱ型)、速升速降型(Ⅲ型)。
1.2.2 评价标准 扫描完成后对图像进行处理,采用ADW 4.4工作站,由2位影像医师进行双盲阅片,意见不同时进行讨论,以最后意见为准。
1.2.3 血清Periostin、SDF-1水平测定 患者自入院当日,采取静脉血5 mL,置于真空管,以3 000 r/min离心15 min,分离后收集血清样本,置入-80 ℃冰箱冷冻保存备用。酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒(美国R&D公司)检测血清Periostin、SDF-1水平。所有操作遵照说明书步骤进行。
1.2.4 诊断标准 以手术病理结果为金标准,MRI以阅片结果为准,血清指标Periostin、SDF-1取截断值,MRI及血清中任一结果提示前列腺癌阳性即视为前列腺癌。
1.3 统计学方法
数据分析采用SPSS 25.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验;绘制受试者工作特征(receiver operating characteristic,ROC)曲线分析血清SDF-1、Periostin水平对前列腺癌的诊断效能;采用Kappa检验分析MRI单独及联合血清SDF-1、Periostin诊断前列腺癌与金标准病理结果的一致性,其中κ > 0.8表示一致性极高,> 0.4~0.8表示一致性较高,≤ 0.4表示一致性较差。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者MRI结果
前列腺癌组患者均为T1WI等信号。T2WI中,外周带并移行区48例,其中7例大片状低信号,29例斑片或结节状低信号,9例斑片或结节状稍低信号,3例等信号;移行区28例,其中8例片状低信号,2例边界不清,18例等低混杂信号。在DWI上,67例患者结节状或斑片状高信号,9例斑片状稍高信号。患者ADC图均表现为低信号。BPH组患者均为移行区,T2WI多为结节状高低混杂信号;在DWI为等或稍高信号。两组患者TIC曲线类型比较,差异有统计学意义(χ2=36.465,P=0.000)。见表1。
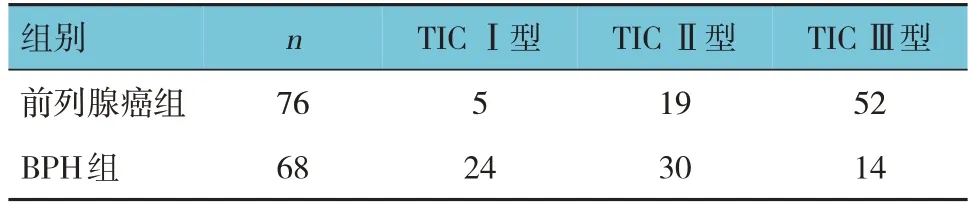
表1 两组患者TIC曲线类型比较 例
2.2 两组患者Tmax、MSI及SER水平比较
两组患者Tmax、MSI及SER水平比较,差异均有统计学意义(P<0.05),前列腺癌组Tmax低于BPH组,MSI及SER均高于BPH组。见表2。
表2 两组患者Tmax、MSI及SER水平比较 (±s)

表2 两组患者Tmax、MSI及SER水平比较 (±s)
组别前列腺癌组BPH组t 值P 值n 76 68 Tmax/min 3.12±1.13 5.28±1.92 8.329 0.000 MSI 221.22±51.68 176.72±35.79 5.939 0.000 SER 124.42±25.46 106.45±11.86 5.325 0.000
2.3 两组患者血清SDF-1、Periostin水平比较
两组患者SDF-1、Periostin水平比较,差异均有统计学意义(P<0.05),前列腺癌组高于BPH组。见表3。
表3 两组患者血清SDF-1、Periostin水平比较 (±s)

表3 两组患者血清SDF-1、Periostin水平比较 (±s)
组别前列腺癌组BPH组t 值P 值n 76 68 Periostin/(ng/mL)44.59±12.73 28.71±8.45 8.711 0.000 SDF-1/(pg/mL)6.34±1.87 4.42±1.42 6.876 0.000
2.4 血清SDF-1、Periostin水平诊断前列腺癌的ROC曲线分析
血清SDF-1水平诊断前列腺癌的最佳截断值为5.91 pg/mL,AUC为0.783(95% CI:0.731,0.873),敏感性、特异性分别为59.21%(95% CI:0.473,0.704)、91.18%(95% CI:0.818,0.967),血清Periostin水平诊断前列腺癌的最佳截断值为37.38 ng/mL,AUC为0.802(95% CI:0.692,0.844),敏感性、特异性分别为64.47%(95% CI:0.527,0.751)、86.76%(95% CI:0.764,0.938)。见图1。

图1 血清SDF-1、Periostin水平诊断前列腺癌的ROC曲线
2.5 MRI单独及联合血清SDF-1、Periostin对前列腺癌的诊断与金标准的一致性分析
MRI、SDF-1、Periostin水平与金标准的一致性比较,差异均有统计学意义(P<0.05),与手术病理金标准结果一致较好。MRI联合血清SDF-1、Periostin水平与金标准的一致性比较,差异有统计学意义(P<0.05),与手术病理金标准结果一致性好。见表4。

表4 MRI、血清SDF-1、Periostin单独及联合对前列腺癌的诊断与金标准的一致性分析
2.6 MRI、血清SDF-1、Periostin单独及联合对前列腺癌的诊断价值
MRI、血清SDF-1、Periostin水平联合诊断前列腺癌的准确性、敏感性和阴性预测值最高,分别为90.28%、94.73%(95% CI:0.856,0.984)和93.55%。SDF-1单独诊断前列腺癌的特异性最高,为91.18%(95% CI:0.818,0.967)。MRI、SDF-1单独诊断前列腺癌的阳性预测值最高,均为88.24%。见表5。
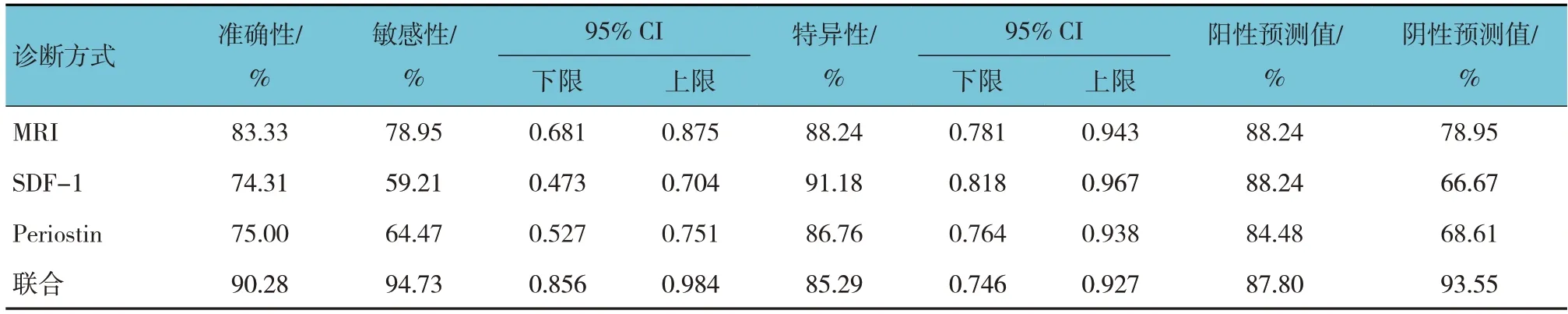
表5 MRI、血清SDF-1、Periostin单独及联合对前列腺癌的诊断价值参数
3 讨论
前列腺癌是男性生殖系统常见恶性肿瘤,发病率、病死率均较高,前列腺癌患者预后与诊疗是否准确及时有密切联系,因此前列腺癌的早期准确诊断十分重要[7]。MRI是前列腺癌首选诊断方式,可多功能、多参数成像,具有较强的软组织分辨能力[8]。但单独的MRI通常易受个人及成像技术等因素影响,因此需结合分子标志物进行诊断。
前列腺癌组织微血管密度较高,这种特征在前列腺高级别上皮内瘤变及前列腺增生等BPH中也存在,故临床进行诊断时,前列腺癌和BPH有一定重叠[9]。近年来,随着影像学检查技术的发展,MRI多参数成像在前列腺癌诊断方面的应用越来越多。T2WI软组织分辨率高,DWI可较敏感的感知细胞内外水分子弥散程度,但其空间分辨率不高,DCEMRI可揭示正常组织及肿瘤组织的药动学特征,进而鉴别肿瘤组织的良恶性[10-11]。前列腺动态增强用TIC表达,前列腺癌多为早期快速强化,TIC多为Ⅱ、Ⅲ型,BPH多为持续强化,TIC多为Ⅰ、Ⅱ型[12]。本研究结果中,前列腺癌组和BPH组TIC类型差异显著,但前列腺癌与BPH的TIC类型有重合,因此选用Tmax、MSI及SER作为量化指标,Tmax、MSI可以显示病灶强化的快慢,SER可以提示病灶的最终强化结果[13]。本研究结果显示,前列腺癌组Tmax低于BPH组,而MSI及SER均高于BPH组,提示与BPH患者相比,前列腺癌的强化程度、强化速度更高。MRI诊断前列腺癌的准确性为83.33%,其与金标准诊断一致性的Kappa值为0.668,与病理结果一致性较强,但敏感性不高,因此需要结合血清指标以提高鉴别诊断准确率。
有研究证实炎症过程参与前列腺癌的发生、发展,炎症促进癌变,通过DNA损伤促进肿瘤增殖和血管生成[14]。SDF-1是癌症相关的炎症因子,研究发现SDF1α/CXCR4通路在前列腺癌中的作用是多方面的,与恶性细胞向特定器官的扩散有关,且SDF-1在前列腺癌组织中高表达[6]。本研究结果中,前列腺癌患者血清SDF-1水平高于BPH患者,可以解释为充质干细胞(mesenchymal stem cell,MSC)数量的增加可以造成分泌的SDF-1水平的增加,此外,基质SDF-1不仅可以刺激PC-MSC,还可以通过MEK/ERK和PI3K/Akt等下游信号通路影响前列腺细胞,促进正常前列腺细胞向恶性前列腺细胞的转化[6,15]。为探究SDF-1用于诊断前列腺癌的价值,进行了ROC曲线分析,结果显示,SDF-1诊断前列腺癌的AUC为0.783,其与金标准诊断一致性的Kappa值为0.494,单独诊断准确性(74.31%)不高。GONZÁLEZ-GONZÁLEZ等[16]研究表明,Periostin在各种类型的癌症中过表达,其过表达通常与侵袭性临床特征和不良结局有关。在前列腺癌原发性肿瘤中的Periostin蛋白过表达通常代表了更差的基线临床特征,如较短的无病生存期和降低的总生存期[17]。在本研究结果中,前列腺癌患者血清Periostin水平高于BPH患者,提示Periostin与前列腺癌的发生有关,随后的ROC曲线分析结果显示,Periostin诊断前列腺癌的AUC为0.802,其与金标准诊断一致性的Kappa值为0.505,与病理结果一致性较高,但单独诊断的价值亦不高,因此血清学指标还需联合MRI共同诊断前列腺癌。
MRI结合血清学指标鉴别癌症及良性疾病的方法逐渐普及,如鉴别甲状腺癌与甲状腺良性结节,降低甲状腺的“过度诊断”[18];用于胃癌的良恶性鉴别[19]、结直肠癌的恶性分级诊断[20]等。刘晓东等[21]称MRI多参数成像联合血清PSA、CEA对前列腺癌的早期诊断价值较高。崔胜宏等[22]发现DCE-MRI联合血清sE-cadherin、AGR2诊断前列腺癌的AUC为0.867,在本研究结果中,MRI联合血清SDF-1、Periostin对前列腺癌诊断的准确性为90.28%,其Kappa值为0.804,与金标准一致性极高,提示MRI联合血清SDF-1、Periostin对前列腺癌的诊断价值较高。
综上所述,MRI联合血清SDF-1、Periostin在前列腺癌的准确诊断方面具有一定的临床应用价值,可用于前列腺癌的鉴别及避免过度诊断,为前列腺疾病的准确诊断提供参考。

