磁共振成像联合血清microRNA-221对前列腺癌的诊断价值*
许品,李锋,张双,纪大双,马烨
[湖北文理学院附属医院(襄阳市中心医院) 放射影像科,湖北 襄阳 441021]
前列腺癌是男性常见恶性肿瘤,发病早期无明显症状,随着病情进展可表现为尿频、尿急、尿痛或排尿困难等,部分患者表现为骨盆处或大腿根部疼痛,与前列腺增生、前列腺炎症状相似,临床诊断易被遗漏[1-2]。目前多数前列腺癌患者确诊时已处于晚期,错失了最佳手术时机。前列腺癌的临床筛查多采用前列腺特异性抗原及前列腺穿刺活检,前列腺炎、良性前列腺增生、前列腺癌均可造成前列腺特异性抗原异常升高。前列腺穿刺活检的病理诊断是临床诊断前列腺癌的金标准,但为有创检查,易引起感染及出血[3-4]。目前影像学检查仍是诊断前列腺癌的重要手段,多种磁共振成像(magnetic resonance imaging,MRI)技术联合使用可提高肿瘤恶性风险等级检测的准确度,其中扩散加权成像(diffusion-weighted imaging,DWI)、动态增强扫描(dynamic contrast enhanced,DCE)可全方位反映肿瘤血流动力学及新生血管生物学特性,明显提高前列腺癌检出率[5-6]。
近年来,随着对癌症发生、发展表观遗传学研究的不断深入,从基因领域探寻癌症发生的相关生物学标志物已成为现阶段热门研究。MicroRNA(miRNA)参与人体细胞增殖、分化、凋亡等基因调控过程,与肿瘤细胞生长、迁移、浸润紧密相关[7]。国内外研究均已证实microRNA-221(miR-221)参与前列腺癌、宫颈鳞状细胞癌等多种癌症的病理过程,且影响癌细胞增殖、凋亡、黏附、迁移等生物学行为[8-9]。然而,目前关于MRI结合血清miR-221检测在前列腺癌诊断中的价值尚缺乏报道。本研究特针对上述问题开展研究,以便寻找高效诊断前列腺癌的指标。
1 资料与方法
1.1 一般资料
回顾性分析2019年5月—2023年1月襄阳市中心医院收治的103例疑似前列腺癌患者的临床资料。本研究经医院医学伦理委员会批准,患者及家属均签署知情同意书。
1.2 纳入与排除标准
1.2.1 纳入标准 ①前列腺病变均为单发病灶;②未接受任何治疗;③伴有不同程度的排尿不畅、血尿等症状或总前列腺特异性抗原增高;④临床资料完整。
1.2.2 排除标准 ①有MRI禁忌证,医患沟通障碍;②影像学检查资料不全或图像伪影影响测定;③合并其他类型恶性肿瘤;④血液系统疾病;⑤重要脏器严重功能障碍;⑥自身免疫缺陷。
1.3 MRI检查
所有患者采用德国西门子公司MAGNETOM Verio 3.0T超导磁共振扫描仪行MRI检查。患者扫描前适度充盈患者膀胱,取仰卧位,扫描中心:耻骨及其上方2.0 cm;腹部相控阵线圈:接受线圈;体线圈:射频发射线圈,扫描序列包括AX-T1WI、AXT2WI、AXT2-SPAIR、SAG及COR-T2-SPAIR;DWI采用单次激发自旋回波平面成像,b值取1 500 s/mm2进行扫描,同时利用系统软件自动生成表现弥散系数(apparent diffusion coefficient,ADC)图;DCE使用轴位DIXON序列扫描,层厚4 mm,层数40层,连续进行30期扫描,对比剂使用钆喷酸葡胺注射液,剂量0.2 mL/kg,采用双筒高压注射器,扫描结束后经自带软件工作站处理得到病灶区时间-信号强度曲线,对病灶局部测量时采用同样大小的感兴趣区,拟合患者时间-信号曲线时参照Tofts双室药代动力学模型,测定速率常数Kep值、容积转运常数Ktrans值、细胞外间隙对比剂容积分数Ve值。
1.4 实时荧光定量聚合酶链反应检测血清miR-221的表达
治疗前取患者静脉血液3 mL,冷藏储存送外检测,离心收集血清,TRIzol法提取血清总RNA,采用RNAiso for Small RNA 试剂(大连宝生生物物工程有限公司)分离miRNA,逆转录成cDNA,进行实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR)(美国ABI 7500 Fast Real-Time PCR System PCR仪)。反应体系20 μL:cDNA 1 μL,正反向引物各0.5 μL,PCR缓冲液10 μL,蒸馏水8 μL。反应条件:95 ℃预变性5 min,93 ℃变性30 s,53 ℃退火30 s,60 ℃延伸30 s,共40个循环。内参选用U6,扩增结束后绘制熔解曲线,以CT值为基础,采用2-ΔΔCt法计算血清miR-221相对表达量,qRT-PCR引物序列见表1。

表1 qRT-PCR引物序列
1.5 病理检查
将前列腺穿刺病理结果作为标准,MRI检查后7 d内采用直肠超声引导下“12+x”针前列腺活检穿刺,对异常回声区域加穿1或2针,每个标本应标记具体的穿刺部位,参照《前列腺癌规范化标本取材及病理诊断共识(2021版)》[10],由2名经验丰富病理科医师进行病理诊断,意见不一致时协商至一致。
1.6 统计学方法
数据分析采用SPSS 18.0统计软件。计量资料以均数±标准差(±s)表示,比较用t检验;计数资料以构成比或率(%)表示,比较用χ2检验;绘制受试者工作特征(receiver operating characteristic,ROC)曲线。P<0.05为差异有统计学意义。
2 结果
2.1 穿刺活检病理诊断结果
穿刺活检病理诊断结果显示,103例前列腺癌疑似患者中,73例诊断为前列腺癌,18例前列腺增生,12例慢性前列腺炎。
2.2 前列腺癌及非前列腺癌患者MRI-DWI检查指标比较
前列腺癌与非前列腺癌患者的ADC值分别为(0.74±0.12)、(0.93±0.18)×10-3mm2/s,经t检验,差异有统计学意义(t=6.263,P=0.000),前列腺癌患者的ADC值低于非前列腺癌患者。
2.3 前列腺癌与非前列腺癌患者MRI-DCE指标比较
前列腺癌与非前列腺癌患者Ktrans比较,经t检验,差异有统计学意义(P<0.05),前列腺癌患者Ktrans高于非前列腺癌患者。前列腺癌与非前列腺癌患者Kep、Ve比较,经t检验,差异均无统计学意义(P>0.05)。见表2。
表2 前列腺癌与非前列腺癌患者MRI-DCE指标比较(±s)
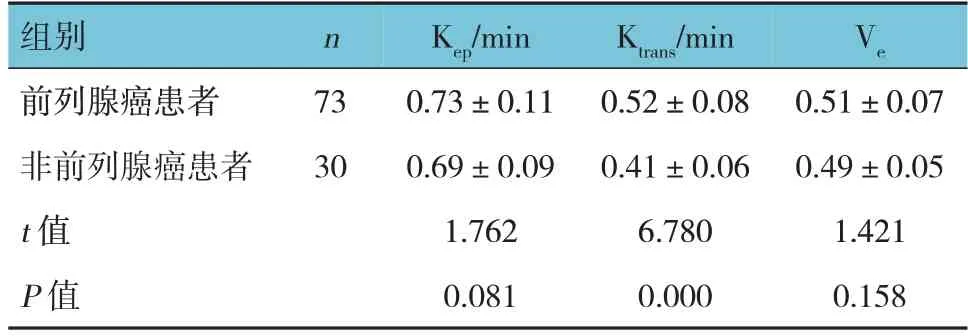
表2 前列腺癌与非前列腺癌患者MRI-DCE指标比较(±s)
组别前列腺癌患者非前列腺癌患者t 值P 值n Ve 73 30 Kep/min 0.73±0.11 0.69±0.09 1.762 0.081 Ktrans/min 0.52±0.08 0.41±0.06 6.780 0.000 0.51±0.07 0.49±0.05 1.421 0.158
2.4 前列腺癌与非前列腺癌患者血清miR-221相对表达量比较
前列腺癌与非前列腺癌患者miR-221相对表达量分别为(0.69±0.09)、(0.57±0.06),经t检验,差异有统计学意义(t=6.706,P=0.000),前列腺癌患者miR-221相对表达量高于非前列腺癌患者。
2.5 ADC、Ktrans、miR-221诊断前列腺癌的价值
ROC曲线分析结果显示,ADC、Ktrans、miR-221及3者联合诊断前列腺癌的敏感性分别为72.60%(95% CI:0.607,0.821)、69.86%(95% CI:0.578,0.798)、73.97%(95% CI:0.622,0.832)、82.19%(95% CI:0.711,0.898),特异性分别为80.00%(95% CI:0.609,0.916)、73.33%(95% CI:0.538,0.870)、70.00%(95% CI:0.504,0.846)、86.67%(95% CI:0.684,0.956),AUC分别为0.756(95% CI:0.651,0.860)、0.741(95% CI:0.633,0.848)、0.739(95% CI:0.631,0.846)、0.907(95% CI:0.842,0.972)。见表3和图1。
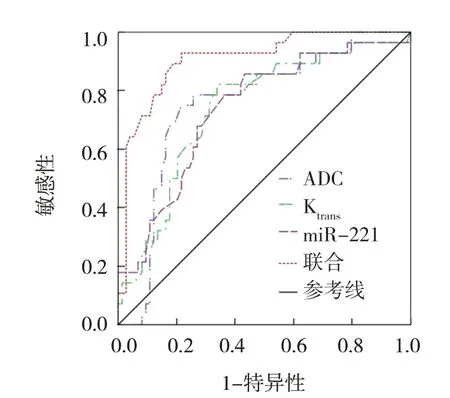
图1 ADC、Ktrans、miR-221诊断前列腺癌的ROC曲线
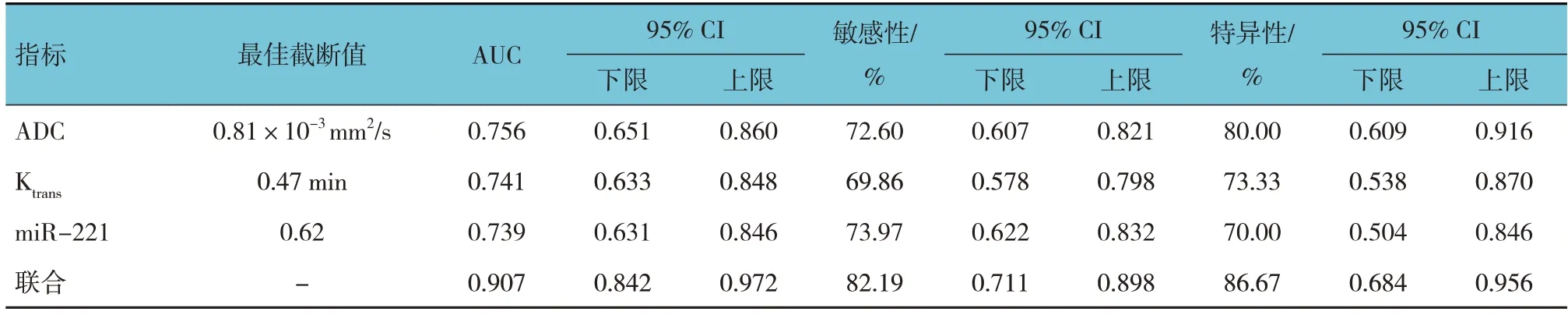
表3 ADC、Ktrans、miR-221对前列腺癌的诊断效能
3 讨论
前列腺癌发生与遗传、年龄、饮食、肥胖等多种复杂因素有关,是中老年男性常见病和多发病[11]。数据统计显示,全世界每年约140万前列腺癌新发病例,且40万患者死于该疾病,我国前列腺癌发病率位于男性恶性肿瘤第6位,病死率位于第7位[12-13]。尽早诊断前列腺癌后可通过根治性手术来改善预后,使患者获取更大生存收益。前列腺影像报告和数据系统(prostate imaging reporting and data system,PIRADS)自2012年推出就获得临床广泛认可,目前已更新至PI-RADS V2.1,其指出采用DWI、DCE等多参数MRI技术更有利于准确诊断前列腺癌。近年来,MRI技术已在前列腺癌诊断中广泛应用,相比其他影像学检查,其软组织分辨率更高,可以更加详细地观察前列腺组织内部结构和血流情况,其诊断敏感性和特异性得到进一步提高[14]。前列腺癌的发生涉及癌细胞浸润、入侵血管、增殖分化等一系列生理病理过程。miRNA是调节基因表达的表观遗传机制,miRNA表达变化可作为诊断恶性肿瘤的高效生物标志物。MRI结合血清miR-221检测是否可进一步提高前列腺癌的诊断准确度值得探讨。
本研究结果显示,前列腺癌患者ADC值低于非前列腺癌患者,前列腺癌患者Ktrans高于非前列腺癌患者,提示MRI-DWI、MRI-DCE检查指标在诊断前列腺癌方面具有一定应用价值。DWI是MRI功能成像技术之一,MRI-DWI是目前唯一能够呈现细胞膜完整性信息、活体组织中水分子扩散运动的无创性影像学检查技术,可以反映不同介质中水分子运动差异,可通过定量分析ADC值评估活体组织中水分子微观运动情况。前列腺癌等恶性肿瘤细胞生长、繁殖活跃,侵袭性强,肿瘤细胞生长增殖速度较快,致使恶性肿瘤细胞呈高密度,肿瘤细胞内部水分子运动受限,扩散作用不明显,使DWI采集信号强度改变,与正常组织或良性病变相比ADC值明显降低。DCEMRI是反映对比剂进入肿瘤及对比剂渗漏至细胞外,并提供组织灌注直接信息的影像学方法,是形态学与血流动力学相结合的技术,可通过定量分析血流动力学指标反映肿瘤血管生成、血管渗透性等生物学改变。Ktrans可反映人体毛细血管通透性、血管灌注量等血流动力学改变。生长繁殖快、侵袭性强的前列腺癌,其局部新生血管较多、新生血管也生长较快,内皮细胞间隙较周围正常血管内皮间隙变大,相对血管灌注量、血管渗透面积也较高,易造成血浆对比剂外渗,Ktrans值增大。与正常前列腺组织相比,良性前列腺病变区域血流灌注虽有一定增加,但对血管结构及内皮细胞间隙改变较小,因此Ktrans变化并不十分明显。李志平等[15]研究显示,初次前列腺活检前多参数MRI检查有较高的前列腺癌检出率。ZIAYEE等[16]研究指出,前列腺癌患者Ktrans值显著高于良性病变患者。
本研究结果显示,前列腺癌患者的miR-221相对表达量高于非前列腺癌患者,说明miR-221在前列腺癌患者中异常高表达。miRNA可通过碱基配对与靶基因结合,转录后可调节多个基因的表达,使靶基因降解或抑制靶基因翻译,miRNA能够通过识别目标mRNA的3'-非翻译区末端的非必要互补序列来与许多基因结合,控制基因表达并影响细胞代谢、增殖、DNA修复和细胞凋亡等过程。miR-221是位于染色体Xp11.3上的基因,其启动子区域包括位于pre-miR-221下游的3个poly-A序列,属于促癌分子。miR-221参与雄激素受体轴的控制和表型发展,以及前列腺癌细胞迁移、侵袭等生物学行为,并可抑制多种细胞周期蛋白依赖性激酶复合物合成,并被建议作为诊断前列腺癌的潜在生物学标志物。PENG等[17]研究指出,miR-221在前列腺腺癌组织中明显过表达。MARRA等[18]的体内研究显示,通过诱导miR-221下调可抑制肝细胞癌细胞生长、增殖。本研究ROC曲线分析结果表明,ADC、Ktrans、miR-221联合诊断前列腺癌效能良好。肿瘤在生物学上具有异质性,血液指标联合MRI影像学参数可提供更全面的肿瘤细胞结构、灌注等生物学信息,提升临床诊断前列腺癌的准确度。
综上所述,ADC、Ktrans、miR-221联合预诊断前列腺癌效能良好。但本研究仍存在一定局限性,仅纳入103例疑似前列腺癌患者,样本量小,统计效能有限,仍需增加样本量,进一步证实研究结果。

