Robo4在脑缺血再灌注损伤大鼠小胶质细胞极化中的作用及其机制研究*
曹天然,刘青芳,潘美民,陈勇
(长沙市第一医院 1.临床试验研究中心,2.神经医学中心,3.皮肤科,湖南 长沙 410005)
缺血性脑卒中(ischemic stroke,ICH)是临床多发病,具有发病率、病死率、致残率和复发率高等特点,给家庭和社会带来了沉重负担[1]。对于ICH的干预,目前国际研究金标准是溶解血栓以恢复血流[2],实现再灌注是治疗这类疾病的必要条件。然而,再灌注可能会进一步加重缺血性脑损伤,即脑缺血再灌注损伤(cerebral ischemia-reperfusion injury,CIRI)[3-4]。CIRI涉及多种病理、生理过程,包括氧化应激、炎症反应、神经元死亡和细胞凋亡等,在CIRI的发生、发展中起着关键作用[5-6]。目前的干预手段是针对CIRI进行多靶点干预,即对神经损伤的多个途径进行阻断。但该病尚缺乏有效的治疗药物,故研究CIRI的病因及寻找药物新靶点具有重要意义。
小胶质细胞是中枢神经系统中主要的固有免疫细胞,在维持中枢内环境的稳定、防止病原的入侵、调节神经系统病理生理过程中起着重要作用[7]。研究表明,脑部驻留的小胶质细胞在脑梗死后被募集到病变部位后再激活,激活后的小胶质细胞可以极化为“经典激活”的巨噬细胞M1和“交替激活”的巨噬细胞M2两种表型[8]。其中,巨噬细胞M1产生促炎细胞因子,例如CD16、CD32、CD86和诱导性一氧化氮合酶(inducible nitric oxide synthase,iNOS),被认为对脑梗死组织恢复有害。相比之下,巨噬细胞M2合成抗炎介质,包括白细胞介素-4(Interleutin-4,IL-4)、IL-10、IL-13和转化生长因子-β(transforming growth factor-β,TGF-β)被认为是有益的[9]。基于小胶质细胞的激活和极化在脑缺血再灌注恢复过程中的动态变化,调整M1/M2细胞比率可能有助于CIRI后脑炎症反应。因此,探索在急性缺血性半影区平衡小胶质细胞表型的新型免疫调节可能为预防或减少CIRI提供可行的策略。
环形交叉轴突导向受体同源物4(Robo4)蛋白环是一种跨膜受体,在调节血管内皮细胞功能和炎症中起着至关重要的作用[10]。但其是否在脑缺血再灌注小胶质细胞极化中发挥调控作用暂不清楚。因此本研究观察了Robo4在脑缺血后小胶质细胞极化过程中的作用,以期为CIRI的治疗探索新靶点。
1 材料与方法
1.1 实验动物与试剂
60只健康雄性成年Sprague-Dawley大鼠[实验动物生产许可证号:SCXK(京)2021-0006,实验动物使用许可证号:SYXK(京)2022-0052],体重250~280 g,购买于北京维通利华有限公司。动物实验通过医院医学伦理委员会科学研究项目审批[No:(2021)伦理(临研)第61号]。BCA试剂盒、十二烷基硫酸钠-聚丙烯酰胺(sodium dodecyl sulfate polyacrylamide gel electrophoresis,SDS-PAGE)凝胶和聚偏二氟乙烯膜购自美国Millipore公司。RIPA缓冲液和BCA蛋白测定试剂盒购自中国Beyotime公司。IL-1β和IL-10、TNF-α、TGF-β酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)试剂盒购自上海酶联生物生物科技有限公司。TRIzol试剂购自美国Invitroge公司。Prime ScriptTMRT试剂盒购自日本TaKaRa株式会社。Robo4、iNOS、CD86、Arg-1、CD206、Notch-1、Hes1和Hes5抗体购自美国Abcam公司。慢病毒载体及其阴性对照购自上海汉恒生物科技有限公司。
1.2 动物分组与模型复制
所有大鼠被随机分为假手术(Sham)组、大脑中动脉短暂性闭塞/再灌注(tMCAO/R)组、tMCAO/R联合过表达Robo4慢病毒阴性载体(tMCAO/R+Lvscramble)组、tMCAO/R联合过表达Robo4慢病毒载体(tMCAO/R + Lv-Robo4)组,每组15只。将5 μL Robo4过表达慢病毒载体(1×109TU/mL)或Robo4过表达慢病毒阴性载体(4×108TU/mL)于tMACO前7 d注入大鼠左侧脑室,24 h后取脑组织待测。
小心分离出大鼠左侧颈总动脉、颈外动脉(external carotid artery,ECA)和颈内动脉(internalcarotid artery,ICA)并将其完全暴露。在结扎ECA及其分支的远端后,将硅胶涂层尼龙单丝通过ECA插入ICA并轻轻推进到大脑中动脉。大脑中动脉短暂性闭塞(transient middle cerebral artery occlusion,tMCAO) 1.5 h后,恢复脑灌注(再灌注24 h)。在整个手术和闭塞期间,用加热灯将体温保持在(37.0±0.5)℃。Sham组大鼠除置入尼龙单丝外,其余操作同上。大鼠清醒后,如果出现站立不稳,左侧肢体瘫痪,提尾时向一侧转圈则说明tMCAO模型复制成功[8]。
1.3 神经功能检测
再灌注后24 h后根据Longa评分法评估神经功能缺损[11]。无神经功能缺陷计0分;右前爪不能完全伸展计1分;爬行时瘫痪侧转圈计2分;爬行时向瘫痪侧倾倒计3分;不能自发行走,意识水平低下或死亡计4分。得分为1~3分、无癫痫发作或脑出血的大鼠视为模型复制成功。共有Sham组(15只)、tMCAO/R组(13只)、tMCAO/R + Lv-scramble组(12只)、tMCAO/R + Lv-Robo4组(13只)纳入后续研究。同时,每组随机选取6只大鼠检测脑梗死面积,其余大鼠脑组织用于实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRTPCR)、Western blotting、ELISA检测。
1.4 2,3,5-三苯基氯化四氮唑法检测大鼠脑梗死面积
取出大鼠大脑,切除嗅球、小脑和脑干,并以2 mm的间隔进行冠状切片。然后将切片浸入1% 2,3,5-三苯基氯化四氮唑(TTC)溶液20 min,在4 ℃下用4%多聚甲醛固定24 h。脑组织未梗死部分呈红色,梗死部分呈白色。使用Image-Pro Plus 6.0软件计算脑切片的梗死面积和总面积。
1.5 qRT-PCR检测大鼠脑组织中Robo4 mRNA表达
使用TRIzol试剂提取总RNA。然后将各组大鼠RNA用PrimeScriptTM RT试剂盒逆转录成cDNA。qRT-PCR使用iQ SYBR Green Supermix试剂盒在Light Cycler热循环仪系统下进行。Robo4正向引物:5'-GGCCCCACCTCCTGCTGAAAAC-3',反向引物:5'-G GACGGCACCACTGGCAATGACT-3',均329 bp;GAPDH正向引物:5'-TGCACCACCAACTGCTTAGC-3',反向引物:5'-GGCATGGACTGTGGTCATGAG-3',均70 bp。反应条件:95 ℃预变性30 s,95 ℃变性3 s,60 ℃延伸20 s,共40个循环。根据2-ΔΔCt法计算基因相对表达量。
1.6 Western blotting检测大鼠脑组织中Robo4、iNOS、CD86、Arg-1、CD206、Notch-1、Hes1和Hes5蛋白表达
脑组织在RIPA缓冲液中裂解后,通过BCA蛋白测定试剂盒测定上清液中的总蛋白浓度。8% SDSPAGE电泳后转移到聚乙烯二氟胺膜上。在室温下于5%脱脂牛奶中封闭2 h后,将膜与一抗孵育过夜。用吐温-20羟甲基氨甲烷缓冲溶液洗涤3次后,将印迹与偶联辣根过氧化物酶的抗兔或抗大鼠免疫球蛋白G在室温下孵育1.5 h,条带曝光,最后凝胶成像系统分析图像并计算光密度值,以β-actin为内参。
1.7 ELISA检测脑组织炎症因子表达
将脑组织在磷酸盐缓冲盐溶液(pH 7.4)中研磨成匀浆。将匀浆液放置离心管中以3 000 r/min离心20 min,收集上清液。根据制造商的方案,使用ELISA试剂盒检测TNF-α、IL-1β、IL-10和TGF-β水平。
1.8 统计学方法
数据分析采用SPSS 22.0统计软件。计量资料以均值±标准差(±s)表示,比较用方差分析或H检验,进一步两两比较用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠Longa评分比较
Sham组、tMCAO/R组、tMCAO/R + Lv-scramble组、tMCAO/R + Lv-Robo4组大鼠Longa评分分别为(0.00±0.00)、(2.86±0.58)、(2.98±0.49)、(1.32±0.38)分,经H检验,差异有统计学意义(H=45.740,P=0.000),tMCAO/R组Longa评分较Sham组高。tMCAO/R + Lv-Robo4组较tMCAO/R + Lv-scramble组Longa评分低。
2.2 各组大鼠脑梗死面积比较
Sham组、tMCAO/R组、tMCAO/R + Lv-scramble组、tMCAO/R + Lv-Robo4组大鼠脑梗死面积分别为(0.00±0.00)%、(35.64±1.58)%、(37.18±1.35)%、(12.12±1.31)%,经H检验,差异有统计学意义(H=20.291,P=0.000),tMACO/R组较Sham组脑梗死面积大,tMCAO/R + Lv-Robo4组较tMCAO/R + Lvscramble组脑梗死面积小。见图1。
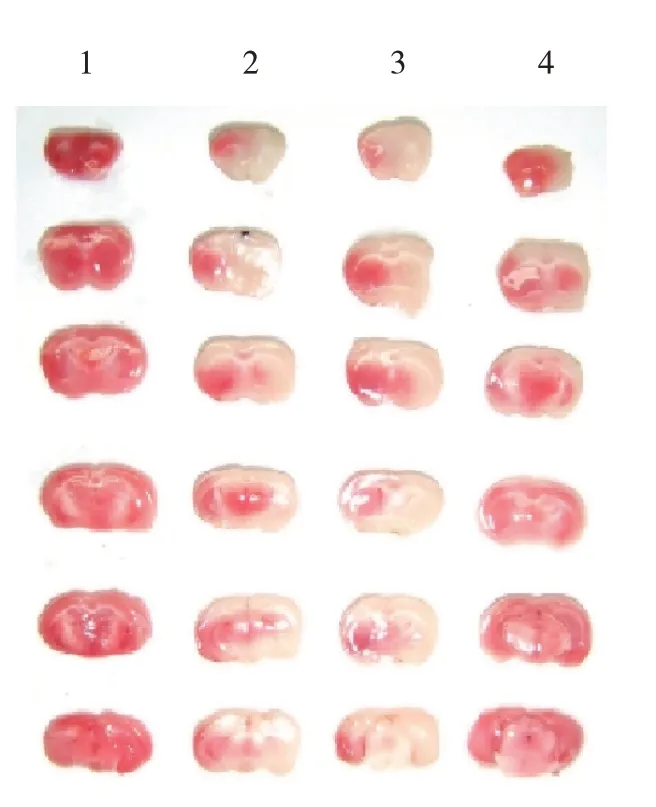
图1 各组大鼠脑组织横切面图 (TTC染色)
2.3 各组大鼠脑组织Robo4 mRNA和蛋白相对表达量比较
各组大鼠脑组织Robo4 mRNA和蛋白相对表达量比较,差异均有统计学意义(P<0.05),进一步两两比较,tMACO/R组大鼠脑组织Robo4 mRNA和蛋白相对表达量较Sham组低,tMCAO/R + Lv-Robo4组Robo4 mRNA和蛋白相对表达量较tMCAO/R + Lvscramble组高。见表1和图2。
表1 各组大鼠Robo4 mRNA和蛋白相对表达量比较 (±s)
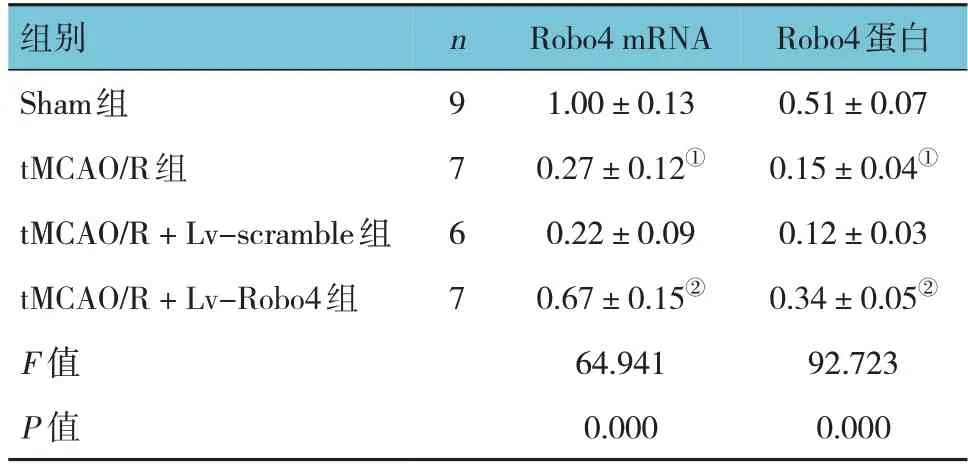
表1 各组大鼠Robo4 mRNA和蛋白相对表达量比较 (±s)
注:①与Sham组比较,P <0.05;②与tMCAO/R + Lv-scramble组比较,P <0.05。
n 9 7 6 7组别Sham组tMCAO/R组tMCAO/R + Lv-scramble组tMCAO/R + Lv-Robo4组F 值P 值Robo4 mRNA 1.00±0.13 0.27±0.12①0.22±0.09 0.67±0.15②64.941 0.000 Robo4蛋白0.51±0.07 0.15±0.04①0.12±0.03 0.34±0.05②92.723 0.000
图2 各组大鼠脑组织Robo4蛋白条带图
2.4 各组大鼠脑组织iNOS、CD86、Arg-1和CD206蛋白相对表达量比较
各组大鼠脑组织iNOS、CD86、Arg-1和CD206蛋白相对表达量比较,经方差分析,差异均有统计学意义(P<0.05),tMACO/R组大鼠脑组织iNOS、CD86、Arg-1和CD206蛋白相对表达量较Sham组高,tMCAO/R + Lv-Robo4组大鼠脑组织iNOS、CD86较tMCAO/R + Lv-scramble组低,Arg-1、CD206较tMCAO/R + Lv-scramble组高。见图3和表2。
表2 各组大鼠iNOS、CD86、Arg-1和CD206蛋白相对表达量比较 (±s)
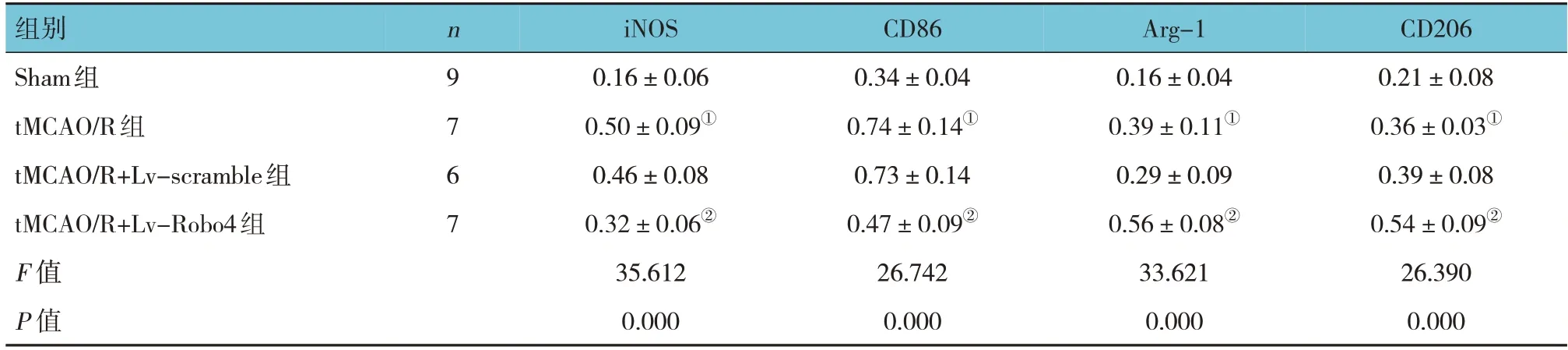
表2 各组大鼠iNOS、CD86、Arg-1和CD206蛋白相对表达量比较 (±s)
注:①与Sham组比较,P <0.05;②与tMCAO/R+Lv-scramble组比较,P <0.05。
组别Sham组tMCAO/R组tMCAO/R+Lv-scramble组tMCAO/R+Lv-Robo4组F 值P 值CD206 0.21±0.08 0.36±0.03①0.39±0.08 0.54±0.09②26.390 0.000 n9 7 6 7 iNOS 0.16±0.06 0.50±0.09①0.46±0.08 0.32±0.06②35.612 0.000 CD86 0.34±0.04 0.74±0.14①0.73±0.14 0.47±0.09②26.742 0.000 Arg-1 0.16±0.04 0.39±0.11①0.29±0.09 0.56±0.08②33.621 0.000
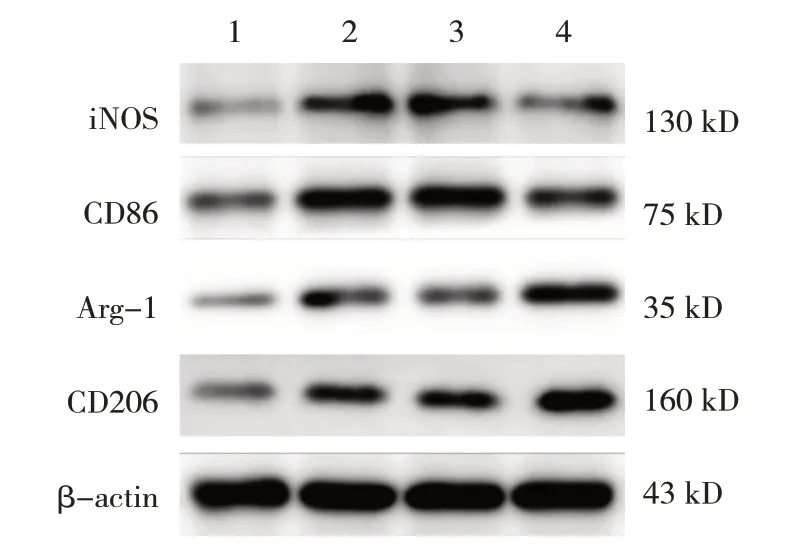
图3 各组大鼠iNOS、CD86、Arg-1和CD206蛋白条带图
2.5 各组大鼠脑组织Notch-1、Hes1和Hes5蛋白相对表达量比较
各组大鼠脑组织Notch-1、Hes1和Hes5相对表达量比较,差异均有统计学意义(P<0.05),tMACO/R组较Sham组高,tMCAO/R + Lv-Robo4组较tMCAO/R +Lv-scramble组低。见图4和表3。
表3 各组大鼠-1、Hes1和Hes5蛋白相对表达量比较 (±s)
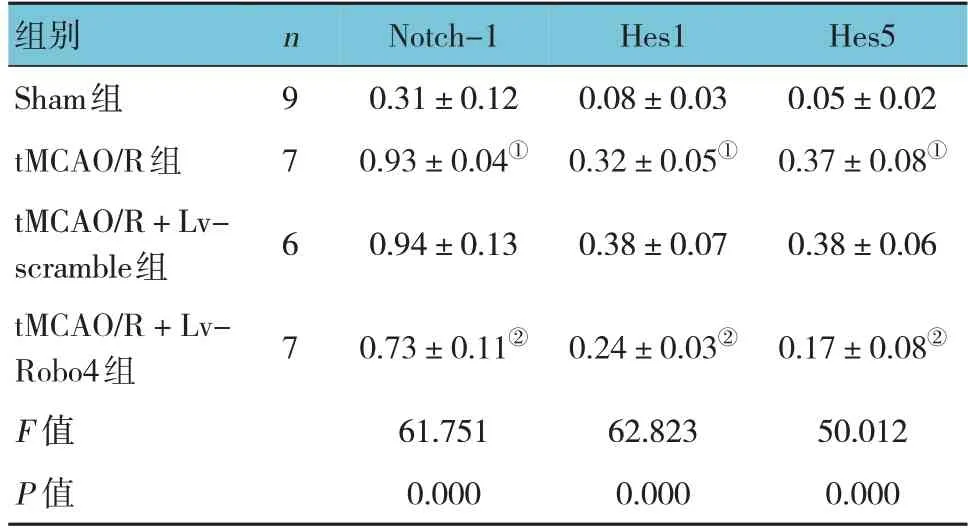
表3 各组大鼠-1、Hes1和Hes5蛋白相对表达量比较 (±s)
注:①与Sham组比较,P <0.05;②与tMCAO/R + Lv-scramble组比较,P <0.05。
Notch-1 0.31±0.12 0.93±0.04①0.94±0.13 Hes1 0.08±0.03 0.32±0.05①0.38±0.07 Hes5 0.05±0.02 0.37±0.08①0.38±0.06 n9 7 6 7组别Sham组tMCAO/R组tMCAO/R + Lvscramble组tMCAO/R + Lv-Robo4组F 值P 值0.17±0.08②50.012 0.000 0.73±0.11②61.751 0.000 0.24±0.03②62.823 0.000
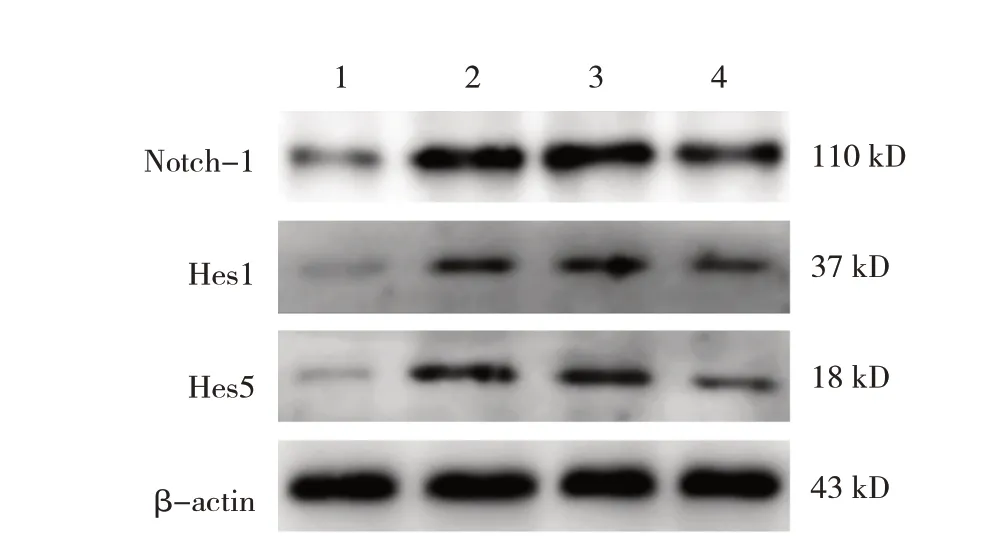
图4 各组大鼠Notch-1、Hes1和Hes5蛋白条带图
2.6 各组大鼠脑组织TNF-α、IL-1β、IL-10、TGFβ水平比较
各组大鼠脑组织TNF-α、IL-1β、IL-10、TGF-β水平比较,差异均有统计学意义(P<0.05),tMACO/R组较Sham组高,tMCAO/R + Lv-Robo4组大鼠脑组织中TNF-α、IL-1β水平较tMCAO/R + Lv-scramble组低,IL-10、TGF-β水平较tMCAO/R + Lv-scramble组高。见表4。
表4 各组大鼠TNF-α、IL-1β、IL-10、TGF-β相对表达量比较 (pg/mL,±s)
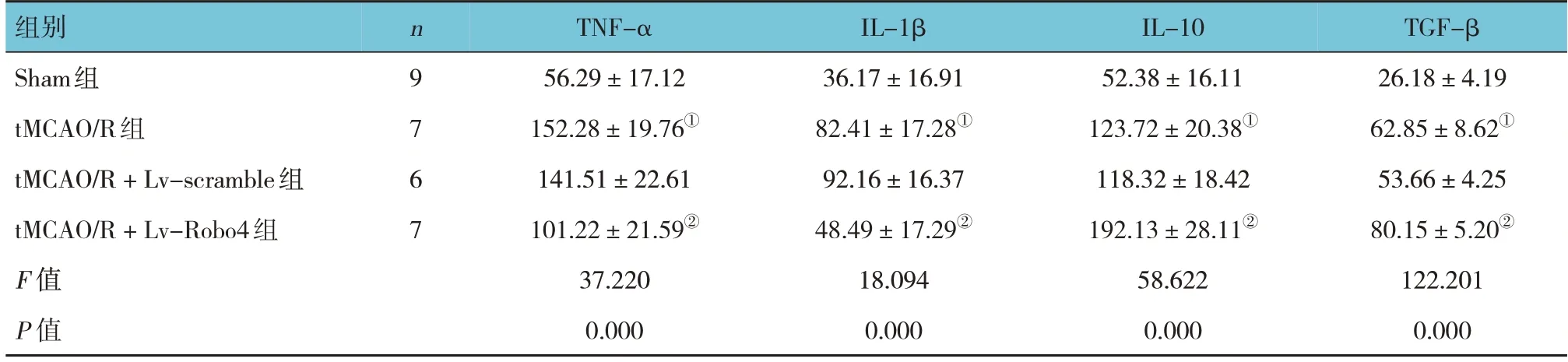
表4 各组大鼠TNF-α、IL-1β、IL-10、TGF-β相对表达量比较 (pg/mL,±s)
注:①与Sham组比较,P <0.05;②与tMCAO/R + Lv-scramble组比较,P <0.05。
组别Sham组tMCAO/R组tMCAO/R + Lv-scramble组tMCAO/R + Lv-Robo4组F 值P 值TGF-β 26.18±4.19 62.85±8.62①53.66±4.25 80.15±5.20②122.201 0.000 n9 7 6 7 TNF-α 56.29±17.12 152.28±19.76①141.51±22.61 101.22±21.59②37.220 0.000 IL-1β 36.17±16.91 82.41±17.28①92.16±16.37 48.49±17.29②18.094 0.000 IL-10 52.38±16.11 123.72±20.38①118.32±18.42 192.13±28.11②58.622 0.000
3 讨论
CIRI是一个复杂的病理、生理过程,涉及到自由基的过度积累、钙超载、兴奋氨基酸的毒性作用、炎症反应和细胞炎症因子的大量释放,以及细胞凋亡的加剧等[12]。目前,普遍认为炎症在CIRI中起着关键作用,其在脑缺血急性期会促进炎症级联反应,进而引起脑水肿出血,增加血脑屏障损伤,促进更多神经元死亡[13-14],而在脑缺血晚期,神经炎症通路对组织修复和功能恢复有益[15-16]。而小胶质细胞作为脑内的常驻免疫细胞被认为在炎症反应中发挥重要作用[17]。当接触到内源性信号(如神经元死亡)或外源性刺激信号(如感染)时,脑损伤组织的小胶质细胞会激活和迁移,且伴随有炎症因子水平升高的迹象[18]。激活的小胶质细胞有M1和M2两种极化表型:M1型促炎小胶质细胞的吞噬作用减少,促炎介质分泌增加,而M2型抗炎小胶质细胞能清除缺血组织,并显著抑制脑损伤[19]。与之一致,本研究结果中的tMACO/R组大鼠脑组织M1小胶质细胞标志物(iNOS和CD86)及M2小胶质细胞标志物(Arg-1和CD206)的蛋白相对表达量显著上升,说明小胶质细胞迁移至脑损伤组织并被激活。此外,tMACO/R组大鼠脑组织炎症因子TNF-α、IL-1β、IL-10、TGF-β水平升高。在各种脑损伤发展过程中,免疫系统被激活,免疫细胞产生细胞因子参与协调脑损伤免疫反应。细胞因子通常分为促炎症因子,如TNF-α和IL-1β,或抗炎症因子,如IL-10和TGF-β。急性脑损伤后引起细胞因子发生动态变化,这些变化部分依赖于激活的小胶质细胞和巨噬细胞,其释放促炎因子和抗炎因子,促进或解决脑损伤后的炎症反应[20]。因此,本课题组认为,在治疗脑缺血早期,通过改变小胶质细胞的极化状态,可能是一种有前景的脑缺血脑卒中的治疗策略,小胶质细胞也成为一个重要靶点。
Robo4蛋白环作为一种跨膜受体,在一些血管疾病进展及炎症反应中起着重要作用[21-22],参与多个生物学过程,如内皮细胞迁移、增殖和血管生成以及维持脉管系统稳态[23-26]。但其在缺血性中风病理过程中的作用知之甚少。有研究表明,激活Robo4-Paxillin信号转导途径,将会减弱外科脑损伤诱导的血脑屏障破坏,并改善大鼠结局[27]。而且Robo4作为炎症性疾病的潜在治疗靶点,被发现过表达Robo4可能抑制血管通透性改善败血症或传染病[28]。本研究结果发现在CIRI 24 h后Robo4表达减少,说明Robo4可能在CIRI中发挥了重要作用。通过外源性于脑室内注入过表达Robo4慢病毒载体后,大鼠神经功能障碍得到明显改善,脑梗死面积显著变小。此外,笔者还发现,过表达Robo4抑制了M1小胶质细胞标志物表达及IL-10、TGF-β的表达,却促进了M2小胶质细胞标志物表达及TNF-α、IL-1β的表达。这表明Robo4抑制M1表型极化小胶质细胞,促进M2表型以限制炎症反应。笔者推测,Robo4可能通过影响CIRI后小胶质细胞活化后表型的动态变化,进一步影响血脑屏障的完整性,从而对CIRI具有神经保护作用。在后续研究中,本课题组将会特异性过表达大鼠脑组织小胶质细胞Robo4,观察其对CIRI后血脑屏障破坏的作用,深入研究Robo4对CIRI神经保护作用的具体机制。
Notch信号通路是与炎症反应相关的信号通路,与多种炎症性疾病如类风湿关节炎、系统性红斑狼疮、心肌炎发生、发展密切相关。本研究结果发现Robo4可以抑制Notch信号通路的异常激活。据报道,Notch信号通路在CIRI后被激活,人脂氧素A4通过Notch信号通路发挥其抗炎作用[29]。且Notch信号通路抑制剂DAPT在模型建立前3 h对局灶性脑缺血/再灌注具有神经保护作用[30]。与其一致的是,笔者发现,与Sham组相比,tMACO/R组大鼠脑组织Notch-1、Hes1和Hes5蛋白表达水平显著升高,Notch信号通路在CIRI后被异常激活。
综上所述,Robo4可调控CIRI后小胶质细胞极化向M2表型转移,进而发挥小胶质细胞抗炎的神经保护作用,且可以调控Notch信号通路。

