酱油种曲四阶段培养法及其在圆盘制曲中的应用研究
◎ 闫景勇,刘建华,阮冲冲,李洁珠
(广东厨邦食品有限公司,广东 阳江 529500)
酱油原油的酿造过程可分为三大环节,即原料制曲、酱醪发酵及原油分离。原料制曲是酱油酿造工艺的关键环节,是米曲霉生长分泌各种酶的过程,是酱醪发酵过程原料分解、物质转化的基础。一般来说,米曲霉在制曲过程中经历孢子吸水发芽期、菌丝生长繁殖期和孢子着生期3 个阶段[1]。原料制曲首先要进行种曲培养,即通过上述3 个阶段培养68 ~72 h 以实现米曲霉菌种的扩大培养而获得成熟种曲;接下来是进行大曲培养,即将成熟种曲与小麦粉、蒸煮冷却后的黄豆混合培养40 ~44 h,低温制曲工艺中大曲培养初期6 ~8 h 是米曲霉孢子吸水发芽期,此阶段米曲霉尚未形成生长优势来抑制杂菌的侵入,温度过低或过高均会造成杂菌的污染繁殖[2],进而易产生花曲、酸曲等品质问题。
圆盘通风制曲机是一种自动化、精准化的酱油制曲设备,目前国内多数的大型酱油厂都在使用该设备[3]。在实际生产过程中,空气由单一入口进入下风室,在下风室形成明显的高速和低速区,造成气流组织不均匀[4]。由于高速区占比相对较小(约占1/8 盘面),故而圆盘制曲是以低速区的曲料温度进行温度控制,如此就会出现低速区曲料温度合适时高速区曲料温度偏低的问题,进而易出现高速区曲料培养前期米曲霉孢子发芽缓慢而易染杂菌造成圆盘局部大曲(6%~12%)酸曲/花曲的品质问题,从而影响产品质量。
本研究通过采用酱油种曲四段培养法,即在常规种曲培养三阶段后增加种曲预处理期使成熟种曲的孢子在种曲机内达到发芽的状态而获得制曲菌种;再将其接种至原料进行大曲培养,使大曲培养跳过孢子吸水发芽期、直接进入生长繁殖期,培养初期即形成竞争优势,抑制杂菌的污染繁殖,验证其对解决圆盘大曲局部酸曲/花曲品质问题的有效性。
1 材料与方法
1.1 菌种与原料
菌种:米曲霉3.042,由广东美味鲜调味食品有限公司提供。
原料:黄豆、面粉、麸皮,从市场采购,符合国家标准即可;头油,为广东厨邦食品有限公司广式高盐稀态酱油酿造工艺所产的第一道酱油原油。
1.2 仪器与设备
IKA RH 磁力搅拌器,广州绿百草科学仪器有限公司;25×16 血球计数板,上海求精生化试剂仪器有限公司;E100 显微镜,南京江南永新光学有限公司;LRH 生化培养箱与DHG-9140A 电热鼓风干燥箱,上海一恒科学仪器有限公司;T6 新锐可见分光光度计,北京普析通用仪器有限责任公司;种曲机,江苏华晖环保科技有限公司;连续蒸煮机与大型圆盘制曲机,北京键联机械设备有限公司。
1.3 试验方法
1.3.1 工艺流程
麸皮与水混合均匀后装入曲盘,厚度控制在1.0 ~1.5 cm,于种曲机内进行高温灭菌、冷却后,接入三角瓶菌种,开展酱油种曲四阶段培养:培养温度控制在30 ~34 ℃,先通过孢子吸水发芽期、菌丝生长繁殖期、孢子着生期三大阶段培养至72 h 以实现菌种的扩大培养而获得成熟种曲,再通过优化研究适宜条件继续开展第4 阶段(种曲预处理期)培养使成熟种曲的孢子达到发芽状态而获得制曲菌种。
黄豆经蒸煮冷却后,与面粉、制曲菌种充分混匀后进入圆盘制曲机内,厚度一般为40 ~50 cm,控制温度为32 ~38 ℃,培养6 ~8 h 后进行第一次松曲,控制温度为30 ~34 ℃,培养15 ~17 h 后进行第二次松曲,控制温度为26 ~30 ℃,培养32 ~34 h 后获得成熟大曲。如此不仅可有效解决圆盘局部大曲酸曲/花曲的品质问题,同时可在确保大曲质量的前提下缩短制曲时间,从而提升产品质量且大大降低圆盘制曲的能耗成本。具体的工艺流程见图1。
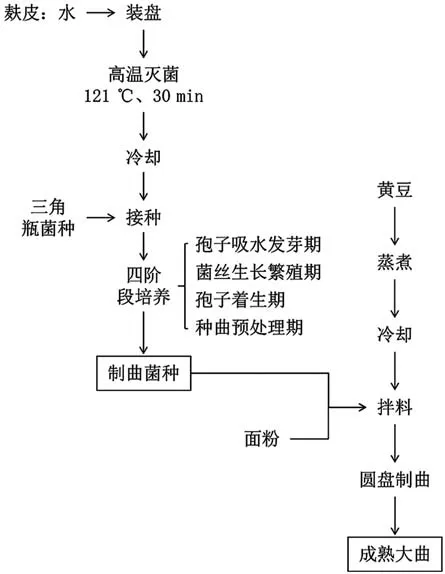
图1 酱油种曲四阶段培养法的制曲工艺流程图
1.3.2 不同加湿量对制曲菌种的影响
第4 阶段使用自来水分别按照100 mL·min-1、150 mL·min-1、200 mL·min-1、250 mL·min-1的加湿量进行加湿培养,培养8 h 后出种,以制曲菌种中孢子的发芽率为判定指标,确定合适的加湿量。
1.3.3 不同加湿水对制曲菌种的影响
第4 阶段分别使用含0%、5%、10%、15%(V/V)头油的加湿水以200 mL·min-1的加湿量进行加湿培养,培养8 h 后出种,以制曲菌种中孢子的发芽率为判定指标,确定适宜的加湿水。
1.3.4 不同通风方案对制曲菌种的影响
第4 阶段使用含10%(V/V)头油的加湿水以200 mL·min-1的加湿量进行加湿培养,并设计不同通风方案(见表1)进行通风培养,培养8 h 后出种,以制曲菌种中孢子的发芽率为判定指标,确定适宜的通风方案。

表1 酱油种曲四段培养法中种曲预处理期通风方案试验组别设计表
1.3.5 不同预处理时长对制曲菌种的影响
第4 阶段使用含10%(V/V)头油的加湿水以200 mL·min-1的加湿量,并采用1.3.4 中试验方案2 的通风方案进行加湿通风培养,分别培养至8 h、10 h、12 h、14 h 后出种,以制曲菌种中孢子的发芽率为判定指标,确定合适的四阶段培养时长。
1.3.6 制曲菌种减时制曲试验
以成熟大曲的中性蛋白酶活力、感官(重点是有无酸曲/花曲)为判定指标,以酸性蛋白酶活力为参考指标,将黄豆经蒸煮冷却后,与面粉、制曲菌种充分混匀后,分别于圆盘制曲机培养28 h、30 h、32 h、34 h、36 h 和38 h 取样检测大曲理化与微检指标,并观察记录其大曲感官状态。
1.3.7 各项指标测定方法
(1)制曲菌种孢子发芽率的测定。参照《孢子数测定法》(SB/T 10315—1999)[5]对制曲菌种进行样品处理、制片、镜检,镜检时选取计数板四周与中间各一个区域,分别记录已发芽孢子数目和未发芽孢子数目。制曲菌种孢子发芽率会影响到大曲培养相关试验结果的准确性,为确保试验质量,以制曲菌种孢子发芽率≥85%为目标[6]。制曲菌种孢子发芽率计算为
(2)大曲质量指标的测定。中性蛋白酶活力、酸性蛋白酶活力参照《蛋白酶活力测定》(SB/T 10317—1999)[7]。
2 结果与分析
2.1 不同加湿量对制曲菌种的影响
水是米曲霉孢子发芽必不可少的,不同加湿量对制曲菌种孢子发芽的影响见图2。由图2 可知,随着加湿量的增加,制曲菌种孢子发芽率呈上升趋势,当加湿量达到200 mL·min-1后其孢子发芽率上升不明显,这可能是米曲霉孢子吸水的速率在200 mL·min-1的加湿量下已达到最大水平,加湿量继续增加但水分并不能被孢子有效吸收。因而,综合考虑发芽率与加湿成本,选定四阶段培养的加湿量为200 mL·min-1。
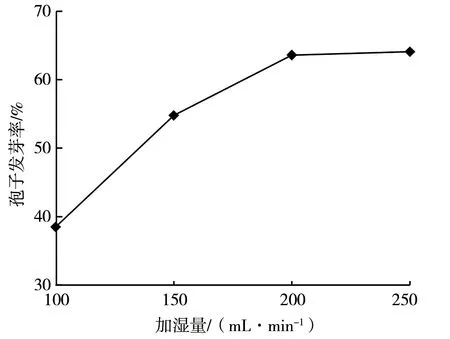
图2 加湿量对制曲菌种孢子发芽率的影响图
2.2 不同加湿水对制曲菌种的影响
酱油种曲经历前三阶段的培养形成大量孢子,此时原本培养基的营养物质基本消耗殆尽。在酱油种曲四阶段培养时,适当补充营养物质有利于米曲霉孢子的再次发芽。本试验通过在加湿水中混入一定比例的含有大量氨基酸、还原糖等可被直接利用的营养物质头油进行加湿培养,以促进孢子的发芽,其试验结果如图3 所示。
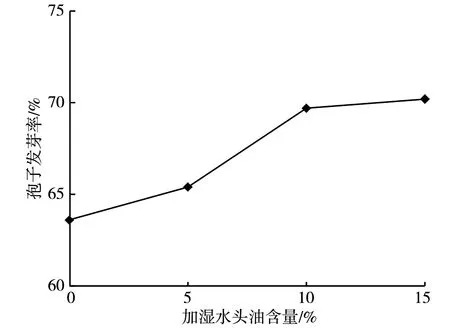
图3 加湿水中头油含量对制曲菌种孢子发芽率的影响图
由图3 可知,当加湿水中添加5 ~15%头油时,其对应的制曲菌种孢子发芽率均高于不添加的组别,说明适当补充营养物质确实可促进成熟种曲孢子的再次发芽。其中,添加量在10%与15%时促进效果基本一致,可使制曲菌种孢子发芽率达到约70%,明显高于添加量为5%的组别,比不添加的组别对应的孢子发芽率约高6.4%。因此,该试验选用含有10%头油的自来水作为加湿水。
2.3 不同通风方案对制曲菌种的影响
由图4 可知,通风方案从对照方案不通风到试验方案1 ~4 逐步增加通风时长,其对应的制曲菌种孢子发芽率整体呈上升趋势。从总体来看,采用试验方案2 ~4 时,制曲菌种孢子发芽率处于较高水平且发芽率水平基本一致,是促进孢子再次发芽较适宜的通风方案。随着时间的推移,孢子陆续开始发芽,对氧的需求会逐步增加且会逐步产生呼吸热,适时的通风有利于供氧散热、避免局部高温,使整体温度更加均一而有利于孢子的萌发;但前期孢子仅是吸水膨胀,故而对氧基本无需求,因此试验方案3、4 虽通风时间更长但其对应的制曲菌种孢子发芽率并未显著高于试验方案2。综上,确定通风方案采用试验方案2,即酱油种曲四阶段培养0 ~4 h 不通风、4 h 以后以4 ~6 m³·h-1进行持续通风的通风方案。
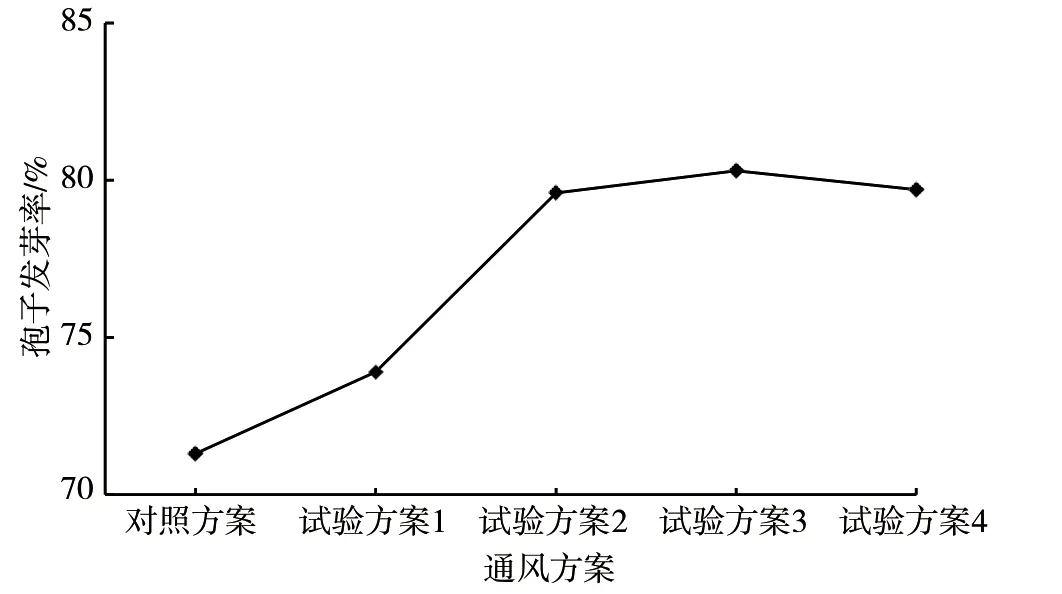
图4 不同通风方案对制曲菌种孢子发芽率的影响图
2.4 不同预处理时长对制曲菌种的影响
通过对加湿量、加湿水、通风方案的优化,在酱油种曲四阶段培养时间为8 h(低温制曲工艺中大曲培养孢子发芽的时间)时,最高的制曲菌种孢子发芽率约为80%,尚不能达到≥85%的理想状态。分析认为,本法直接采用在种曲机内继续加湿通风培养的方案使孢子发芽,其孢子需从种曲机内的气流中吸收水分、营养物质,相对于大曲培养时孢子与原料直接接触而直接汲取水分、营养物质的方式,其吸收的速率要低于后者,故而导致即使已创造较好的培养条件,但其孢子的发芽速度仍相对较慢的问题。基于上述分析,该试验通过以2 h 为一个梯度逐步增加四阶段的预处理时长,以验证不同预处理时间对制曲菌种的影响,试验结果如图5 所示。
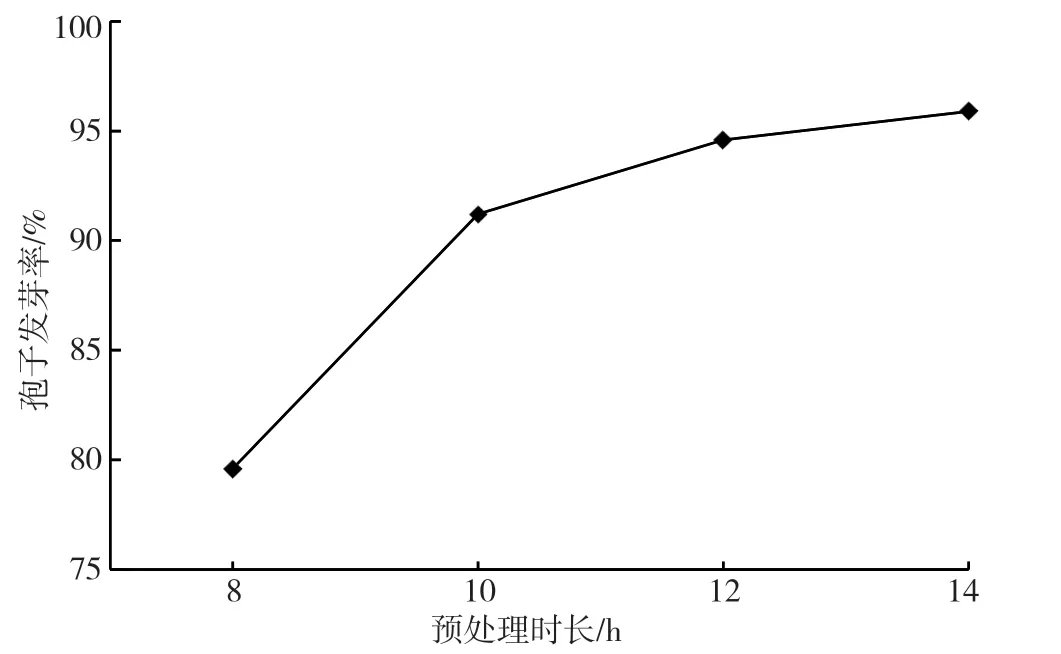
图5 不同预处理时长对制曲菌种孢子发芽率的影响图
由图5 可知,随着酱油种曲四阶段预处理时长的增加,培养所得的制曲菌种孢子发芽率逐渐升高。当预处理时长达到10 h 后,制曲菌种孢子发芽率均超过90%,完全达到≥85%的理想目标。综合考虑,实际生产有一定波动,建议酱油种曲四阶段的预处理时长控制在10 ~12 h 为宜。
2.5 制曲菌种减时制曲试验
试验采用上述孢子发芽率超过90%的制曲菌种进行大曲培养,跳过孢子吸水发芽期而直接进入生长繁殖期,培养初期即形成竞争优势,抑制杂菌的污染繁殖,有利于大曲品质的提升,具体试验结果详见表2。

表2 制曲菌种减时制曲试验结果汇总表
由表2 不同制曲时间大曲的质量指标与感官对比结果可知,采用本试验的制曲菌种进行圆盘大曲的培养,其培养所得大曲均无酸曲/花曲,可以有效解决圆盘局部大曲存在酸曲/花曲的品质问题。随着制曲时间的延长,其中性蛋白酶活力与酸性蛋白酶活力整体呈现上升趋势,中性蛋白酶活力在制曲时间为38 h时最高、酸性蛋白酶活力在制曲时间为36 h 时最高。在制曲时间为36 ~38 h 时蛋白酶活力最高,对应大曲整体呈黄绿色、孢子多,但就生产而言,孢子数过多可能影响工人操作,同时也不便于后期清洁[8];制曲时间为32 ~34 h 时中性蛋白酶活力均超过1 500 U·g-1、酸性蛋白酶活力均超过300 U·g-1,蛋白酶活力水平整体处于优良水平且大曲孢子适中/不多,不会影响工人操作与后期清洁。同时,相对于常规圆盘大曲培养周期40 ~44 h 可缩短8 ~10 h,从而提升了产品质量且大大降低了原料制曲的能耗成本,本试验酱油种曲四阶段培养法及其圆盘制曲的生产工艺具有常规圆盘大曲生产工艺不可比拟的品质与成本优势。因此,采用本试验的制曲菌种制曲的时间优选为32 ~34 h。
3 结论
通过采用本试验的酱油种曲四段培养法,即在常规种曲培养三阶段后增加种曲预处理期使成熟种曲的孢子在种曲机内达到发芽的状态而获得制曲菌种,再使用制曲菌种进行圆盘制曲,与现有圆盘制曲工艺对比,得到以下结论。
(1)采用本试验优化后的酱油种曲四阶段培养法,即在常规种曲培养三阶段结束(72 h)后,第4阶段使用10%(V/V)头油的加湿水以200 mL·min-1的加湿量,并采用0 ~4 h 不通风、4 h 后以4 ~6 m3·h-1持续通风的工艺进行加湿通风培养,培养10 ~12 h后出曲而获得制曲菌种,该方法可使制曲菌种孢子的发芽率超过90%,达到≥85%的理想目标。
(2)使用本试验的制曲菌种进行圆盘制曲,大曲培养过程可跳过孢子吸水发芽期而直接进入生长繁殖期,培养初期即形成竞争优势,有利于抑制杂菌的污染繁殖,其培养所得大曲均无酸曲/花曲,可有效解决现有圆盘制曲工艺中局部大曲存在酸曲/花曲的品质问题。
(3)使用本试验的制曲菌种进行圆盘制曲,可在确保大曲品质的前提下,使其制曲时间相对于常规圆盘制曲工艺缩短8 ~10 h,从而大大降低了原料制曲的能耗成本。

