单侧双通道内镜下腰椎椎间融合术治疗腰椎管狭窄症的疗效和影像学分析
王湘斌,王翀*,田征,艾克拜尔·尤努斯,李勇,隆宇斌
(1.新疆医科大学第一附属医院骨科,新疆 乌鲁木齐 830054;2.湖南省邵阳市中心医院脊柱外科,湖南 邵阳 422000)
腰椎管狭窄症(lumbar spinal stenosis,LSS)是由黄韧带肥厚、小关节增生、椎间盘突出及椎体滑脱等多种因素致椎管、神经根管和椎间孔等狭窄,并引起神经根或马尾神经受压的综合症,以神经源性间歇性跛行为表现特征,其中退行性LSS在老年人中最为常见[1-2]。症状性LSS需手术治疗患者占腰椎退行性疾病的8%~11%,传统手术方式包括椎板开窗减压、椎间盘切除和植骨融合内固定术[3-5]。传统开放腰椎管减压术具有减压充分、视野开阔等优点,但对椎旁肌和软组织的广泛剥离导致了术后腰痛、脊柱不稳定、术后恢复慢及住院时间长等一系列问题[6-7]。
水介质下的双通道内镜技术于2017年由Heo等[8]正式提出,并引用单侧双通道内镜(unilateral biportal endoscopy,UBE)的概念,该技术的应用为解决上述不足提供了新的诊疗思路。单侧双通道内镜下腰椎椎间融合术(unilateral biportal endoscopic lumbar interbody fusion,UBE-LIF)是基于该技术的一种新兴的微创融合手术,近年来被国内外学者广泛用于治疗腰椎退行性疾病,并取得良好的临床疗效[8-11],但目前国内就UBE-LIF术后的疗效和影像学结果报道较少。为此,笔者回顾性分析2021年3月至2022年3月在新疆医科大学第一附属医院骨科采用UBE-LIF治疗的LSS患者,目的在于分析UBE-LIF治疗LSS的疗效和影像学结果,并就UBE-LIF治疗LSS的优势、手术要点、注意事项、并发症及防治措施进行总结,现报告如下。
1 资料与方法
1.1 纳入与排除标准 纳入标准:(1)年龄45~75岁;(2)LSS诊断明确,伴或不伴节段性不稳定(屈伸位X线片示平移>3 mm和/或成角>15 °)或轻度腰椎滑脱(Meyerding分级Ⅰ度);(3)经3个月保守治疗后症状无明显改善或加重;(4)行单节段手术;(5)随访时间≥12个月。排除标准:(1)责任节段既往行手术;(2)手术节段≥2个;(3)合并其他脊柱疾病(脊柱骨折、脊柱感染或脊柱肿瘤等);(4)随访资料不完整或失访。
1.2 一般资料 本研究共纳入符合上述纳排标准的LSS患者63例,其中男24例,女39例;年龄45~75岁,平均年龄(61.17±7.88)岁;中央管狭窄8例,中央管狭窄伴侧隐窝狭窄9例,中央管狭窄伴椎间孔狭窄11例,中央管狭窄伴节段性不稳定16例,LSS伴退行型腰椎滑脱(Ⅰ度)11例,LSS伴峡部裂型腰椎滑脱(Ⅰ度)8例。本研究经新疆医科大学第一附属医院伦理委员会批准(210723-15)。
1.3 手术方法 采用气管插管全身麻醉。患者取俯卧位,C型臂X线机透视确定目标节段,标记椎弓根及上位棘突基底与椎板下缘交界移行处体表投影。常规消毒、铺单,铺单形成“U”型防水槽以便冲洗液顺利流出,并于术区贴护肤膜。术者站在患侧,若患者有双侧症状,以症状重侧为首选入路。于标识的体表投影线上下各约1 cm、入路侧椎弓根外侧缘各做一长约1 cm纵行切口。将逐级扩张器和椎板解剖器分别置入以剥离椎旁肌,并将其置于骨性结构表面,C型臂X线机透视确定位置良好。在内镜直视下用椎管外等离子射频刀头清理软组织并仔细止血,交替使用骨刀、咬骨钳及磨钻去除下关节突和部分上位椎板下缘至显露黄韧带起点,去除部分下位椎板上缘至显露黄韧带止点,用镜下摆据截除上关节突尖部,用咬骨钳咬除残留的骨质和上关节突内侧以打开神经根管入口及骨性侧隐窝,显露外侧黄韧带和椎弓根内缘,在行走根和出口根之间创造空间。若需双侧减压,则减压至对侧行走根外缘和椎弓根内缘。完成骨性减压后完整去除黄韧带,助手用“L”型拉钩将硬脊膜和神经根略牵向中线,切除椎间盘,充分处理椎间隙,并将镜头向前推进以查看终板制备情况。残留的髓核和软骨终板被完全去除至骨性终板略渗血。测量并将合适大小Cage模型插入椎间隙进行试模,以重新调整椎间隙高度,并确定需植入真实Cage的大小。将留取的局部自体骨咬成小块后植入椎间隙前部并压实,若植骨量不足,可取人工骨或同种异体骨。用拉钩保护硬脊膜和神经根后,内镜监视下置入装满自体骨的Cage,用榔头敲击以将Cage更深地插入椎间隙,透视确定其位置。撤出内镜和减压手术器械。在双侧分别置入2枚经皮椎弓根螺钉,完成钉棒固定。留置引流管并固定,缝合切口、无菌敷料包扎(见图1~6)。

图1 术中使用连级扩张器创造2个入口 图2 C型臂透视确定2个通道位置 图3 内镜下椎间盘、软骨终板被完全去除

图4 术中植骨照 图5 内镜下显示硬脊膜、同侧神经根及置入的Cage 图6 术后切口照
1.4 术后管理 术后24 h予静脉滴注抗生素预防感染,予非甾体抗炎药减少术后疼痛,营养神经、脱水消肿等对症治疗,术区引流量<30 mL/24 h时拔除引流管,术后1~3 d可佩戴腰围下床活动,患者出院前复查腰椎正侧位X线片和腰椎CT,评估植骨及椎体复位情况、Cage和钉棒系统位置,出院前复查腰椎MRI评估减压情况,腰围保护持续3个月。
1.5 观察指标 记录患者的手术时间、术中出血量、术后引流量、术后下地时间、术后住院时间和并发症情况。术前与术后不同时间点进行腰背部和腿部视觉模拟评分(visual analog scale,VAS)[12]、日本骨科协会(Japanese orthopaedic association,JOA)评分[13]、Oswestry功能障碍指数(Oswestry disability index,ODI)[14]及改良Macnab标准[15]评估临床疗效。术后1、3、6个月及末次随访时复查X线片,并采用Bridwell分级标准[16]评估椎间植骨融合情况,对于X线片不能明确者,进一步通过CT评估。

2 结 果
2.1 一般结果 手术节段:L2~37例、L3~411例、L4~527例、L5S118例;单侧减压38例,单侧入路双侧减压25例;手术时间100~195 min,平均(139.37±20.88) min;术中出血量85~190 mL,平均(124.52±21.58) mL;术后引流量15~65 mL,平均(35.48±10.34) mL;术后下地时间1~3 d,平均(1.70±0.59) d;术后住院时间3~6 d,平均(4.53±0.59) d;术后随访12~20个月,平均(15.20±2.23)个月。
2.2 症状功能情况 所有患者术后1 d腰痛、下肢痛和麻木得到缓解,术后1、3、6个月随访时腰痛、下肢痛和麻木以及神经源性间歇性跛行显著改善,末次随访时临床症状消失。术后1 d、1、3、6个月和末次随访的腰背部和腿部VAS评分低于术前,不同治疗时间的腰背部和腿部VAS评分比较,差异有统计学意义(P<0.05);术后1、3、6个月和末次随访的JOA评分高于术前,术后1、3、6个月和末次随访的ODI低于术前,不同治疗时间的JOA评分和ODI比较,差异有统计学意义(P<0.05,见表1)。末次随访时改良Macnab标准评价,优48例(76.19%),良8例(12.70%),可7例(11.11%),优良率为88.89%。

表1 手术前后腰背部和腿部VAS、JOA评分及ODI的比较
2.3 影像学检查结果 术后6个月随访,Bridwell分级Ⅰ级15例(23.81%),Ⅱ级20例(31.75%),Ⅲ级24例(38.10%),Ⅳ级4例(6.35%);末次随访时,Bridwell分级Ⅰ级58例(92.06%),Ⅱ级5例(7.94%)。
2.4 并发症情况 共发生8例(12.70%)并发症:硬膜外血肿2例(3.17%),短暂性臀部疼痛2例(3.17%),硬脊膜撕裂2例(3.17%),下肢短暂性感觉障碍及肌肉麻痹1例(1.59%),1例(1.59%)术后3个月复查X线片发现椎弓根螺钉松动、拔钉,这些患者均未行翻修手术,均经保守治疗后症状消失。所有患者均未出现钉棒断裂、Cage下沉、假关节形成、脑脊液漏和感染等。
2.5 典型病例 50岁女性患者,腰痛伴间歇性跛行10年,加重4个月入院,行走约300 m即感右小腿疼痛、麻木明显,休息后症状缓解。查体:L4~5棘突可扪及轻度“台阶样”改变,有压痛、叩击痛,右小腿前外侧及足背感觉减弱,右侧足母背伸肌肌力4级,双侧直腿抬高试验阴性,双侧巴氏征阴性。临床诊断为LSS伴节段性不稳定(L4~5),术前腰背部VAS评分5分,腿部VAS评分4分,JOA评分12分,ODI为65.67%。行UBE-LIF术后1 d腰背部VAS评分3分,腿部VAS评分3分。术后1个月腰背部VAS评分2分,腿部VAS评分1分,JOA评分21分,ODI为52.22%。术后3个月腰背部VAS评分1分,腿部VAS评分1分,JOA评分23分,ODI为54.30%。术后6个月腰背部VAS评分1分,腿部VAS评分0分,JOA评分25分,ODI为28.43%。末次随访的腰背部VAS评分0分,腿部VAS评分0分,JOA评分28分,ODI为10.55%。改良Macnab标准评价:优。手术前后影像学资料见图7~13。

图7 术前侧位X线片、CT和矢状位MRI示L4~5椎管狭窄伴节段性不稳定 图8 术前CT和横断面MRI示中央管狭窄

图9 术后X线片示内固定位置及椎体复位良好 图10 术后CT和矢状位MRI示椎间植骨充分、椎管狭窄改善 图11 术后CT和横断面MRI示椎管减压充分
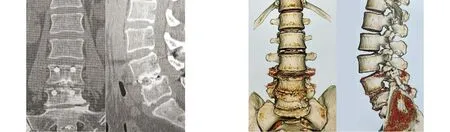
图12 术后6个月CT示Cage位置良好,椎间高密度骨性融合 图13 术后17个月CT三维重建示骨性融合
3 讨 论
3.1 UBE-LIF治疗LSS的优势、手术要点及注意事项 近年来,UBE技术逐渐兴起并用于治疗腰椎退行性疾病,包括腰椎管减压术和内镜下腰椎椎间融合术[8-11,17-19]。其通过2个小切口建立2个独立入口,分别作为观察和工作通道。观察通道插入内镜冲洗系统,用于监视并持续冲洗手术区域;工作通道插入各种手术器械进行操作。UBE下进行单节段腰椎管减压术和椎间融合术,在减压时只需采用2个1 cm左右的小切口即可进行操作,对于双侧减压者而言,也可通过行单侧椎板切除双侧减压术(unilateral laminotomy for bilateral decompression,ULBD)完成[20]。与传统开放融合手术相比,其创伤小,对肌肉、韧带及正常骨性结构破坏较小,术后患者疼痛减轻,且可减少因疼痛延长的住院时间[21-22]。
术中持续生理盐水冲洗使水介质下的内镜手术具有独特的优势[23-24],一方面,持续生理盐水冲洗所产生的水压可减少血管出血,防止出血导致的术野模糊;另一方面,大量生理盐水持续冲洗可清除大部分炎症因子并及时排出,有效降低椎间隙压力,从而显著减轻疼痛;此外,持续盐水冲洗有分离黏连的作用,这有助于因严重狭窄而紧密黏附在硬脊膜和神经根上的黄韧带自发分离,从而减少在摘除黄韧带过程中手术器械对硬脊膜和神经根损伤。术者也可根据术中需要调整内镜方向,进一步扩大手术视野,使内镜下视野清晰、解剖结构易于辨认,提高了操作安全性。在内镜监视下处理椎间隙,可最大范围去除椎间盘和软骨终板,使得终板制备更为完全,并减少手术器械对骨性终板损伤,可提高椎间植骨材料与椎体的接触面积,从而保证了术后的融合率,并减少植骨不融合或不完全融合、Cage下沉等并发症发生[25-26];在可视化下进行植骨和植入Cage,且可在行此操作时通过工作通道置入神经拉钩用来保护硬脊膜和神经根,使得植骨和植入Cage更为完全,同时也减少了Cage和手术器械对硬脊膜和神经根损伤[27]。另外,就与单通道内镜下融合手术比较而言,患者及手术人员所受到的辐射暴露次数减少[28]。该技术还可应用术者较为熟悉的常规脊柱手术器械进行减压,为因昂贵医疗器械而限制发展的基层医疗机构提供便利。
手术要点及注意事项:术中减压程度视具体需要决定,先减压骨性结构,再处理黄韧带;先截除下关节突及上位椎板下缘,再处理下位椎板上缘,然后处理上关节突内侧和尖部。术中先显露下关节突和关节突关节,经关节突关节入路,从下关节突尖部开始往上依次截取下关节突可以使解剖结构清晰分明、避免反复操作,从而提高截骨效率。去除下关节突和部分上位椎板下缘至显露黄韧带的起点。在去除黄韧带部分浅层后,处理部分下位椎板上缘至显露黄韧带的止点。在处理上位椎板下缘和下位椎板上缘时,建议使用高速磨钻将其磨至单层皮质骨后用咬骨钳咬除,此处减少使用骨刀和枪钳,可降低硬脊膜和神经损伤风险。处理上关节突内侧及尖部,在行走根和出口根之间创造足够的空间,便于后续植入Cage。处理上关节突尖部时,用探钩确定椎弓根内缘大概位置后,可以尝试用镜下摆锯或超声骨刀截骨,这样不仅效率高且截骨面整齐、松质骨渗血减少。此处应仔细止血,以保持清晰的手术视野,但对于此处的止血是较为困难的,这与腰动脉在此处的分支(绕过椎弓根峡部:关节间动脉;位于上下关节突之间:上、下关节动脉)是有关联的,骨蜡和明胶海绵可为术中止血提供帮助。对于伴有峡部裂型滑脱者,减压的主要目的是释放出口根,减压范围应更向外上,直至出口根完全显露并恢复正常形态和搏动。对于严重腰椎中央管狭窄、双侧侧隐窝狭窄或有双侧症状者,可行ULBD。对侧减压时,首先用骨刀或带有保护鞘的高速磨钻去除棘突根部的部分骨质以便于镜头跨过黄韧带中间缝隙实现“过顶”。在该技术开展初期,建议使用带保护鞘的高速磨钻进行操作,此处减少使用骨刀可降低硬脊膜和神经根损伤风险。保留黄韧带无疑更为安全,但为提供更多的手术视野和操作空间,避免初学者在操作过程中“迷路”,若只需行同侧减压,可在早期去除黄韧带。但若需对侧减压,保留同侧黄韧带,可降低对侧减压时手术器械造成硬脊膜及同侧神经根损伤风险。尤其对于严重椎管狭窄的病例,若先去除黄韧带,硬脊膜扩张明显造成“过顶”困难和损伤风险增加。腰椎管狭窄或椎体滑脱严重者,黄韧带常紧密黏附于硬脊膜和神经根上,术中应小心分离覆盖在硬脊膜和神经根上的黄韧带,以减少医源性硬脊膜撕裂,可使用咬骨钳或髓核钳轻轻牵拉黄韧带有助于自发分离或使用钩状探针仔细分离,生理盐水持续冲洗可使其进入硬脊膜和黄韧带之间的硬膜外间隙而使黏连溶解。
3.2 UBE-LIF治疗LSS的临床疗效 关于UBE-LIF治疗LSS的疗效,目前缺乏多中心、大样本、前瞻性研究。2017年,Heo等[8]采用UBE-LIF治疗69例腰椎退行性疾病,术后MRI显示获得最佳神经减压,VAS评分和ODI均明显改善,神经功能无加重恶化。2018年,Kim等[29]报告14例采用UBE-LIF治疗的患者,手术时间(169.00±10.00) min,估计失血量为(74.00±9.00) mL;VAS评分由术前7.40分降至术后2个月的2.70分。Park等[21]于2019年比较了UBE-LIF和后路腰椎椎间融合术(posterior lumbar interbody fusion,PLIF)治疗腰椎退行性疾病的术后1年随访疗效,结果发现UBE-LIF组手术时间较PLIF组长,但PLIF组输血病例(20%)明显多于UBE-LIF组(无病例);术后第1周内UBE-LIF组腰背部VAS评分较PLIF组明显改善,但患者术前和术后1年腰背部VAS评分差异无统计学意义(P>0.05),两组患者术后腿部VAS评分和ODI均显著改善。Kang等[30]于2021年比较了UBE-LIF和微创经椎间孔腰椎椎间融合术(minimally invasive surgery transforaminal lumbar interbody fusion,MIS-TLIF)在单节段或双节段LSS伴或不伴腰椎滑脱患者中的临床结果,结果发现术后1个月腰背部VAS评分和健康调查简表(the MOS item short from health survey,SF-36)评分在UBE-LIF组较MIS-TLIF组改善更为明显。然而,术后1年腰背部和腿部VAS评分、ODI和SF-36评分在两组间差异无统计学意义。虽然UBE-LIF组的总手术时间较MIS-TLIF组长,但MIS-TLIF组的估计失血量和手术引流量更多,故认为UBE-LIF较MIS-TLIF创伤更小、出血更少等。
2023年,笔者报告采用UBE-LIF治疗73例单节段LSS患者[31]。所有患者均顺利完成手术,术中无转为开放手术者。MRI显示UBE-LIF术后获得最佳神经减压,平均手术时间(150.89±15.58) min,平均估计失血量(126.03±17.85) mL,术后引流量(34.84±8.31) mL,术后下地时间(2.00±0.75) d,术后住院时间(5.96±1.38) d。术后腰背部和腿部疼痛VAS、JOA评分和ODI较术前显著改善,差异有统计学意义(P<0.05)。末次随访时,根据改良Macnab标准评价优良率为87.67%,共发生围手术期并发症9例,发生率为12.33%。术后6个月X线片或CT示37例(50.68%)出现节段性融合,30例(41.10%)出现不完全融合,6例(8.22%)无融合征象。而末次随访时,所有患者均获得骨性融合。笔者总结认为UBE-LIF治疗LSS具有手术侵袭性小、术后恢复快的优点。本研究63例患者均顺利完成手术,从研究结果看,UBE-LIF在术后下地时间及术后住院时间等方面优于文献[21]所报告的传统开放腰椎融合术,反映了该手术具有损伤少、术后恢复快等优点。其手术时间比传统开放手术长,这与陡峭的学习曲线有关,术者需要适应一段时间才能熟悉镜下解剖结构,术中需仔细止血以保持术野清晰,且技术开展早期,处理椎间隙花费时间较长[32]。随着术者对镜下解剖及运用手术器械越来越熟悉,手术时间随之减少。有学者研究报告该技术需要约34例病例才能达到适当的稳定水平[9]。
本研究患者术后均复查腰椎CT和MRI示神经减压充分,术后腰腿疼痛、麻木明显改善,术后不同治疗时间点的腰背部和腿部VAS、JOA评分及ODI均明显优于术前,并在随访期间持续改善。末次随访时改良Macnab标准评价优良率为88.89%。56例(88.89%)术后1个月恢复正常的日常生活,所有患者术后3个月均恢复正常工作。Park等[21]和Kim等[9]分别对61例和57例行UBE-LIF手术的病例进行分析,结果分别显示有58例(95.08%)和55例(96.49%)达到Bridwell Ⅰ级和Ⅱ级。本研究结果显示末次随访时,Bridwell分级Ⅰ级为92.06%,与上述文献报告的融合率几乎相同。许多研究已经提到UBE-LIF的一个优点是能在清晰的可视化下制备终板,安全和细致的终板准备提供了足够的融合床且提高了融合率[9,21,29,33]。然而,其他类型腰椎椎间融合术在制备终板和植入Cage过程中是盲目进行的,这可能会导致融合床准备不足。Bridwell分级Ⅱ级为7.94%,分析可能原因如下[27,33-34]:(1)这些病例术后随访时间较短,且伴有严重骨质疏松;(2)所植入的聚醚醚酮Cage表面光滑,生物活性低,影响骨传导;(3)长时间持续大量生理盐水冲洗对骨愈合有一定影响,但确切机制尚不清楚。
3.3 UBE-LIF治疗LSS的并发症及防治措施 随着该技术在临床上广泛应用,手术相关并发症也逐渐暴露,减压过程中所致硬脊膜撕裂是常见并发症,文献报道其发生率为13.20%,而本研究发生2例(3.17%)硬脊膜撕裂,发生率远低于该文献报道[35]。2例均发生在对侧减压、用咬骨钳去除覆盖在下位椎板上缘的黄韧带时,由于椎管严重狭窄致硬脊膜和黄韧带黏连严重,以及对膜椎韧带剥离不足,导致硬脊膜撕裂。因裂口较小,无神经疝出,术中予明胶海绵覆盖,严密缝合皮肤切口、局部加压包扎,术后未出现脑脊液漏。为避免发生硬脊膜撕裂和脑脊液漏,可通过以下措施进行防治[36-37]:(1)术中保持视野清晰,保持冲洗液顺利流出,术中仔细止血;(2)仔细辨识镜下解剖结构,分离黏附于硬脊膜和神经根上的黄韧带时,在生理盐水持续冲洗下,先用探钩或刮匙将其分离,再用枪钳或髓核钳轻轻牵拉有助于自发分离;(3)硬脊膜撕裂较小时,术中无需缝合,可通过严密缝合手术切口并局部放置纱布、棉垫加压包扎可防止脑脊液从切口漏出。2例(3.17%)术后引流量较少,在拔除引流管不久后出现腿痛,考虑为引流不通畅致硬膜外血肿形成,予脱水消肿药物治疗后症状消失。可采取以下措施预防硬膜外血肿[36-37]:(1)围手术期严格管控抗凝药物;(2)术中仔细止血,必要时可使用明胶海绵和骨蜡;(3)生理盐水灌注压控制在25~30 mm Hg,压力过低会造成水流缓慢、术野模糊,压力过高会掩盖出血灶而导致止血不充分。2例(3.17%)行双侧减压的患者,术后次日出现臀部轻度疼痛,而其术前并无臀部疼痛症状,考虑为对侧减压“过顶”时对马尾神经造成骚扰,经观察后疼痛消失。1例(1.59%)L3~4椎管狭窄伴节段性不稳定患者,术后出现双下肢短暂性感觉及运动障碍,究其原因为该患者具有严重狭窄、椎管容积较小,且技术开展早期,助手对神经根拉钩的使用不熟悉,在手术过程中对硬脊膜和神经根产生强烈的拉力所致。术后予脱水消肿、营养神经及肢体功能锻炼等,治疗1周后肌力部分恢复,术后1个月恢复正常。1例(1.59%)术后3个月复查X线片发现椎弓根螺钉松动、拔钉,考虑其原因为该患者年龄较大,伴有严重骨质疏松[38],术中因操作失误而二次调整钉棒位置致钉道松动,且该患者依从性差,过早去除腰围保护及腰椎负重过大,予以规律抗骨质疏松并适当延长腰围使用时间,后期随访未发现再次移位,所有患者均未出现钉棒断裂、Cage下沉和感染等。
3.4 研究的局限性 本研究尚存诸多不足,术后随访时间较短,缺乏与其他类型融合手术对照研究和多中心研究,后续应通过更多病例和多中心随访结果来进一步佐证。此外,在后续随访时应进一步验证其长期疗效和影像学结果,如对脊柱稳定性的长期影响等。
综上所述,UBE-LIF治疗LSS可在确保手术疗效的同时,减少手术相关损伤,加快术后恢复和提高安全性等。该技术是一种有效、安全的微创融合手术方式,可为LSS手术治疗的选择提供参考。

