聚乳酸/壳聚糖/氧化石墨烯载阿司匹林仿生支架的制备与表征
刘淑琼,吴芳芳,刘瑞来,许祯毅
(武夷学院生态与资源工程学院,福建省高校绿色化工技术重点实验室,福建 武夷山 354300)
骨组织工程在骨疾病和骨缺损的治疗中起着重要的作用。支架材料是影响骨修复和治疗完整性的关键因素。三维(3D)仿生支架的化学成分和物理结构对骨细胞的黏附、增殖、分化、调控和血管形成具有重要意义[1-2]。然而,单靠支架的化学性质或物理结构较难预测现有支架对细胞行为的调节和组织再生的生物学效应[3]。研究显示,支架与药物的有效结合可以促进骨修复,增强骨组织再生的能力[4-8]。因此,具有药物释放功能的新型仿生支架将成为组织工程中的研究热点。药物控释体系是指制备一定剂型的生物医用材料作为药物或生物活性物质的载体,并根据设计的剂量,使药物在规定的时间内以特定的速度缓慢释放到身体的特定部位,以治疗疾病、提高免疫力和促进组织修复[9]。目前药物控释体系的研究非常广泛,如胶束、纳米颗粒、纳米纤维和组织工程支架等。其中尤以纳米尺度的载药体系为研究热点[10-12],这与纳米材料的纳米效应息息相关[13-14]。纳米材料是一种结构单元尺度为1~100nm 的新型材料。但在药物释放领域,一般将纳米的尺寸界定在1~1000nm 之间[15]。细胞外基质中的纤维尺度是50~500nm,因此仿生载药支架既能满足细胞对支架结构和形态的要求,又能满足药物作为纳米载体的要求。
在组织工程中,静电纺丝、自组装、3D打印、相分离等技术已被用于制造仿生支架[16-18]。其中,静电纺丝和相分离应用最多。但是传统静电纺丝技术在制备具有大孔结构和类似于天然细胞外基质(ECM)复杂三维结构的支架上面临着巨大的挑战,而复杂的3D 多孔结构对于细胞行为调控和组织再生则至关重要[19]。相分离法操作方便,设备简单,可控制形成类似于天然ECM 的复杂结构,该方法被认为能够解决静电纺丝所带来的问题,已被有效地应用于纳米纤维支架的制备[20]。
聚乳酸(PLA)是一种无毒、无刺激性、高强度、可塑性强的生物高分子材料,具有良好的生物降解性和生物相容性,已在生物医学方面显示出应用潜力,如组织工程、缝合、植入和药物传递[21-22]。PLA 因其具有可调的降解速率、优良的加工性能、独特的药代动力学和药理功效等特点而被广泛研究。虽然前人的研究表明PLA 可以用于骨组织修复,但所得到的材料往往存在一些缺点,如细胞亲和力和亲水性均较差[23]。壳聚糖(CS)是一种从几丁质中提取的天然阳离子多糖,具有独特的生物相容性、生物降解性、无毒无刺激性和高pH 敏感性等优点,是一种具有巨大潜力的智能给药载体,已在生物医用领域具有广泛的应用[24-25]。氧化石墨烯(GO)是一种新颖的二维碳材料,因其独特的物理和化学特性而备受关注[11-12]。GO 具有较高的比表面积和丰富的亲水官能团(如羰基、羟基、羧基和环氧基团),具有较强的吸附性能和良好的亲水性[25]。GO 还因含有较多的官能团容易实现功能化和修饰,这大大促进了药物的吸附和缓释[10-12]。此外,GO 在药物载体、细胞成像、组织工程支架和可穿戴医疗设备等方面的生物医学应用也已经得到验证[10-11]。复合材料是解决支架材料性能缺陷的一种简单而有效的方法。Mao 等[10]报道了GO 可显著促进PLA/GO纳米纤维膜中RhB的释放。此外,纳米纤维结构对PLA/GO 纳米纤维膜的释药性能起着至关重要的作用。本文作者课题组[26]之前的研究也表明GO的加入可以提高PLA基体的亲水性。在另一项研究[11]中,研究人员采用双皮克林乳液法制备了GO@PLA@HA 载药复合微胶囊,但文中只提到了载药微胶囊的相关特性,并没有考虑将其用作骨支架的可行性。Rasoulzadehzali 等[24]制备了壳聚糖/氧化石墨烯-银复合水凝胶,结果显示,该复合水凝胶具有更持久和可控的药物释放能力。Joz Majidi 等[27]采用溶剂铸造法制备了PLA/GO 和PLA/GO/CS 复合支架,结果显示GO-CS 纳米复合材料的掺入不仅提高了PLA 的表面亲水性、杨氏模量和结晶度,而且大大提高了PLA 的生物相容性,但该支架不具备纳米仿生结构。Ji等[12]成功制备了新型多孔GO/CTS/HA 纳米复合膜,为骨髓间充质干细胞(mMSCs)的增殖提供了理想的支架。综上表明:PLA、CS和GO在载药及组织工程中均有良好的应用。然而,目前将这三种化合物复合并结合相分离制备仿生3D 多孔骨组织工程载药支架的研究还未见报道。
阿司匹林(ASA)是一种非甾体抗炎药,具有镇痛、解热、抗炎、抗风湿和抗血栓形成等作用[28-29]。近来有研究表明,它对骨修复和骨治疗也具有一定的作用,如可以抑制破骨细胞的分化成熟,显著促进啮齿动物骨修复[30]。Ren 等[28]报道:与纯钛种植体相比,载ASA 的移植体大大促进了MC3T3-E1 细胞向成骨细胞的增殖和分化。因此,本文采用相分离的方法制备了一系列新型3D 仿生PLA/CS/GO/ASA 载药复合支架,并研究了ASA 含量对支架形态、理化性质、细胞相容性、血液相容性和药物缓释性能的影响。
1 材料和方法
1.1 材料
聚乳酸 (PLA, 3052D,Mn=250000g/mol,Natureworks);壳聚糖(CS,BR,国药集团化学试剂有限公司);氧化石墨烯(GO)由实验室自制,具体制备过程可参见文献[26];其他试剂均来自国药集团化学试剂有限公司,全部为分析纯。
1.2 PLA/CS/GO/ASA载药仿生复合支架的制备
本文采用热致相分离法来制备PLA/CS/GO/ASA 复合纳米纤维载药仿生支架。以5%ASA 含量的载药支架的制备过程为例:首先,将0.15g CS、0.06g GO 和0.15g ASA 依次溶解到27g 1,4-二氧六环/水(90/10,质量比)的混合溶剂中,并超声分散30min,得到5%ASA 含量的均相溶液,往均相溶液中加入3g PLA,置于60℃恒温搅拌直至PLA完全溶解。取该混合溶液置于模具中,然后将模具放置于0℃ 3h 再放置于-40℃ 2h 进行凝胶相分离,待相分离结束,将支架放置于真空冷冻干燥机(0.940mbar,-56℃)干燥3d,收于干燥器中待用。其他不同ASA 含量的载药支架的制备同上,只需改变ASA的质量分数,即0、5.0%、10.0%、15.0%、30.0%和50.0%的ASA 含量分别为0.00、0.15g、0.30g、0.45g、0.90g和1.50g,所得载药支架依次命名为PSGA0、PSGA5、PSGA10、PSGA15、PSGA30和PSGA50。
1.3 PLA/CS/GO/ASA 载药仿生复合支架的表征
采用扫描电子显微镜(SEM,Vega 3 sbh,TESCAN)对PLA/CS/GO/ASA 载药仿生复合支架的结构形貌和支架对血小板的黏附情况进行分析。具体操作:将样品脆断(血小板黏附样品则直接观测样品表面),切取约1mm的薄片,将薄片断面朝上喷金110s(旋转喷金仪,SBC-12,30mA),测试条件:电压10kV,电流10mA。
采用Nicolet Avatar 360傅里叶变换红外光谱仪(FTIR,Nicolet IS5,Thermo fisher Ltd.)分析不同ASA 含量的PLA/CS/GO/ASA 载药仿生复合支架的基团特征,测试条件为:分辨率4cm-1,扫描次数为64次,扫描范围4000~400cm-1。
采用Philips X’pert MPD X 射线衍射仪(XRD,D8 Advance,布鲁克有限公司)分析含有不同ASA含量的复合支架的晶体结构。测试条件为:Cu Kα,管压40kV,管流40mA,步长0.02°,扫描速率4°/min,扫描范围5°~60°。
1.4 孔隙率和接触角
孔隙率是根据比重瓶法进行测定的,具体的操作步骤可参考文献[31]。采用接触角测定仪(JYPHa,承德金和有限公司)评价支架的亲水性能。具体操作是将5μL去离子水滴到支架表面,由仪器自动捕捉水滴形态,并测定相应的接触角大小。每个样品平行测定3次,计算标准差。
1.5 纤维直径的测量
利用纳米测量软件对复合支架的纳米纤维直径大小进行统计测量。每个样品随机测量50 条纤维直径并取平均值,计算标准差。
1.6 细胞培养
用小鼠成骨前细胞系MC3T3-E1 评价PLA/CS/GO/ASA 载药仿生复合支架的细胞相容性。将MC3T3-E1(中国科学院细胞库)培养在含有88%a-MEM 培养基(a-MEM,L570KJ,上海源培生物科技有限公司)、10%胎牛血清(FBS,C0230,BOVOGEN,南美)、1% l -谷氨酰胺(Gln,北京索莱宝生物科技有限公司)和1%青霉素-链霉素(碧云天生物科技有限公司)的传统培养基上。然后将细胞置于37℃、5% CO2的恒温培养箱中培养,每3 天更新一次培养基。取对数期细胞,加入0.25%胰蛋白酶EDTA 溶液(25200-056,Gibco,美国)进行细胞增殖研究。
1.7 细胞增殖
将支架样品切成小片(10mm2×2mm),放入24孔板并进行紫外线(UV)灭菌24h。收集对数期的MC3T3-E1细胞,进行细胞计数,调整细胞悬液浓度,铺板使待测细胞为1×104个/孔,然后在5%CO2、37℃条件下,支架材料和细胞孵育24h、72h和120h。到达预定时间点,吸走原有培养基,PBS洗细胞2 次,加500μL 含10% CCK8 的培养基,继续培养2h,然后将液体吸入96 孔板中,用酶标仪(EPOCH2,Biotek,USA)在450nm 处检测光密度(OD 值)。所得值与每孔中黏附的细胞数成正比,每个样品平行测试3次,计算标准差。
1.8 载药仿生复合支架的血液相容性
采用溶血率和血小板黏附评价PLA/CS/GO/ASA 载药仿生复合支架的血液相容性。根据ISO 10993-4∶177,从健康志愿者中采集静脉血,加入柠檬酸三钠(9%)作为抗凝剂,形成新鲜抗凝人血[32]。
溶血率是通过测量暴露在实验材料下的全血中红细胞释放到溶液中的血红蛋白的相对数量来评估的[33]。用10mL 0.9%的NaCl溶液将8mL新鲜抗凝人血稀释成稀释血。将待测支架样品(1cm2×0.1cm)置于试管中,加入0.9%的氯化钠溶液10mL,在37℃恒温30min,再加入稀释血0.2mL,混匀后继续恒温60min。阳性对照用去离子水10mL 加入稀释血0.2mL,阴性对照用10mL 0.9%的氯化钠溶液加入稀释血0.2mL,以2000r/min 的离心速度离心10min。取上层清液移入比色皿,利用紫外分光光度计测定波长540nm 处的吸光度,按式(1)计算溶血率[34]。
式中,HR表示溶血率;Xts表示支架的吸光度;Xnc和Xpc分别表示阴性和阳性对照的吸光度值。
将1cm2×0.05cm 大小的支架样品分别放入盛有一定量生理盐水的烧杯中,在37℃中恒温浸泡2h。将新鲜抗凝人血离心20min,离心速度为3000r/min,获得血小板血浆。将0.2mL血小板血浆滴到浸泡过生理盐水的支架样品上,于37℃恒温水浴中一起振荡培养2h。然后用生理盐水将培养后的样品轻漂3次,用2.5%戊二醛固定液在4℃固定1h,再用PBS 溶液冲洗2 次,每次10min,最后依次在50%、60%、80%、90%、100%乙醇-水梯度溶液中浸泡30min,逐级脱水,叔丁醇置换,并在4℃冰箱放置24h,然后真空干燥,最后用扫描电镜观察血小板黏附情况,每个样品平行测定3个,计算标准差。
1.9 ASA的体外释放
配制浓度为0.25~400μg/mL 的ASA 标准溶液,并用紫外-可见分光光度计(UV-1100,上海美普达仪器有限公司)测定ASA 在270nm 处的吸光度,进行标准曲线的绘制,所得曲线的R2=0.9998。支架的体外释放过程如下,将约30mg 支架样品浸入25mL PBS (pH=7.35) 溶液中,持续恒温振荡(100r/min,37℃)。在预定的时间点取出3mL 缓释溶液并测定270nm处的吸光度,同时补充3mL新鲜PBS溶液。利用所测的吸光度对照标准曲线,计算累计释放的ASA质量分数。计算公式如式(2)。
式中,mn是支架PLA/CS/GO/ASA 在t时间点累计释放的ASA 总量;M是支架中ASA 的理论负载量。
1.10 统计分析
本文中所有的体外实验均重复进行,数据以所得值的平均值±标准差(SD)表示。使用Graphpad Prism 软件(7.0)进行统计分析。两组间的P值采用Student-t检验进行分析,P<0.05 被认为具有统计学意义。
2 结果与讨论
2.1 SEM分析
仿生细胞外基质(ECM)结构的纳米纤维支架已被证明对细胞的黏附、增殖、分化及迁移等功能具有良好作用[1-2,35],同时纳米材料在药物缓释系统中也有良好的应用[15]。图1显示了相分离方法制备的不同ASA 质量分数(0、5%、10%、15%、30%和50%)的PLA/CS/GO/ASA 复合支架的形貌变化。图1(a)显示PSGA0复合支架主要由生长不完全的重叠球晶构成,球晶由微、纳米纤维聚集而成。随着ASA的添加,复合支架的基体结构逐渐改变,原本不完善的球晶结构进一步转变为疏松的纳米纤维束,纤维聚集程度降低,孔隙数量增加。但随着ASA含量的增加,纤维直径没有太大的变化,平均直径分别为(262.4±91.0)nm、(216.6±99.9)nm、(194.0±69.9)nm、(330.8±115.7)nm、(233.6±107.3)nm、(282.2±196.3)nm。因此,不同ASA含量的PLA/CS/GO/ASA 复合支架均具有纳米纤维的仿生结构。另外,从图上还可以看出,在支架的基体结构上除了纤维结构之外还有一些额外的二维(2D)薄片结构,这与本文作者课题组之前报道的PLA/GO 复合支架表现出的形态结构一致,应该都是GO析出所致[26]。从总体上来看,当ASA 质量分数大于30%时,PLA的球晶结构完全被破坏,这可能是因为大量ASA 的添加对PLA 球晶的生长起到阻碍作用。但实验范围内,ASA的添加不影响复合支架的仿生纳米纤维结构的形成。

图1 不同ASA含量的PLA/CS/GO/ASA载药仿生复合支架的电镜图
2.2 XRD分析
图2 为PLA/CS/GO/ASA 载药仿生复合支架的XRD 图谱。在所有复合支架试样中均可观察到PLA在17°和19°的特征衍射峰[26]。随着ASA含量的增加,PLA的特征衍射峰位没有明显变化,说明复合体系中PLA 的晶体形貌没有受到ASA 的影响。同时,随着ASA 含量的增加,复合支架中ASA 的特征衍射峰逐渐出现并增强。这些结果表明相分离方法可以有效地将不同含量的ASA加载到PLA/CS/GO 复合支架上,并且对支架的化学性质和仿生微纳米纤维结构的影响较小,这对支架的仿生具有重要作用。

图2 不同ASA含量的PLA/CS/GO/ASA载药仿生复合支架的XRD图
2.3 FTIR分析
图3是不同ASA含量的PLA/CS/GO/ASA载药仿生复合支架和纯ASA 的FTIR 光谱。如图3 所示,所有的复合支架在1753cm-1、1454cm-1、1359cm-1、1181cm-1和1054cm-1处均出现PLA 相关的特征吸收峰,且随ASA 含量的增加,其特征吸收峰(1677cm-1、1603cm-1、910cm-1处)对应的峰和强度都有所增强,这些特征吸收峰都归属于ASA 的环状缔合物[31]。FTIR 结果证实了ASA 在复合材料中的存在,同时也表明PLA/CS/GO复合支架与ASA之间没有化学相互作用,这可能不利于复合支架的药物缓释。
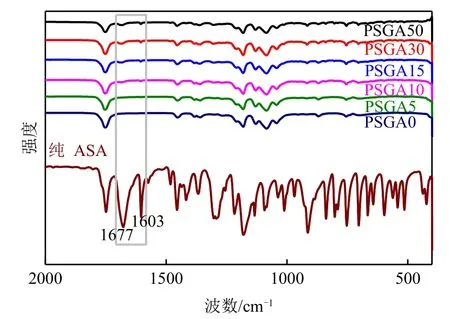
图3 不同ASA含量的PLA/CS/GO/ASA载药仿生复合支架的红外光谱图
2.4 孔隙率分析
图4显示了不同ASA含量下PLA/CS/GO/ASA载药仿生复合支架的孔隙率。高孔隙率是复合材料作为骨组织工程支架材料的必备条件。通过孔隙可促进营养物质的运输及废弃物的排泄,有利于骨组织的再生,促进新骨的生长。研究表明,80%以上的孔隙率可以满足组织工程对孔隙率的要求[2]。从图4 可以看出,复合支架的孔隙率从未添加ASA 的86.20%±0.39%下降到添加15% ASA 时的80.54%±1.24%。而当ASA 质量分数增加到30%以上时,孔隙率又呈上升趋势,达到86.06%±0.66%。这可能与ASA 和PLA 基体相容性差有关。当混合体系发生相分离时,ASA析出形成ASA单相,填充PLA基体结构中的孔隙,导致孔隙率降低。而当ASA质量分数增加到30%时孔隙率又增加,这可能是因为大量ASA 的添加破坏了PLA 球晶的生长,从而形成高孔隙率的多孔结构,这一结论与电镜图的结果相互印证。
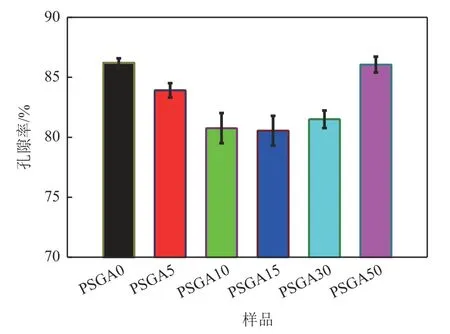
图4 不同ASA含量的PLA/CS/GO/ASA载药仿生复合支架的孔隙率
2.5 接触角分析
图5为PLA/CS/GO/ASA载药仿生复合支架的接触角。通过分析复合材料的接触角可以评估材料的亲水性。亲水性的提高不仅有利于细胞的黏附、增殖和生长[1],而且有利于药物从载药支架中释放。如图5 所示,随着ASA 的加入,接触角呈下降趋势,说明ASA 的加入有利于提高支架的亲水性,但作用不是太明显,这可能跟ASA 本身微溶于水的特性有关。
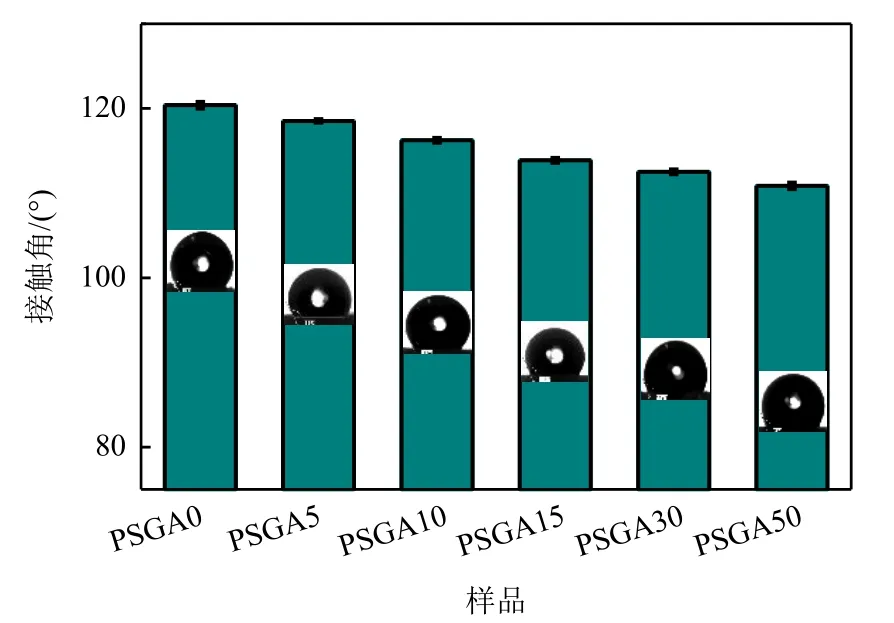
图5 不同ASA含量的PLA/CS/GO/ASA载药仿生复合支架的接触角
2.6 血液相容性
理想的骨组织工程支架在与血液接触时必须具有良好的血液相容性。根据美国材料与实验学会(ASTM,756-00,2000)规定,材料的溶血特性可分为三类:非溶血(溶血率低于2%)、轻度溶血(溶血率在2%~5%)和溶血(溶血率超过5%)[36]。因此,本研究采用人红细胞来测定PLA/CS/GO/ASA复合支架的血液相容性。图6显示,本文所制备的不同ASA含量的载药支架的溶血率分别为:PSGA0 0.27%±0.04%; PSGA5 0.58%±0.24%; PSGA10 1.95%±0.31%; PSGA15 1.71%±0.35%; PSGA30 2.14%±0.24%;PSGA50 3.10%±0.21%。因此,根据ASTM的规定,PSGA0和PSGA5复合支架的溶血率均小于2%,为非溶血材料;而PSGA10 和PSGA15则处于轻度溶血和非溶血的界限;PSGA30和PSGA50的溶血率虽有所增加,但仍然小于5%,属于轻度溶血材料。这一结果与PLGA/ASA[37]、琼脂糖/CS/GO[38]等相关支架材料的溶血结果一致。
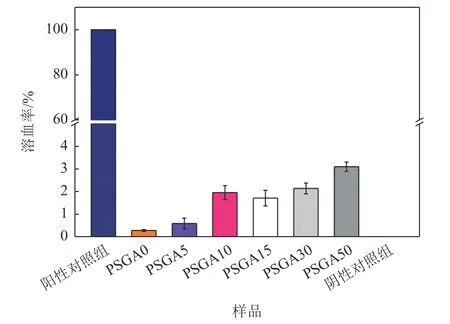
图6 不同ASA含量的PLA/CS/GO/ASA载药仿生复合支架的溶血率
图7是不同ASA含量的复合支架的血小板黏附实验的SEM 图。如图7 所示,PSGA0、PSGA5、PSGA10、PSGA15 和PSGA30 的复合支架表面黏附着零星的血小板(箭头所示),PSGA50 的样品则未发现[图7(f)]。复合支架的表面性质、亲水性和组成都可能对血小板黏附起作用。Milleret 等[39]研究了静电纺丝纤维直径和血管移植物表面的粗糙度对血液活化的影响,即对血小板活化和黏附的影响,结果显示,支架的形貌结构比聚合物的化学组分具有更大的影响。他们还发现,由细纤维(直径<1μm)组成的支架几乎没有血小板黏附,而那些纤维较宽(2~3μm)的支架的血小板黏附增加。此外,他们还认为纤维直径越小支架的疏水性越强。另有研究也证实涂层的超疏水特性抑制血小板黏附在材料表面[40]。因此,本研究制备的仿生微、纳米纤维支架具有抑制血小板黏附的特性是由于亲水性较差及本身的仿生微纳米纤维结构造成的。另外,ASA本身也是一种抗凝药物,可用来增加血液的流动性,减小血小板的活性。Lee 等[37]和Aslani等[41]的研究小组都报道了一种负载有ASA的可生物降解纳米纤维复合支架可以有效抑制血小板的黏附。在本研究中,复合支架抑制血小板黏附可能是多种因素综合作用的结果。因此,综合溶血实验和血小板黏附实验可证明所制备的复合支架具有良好的血液相容性。

图7 不同ASA含量的PLA/CS/GO/ASA载药仿生复合支架的血小板黏附电镜图
2.7 细胞相容性
采用CCK-8 评估MC3T3-E1 细胞在不同ASA含量的复合支架上的增殖情况(图8)。如图8 所示,MC3T3-E1细胞在不同的支架上培养1~5d后均有细胞增殖,但增殖情况不同。样品PSGA0随着培养天数的增加,OD值也逐渐增加(P<0.0001),说明支架具有良好的细胞相容性;PSGA5 的样品具有相同的增殖趋势。但对比这两组支架可知,在支架培养的前3 天,ASA 的添加有利于细胞的增殖,具有较高的OD值(P<0.0001),而在第5天,细胞增殖的OD值则小于未添加ASA组。同样,从图中还可以看到,样品PSGA50 的OD 值在整个培养周期中都小于样品PSGA0 和PSGA5。说明ASA 的添加对材料的细胞活性有一定的影响,特别是当ASA含量(50%)较大时,支架的OD 值较小,说明高浓度的ASA 对细胞具有一定的抑制作用。这与之前报道的细胞增殖结果一致[26]。另有研究报道也显示ASA 对细胞增殖有不同的作用。Cao 等[42]的研究表明,低浓度的ASA 可促进细胞增殖,而高浓度的ASA 则对细胞具有抑制作用。Niu 等[43]报道小剂量ASA并不能显著促进BMSC的增殖;大剂量ASA(5mmol/L)则会抑制BMSC增殖,可能是因为药物对细胞培养环境的酸化作用所致。Aslani 等[41]证明ASA 的掺入不会损害细胞活力和细胞增殖。此外,他们还报道了AM 裂解液涂层ASA-PLLA-aligned支架有利于沃顿氏胶源的间充质干细胞的内皮分化。负载ASA 的PLGA 纳米纤维支架具有功能活性,可高效抑制血小板和单核细胞黏附,并促进再内皮化[37]。虽然ASA 对细胞增殖的作用尚有争议,但有文献表明,该药物在促进骨质疏松症骨再生,促进骨修复方面具有重要作用。Ren 等[28]认为载ASA的植入物显示MC3T3-E1细胞向成骨细胞分化程度更高且增殖率与纯钛植入物相当。另外,Aslani 等[41]还表明,ASA 在合并移植术后部位的局部释放有助于抑制血栓形成。因此,细胞增殖实验表明,制备的PSGA0 支架比载ASA 支架具有更好的细胞相容性;但少量ASA 的加入对支架的增殖影响不大,大量ASA 的添加则对细胞的增殖具有抑制作用,但它们仍然表现出一定程度的细胞相容性。
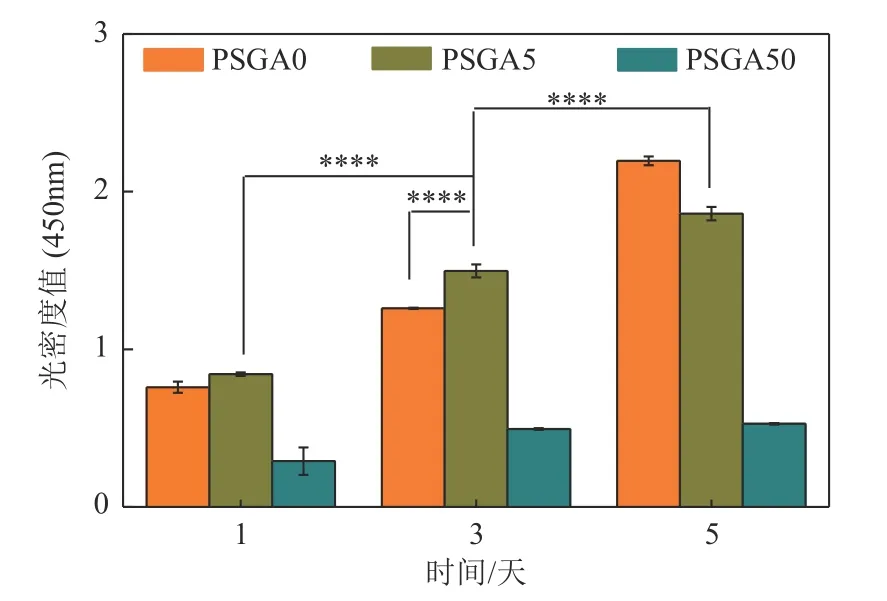
图8 MC3T3-E1在不同ASA含量的PLA/CS/GO/ASA仿生复合载药支架上的增殖
2.8 ASA的体外缓释
图9(a)是PSGA5载药支架在PBS溶液中浸泡8d后的SEM 图。对比图1(b1)可发现支架在缓释后表面出现明显的孔隙结构,这是由支架中的药物ASA从支架中释放形成的。从ASA 的缓释累积释放曲线图[图9(b)]上也可以证实这点。从累积释放曲线上可以看出,支架在24h时累积释放了30.25%,后期释放速率趋缓,在释放第6天达到最大累积释放量(94.46%)。说明该复合支架可以有效地缓释ASA,这将对后期的骨移植及修复起到重要作用。

图9 5% ASA含量的PLA/CS/GO/ASA载药仿生复合支架缓释8天后的电镜图(a)和阿司匹林在PLA/CS/GO/ASA载药仿生复合支架上的累积释放质量分数(b)
3 结论
采用相分离法制备了一系列不同ASA 含量的三维多孔PLA/CS/GO/ASA载药仿生复合支架。ASA的添加破坏了PLA 球晶结构的形成,增大了基体结构的孔径,但对仿生微、纳米纤维结构的影响不大;实验范围内随ASA的增加, 载药支架亲水性能有所改善,但孔隙率呈先减后增的趋势,但均大于80%;溶血率和血小板黏附实验表明,低含量的ASA载药仿生复合支架具有良好的血液相容性;所制备的载药复合支架具有细胞相容性,而高含量ASA 的加入对MC3T3-E1 细胞具有一定的抑制作用;药物缓释实验证明该复合支架具有良好的缓释性能。综上,该系列的载药仿生支架有望应用于临床骨修复,但其降解性能和药物释放及对应的力学性能有待进一步的实验。

