黄芪多糖对肺肿瘤转移前微环境中HIF-1和S100A8/A9 蛋白表达及肺转移的影响
刘兆华,王彦君,申明,陈彦文,李杨,杨玲玲,梁乾坤,明海霞∗
(1.甘肃中医药大学基础医学院,兰州 730000;2.甘肃中医药大学中西医结合基础学科,兰州 730000;3.甘肃中医药大学重大疾病分子医学与中医药防治研究重点实验室,兰州 730000;4.甘肃省中医药防治慢性疾病重点实验室,兰州 730000;5.甘肃中医药大学附属医院,兰州 730000)
据相关统计结果显示,全球每年新发肺癌病例约209.3 万例,死亡约176.1 万例,在所有恶性肿瘤中一直居高不下[1]。虽然在现在科学治疗模式下,可以使用各种治疗方法包括手术、放化疗、生物疗法以及靶向治疗。但不容乐观的是,手术切除后的5 年生存率仅为20%~ 25%[2]。对于中后期的患者来说,放化疗虽然有一定的疗效,但副作用大大增加,5 年内的生存率不足15%[3]。其中肿瘤转移是肺癌患者死亡的主要原因,其前提是由原发肺癌细胞来源的分泌因子构建的肿瘤转移前微环境(pre-metastatic niche,PMNs)。因此,抑制PMNs 的形成,对肿瘤的复发和转移具有一定的积极意义。中医认为“最虚之处,便是客邪之地”,机体某一局部的“最虚”,是形成PMNs 的必要条件,所以肿瘤巩固治疗期间的原则是“先安未受邪之地”,从而起到预防转移的作用[4]。
在邹伟等[5]关于小鼠肿瘤模型的研究中发现,髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)能够定向趋向性迁移到机体的某些特定位点,并与相应器官的纤维连接蛋白(fibronectin,FN)表位相结合,这为在机体中进行转移的癌细胞提供了大量的附着点位,且能够通过特异性诱导钙结合炎性蛋白S100A8/A9 的表达从而募集更多的MDSCs,形成恶性循环。MDSCs 来源于未分化成熟的骨髓细胞,能够抑制包括由免疫T 细胞、自然杀伤细胞等介导的免疫应答,从而成为PMNs 构建中的关键因素。另有研究显示,在胰腺癌中,缺氧诱导因子1(hypoxiainduciblefactor-1,HIF-1)可通过上调分泌MCP-1,促进PMNs 中炎性和纤维化微环境的形成,因此将HIF 作为靶点针对肿瘤相关免疫治疗可能成为新的方向[6]。现代药理学研究表明,黄芪多糖(Astragaluspolysaccharide,APS)具有调节机体免疫、增强巨噬细胞活性、抗肿瘤等作用,故选用药物黄芪多糖以S100A8/A9、HIF-1 为靶点进行研究,通过小动物活体成像,HE 染色及对肿瘤转移前微环境中相关标志性蛋白的检测,验证肺肿瘤转移前微环境的模型构建,并初步阐明APS 对肺PMNs中的作用靶点及对肺转移影响的分子机制。
1 材料与方法
1.1 材料
1.1.1 实验动物
采用49~ 56 日龄的SPF 级C57BL/6 健康小鼠雌雄各半共90 只,体重(18 ± 2)g,购于福贝斯(北京) 生物技术有限公司【SCXK(京) 2019 -0010】,分笼饲养于甘肃中医药大学实验动物中心【SYXK(甘)2020-0009】。饮水和进食自由,饲养环境适宜,通风设备齐全,按期消毒,温度(23 ± 2)℃,湿度(45 ± 15)%,光照时间约为12 h/12 h 明暗周期,所有操作均经甘肃中医药大学实验动物伦理委员会审批(2021-150)。
1.1.2 细胞
荧光素酶(LUC)标记的Lewis 鼠源性肺腺癌细胞株(lewis lung carcinoma cells,LLC)购自上海丰晖生物(CL0720)。
1.1.3 主要试剂与仪器
黄芪多糖(批号:C29J9Y53671,上海源叶生物有限公司),纯度大于70%;芬戈莫德(批号:32034,MCE 公司);胎牛血清(批号:12A349,ExCell Bio 公司);青链霉素混合液(批号:P1400,Solarbio 公司);S100A8 抗 体(批 号:21 × 5531,Affinity 公 司)、S100A9 抗体(批号:56m0698,Affinity 公司);HIF-1抗体(批号:44461,GeneTex 公司);抗体内参(批号:66j9958,ImmunoWay 公司);组织细胞裂解液(批号:R0010,Solarbio 公司);BCA 蛋白浓度测定试剂盒(批号:PC0020,Solarbio 公司);SYBR Green 荧光染料(批号:H1108051,YEASEN 公司);超敏ECL(批号:P10100A,新赛美公司);蛋白磷酸酶抑制剂(批号:P1260,Solarbio 公司);SDS-PAGE 凝胶制备试剂盒(批号:P1200,Solarbio 公司)。
-80℃超低温冰箱(海尔,DW-86L338J,中国);二氧化碳培养箱(HERAcell VIOS 160i,美国);酶标仪(SpectraMax 190,美 国);基 因 扩 增 PCR 仪(S1000,美国);普通PCR 仪(TC-96,中国);分光光度计(NanoDrop 2000C,美国);小动物活体成像仪(IVIS Spectrum,Caliper Life Sciences,美国)。
1.2 方法
1.2.1 细胞培养
LUC 标记的小鼠Lewis 肺癌(LLC)细胞加入新鲜DMEM 培养液中,培养箱为95%空气与5% CO2混合的气体环境,温度为(36.5 ± 0.5)℃。定期采用显微镜对肿瘤细胞的生长状态进行观察,及时进行细胞传代,并选取对数期的肿瘤细胞进行实验。
1.2.2 模型建立、动物分组及给药
制备肺癌转移前微环境模型,将C57BL/6 小鼠随机分为空白组、模型组、低剂量组(灌服黄芪多糖50 mg/kg)、中剂量组(灌服黄芪多糖100 mg/kg)、高剂量组(灌服黄芪多糖200 mg/kg)、芬戈莫德组(腹腔注射FTY720 1 mg/kg),每组15 只。除正常组外,将LUC 标记的LLC 细胞悬液(1 × 106/mL)0.1 mL 注射在小鼠的尾静脉上。FTY720 组在肿瘤接种24 h 后,腹腔注射,给药剂量为1 mg/kg,2 d 1 次,间隔给药持续4 周。APS 各组在肿瘤接种24 h 后按计划分量给药,每天1 次,持续4 周。模型组给同剂量的生理盐水。
1.2.3 小动物活体成像
在接种后的第3、7、14 天采用小动物活体成像技术监测小鼠体内肿瘤荧光信号的表达。将各组小鼠经过腹部褪毛后腹腔注射荧光素酶底物(15 mg/mL),采用0.8%的戊巴比妥钠对小鼠进行麻醉,15 min 后将小鼠采取仰卧体位放入Lumina Ⅲ操作台进行活体成像检测。通过IVIS Spectrum 系统拍照,其中高强度信号显示为红色,低强度信号为紫色。
1.2.4 HE 染色
取小鼠肺肿瘤部位组织进行病理检测,采用常规方法制作切片,依次加入二甲苯Ⅰ20 min,二甲苯Ⅱ15 min,无水乙醇6 min,75%乙醇6 min,用水冲洗片刻,苏木精染色4~ 6 min,自来水冲洗,伊红染色5 min,用水冲洗,采用无水乙醇脱水1~ 2 s,再放入石炭酸二甲苯脱水2~ 3 s,并采用中性树脂胶封固。
1.2.5 Western Blot
检测各组小鼠肺组织中S100A8、S100A9 和HIF-1 蛋白的表达。处死小鼠,取出肺组织,加入细胞裂解液和PIR 混合液(10 μL/mg)进行匀浆,并在冰上裂解15 min,离心10 min (12 000 r/min),取上清液保存。使用分光光度计进行蛋白浓度测定。并根据相应蛋白的分子量依据说明书配置所需的浓缩胶和分离胶,用移液枪加入制胶板中。取蛋白样品上样,电泳应采用80 V 恒压0.5 h 后转120 V约1 h,电泳完成后取出凝胶,对照标准蛋白条带线,确定样品蛋白的所在区域,将电泳凝胶与PDVF 结合,排出气泡,电泳槽转印,恒流220 mA,30 min。转印结束后,取出PDVF 膜置入封闭液中(含4%脱脂奶粉TBST 溶液)进行封闭2 h。取出PDVF 膜用TBST 缓冲液洗去残留封闭液,根据抗体说明书配置一抗并将孵育盒放入4℃摇床过夜,再用TBST 液洗3~ 4 次,每次8~ 10 min,然后配置二抗放摇床孵育2~ 3 h,用TBST 洗去残留液。加入ECL 发光液显色至条带清晰,使用成像仪拍照保存结果,并使用Image J 软件进行分析。
1.2.6 实时荧光定量PCR(RT-qPCR)
取小鼠肺组织75 mg 用无菌剪刀剪碎并将其放入生理盐水中浸泡清洗,并加入TRIzol 溶液1.5 mL,将其放入匀浆机中充分研磨,4℃,12 000 r/min离心15 min,取出后静置3 min,加入氯仿0.3 mL,将其充分混匀,随后再静置4 min 后离心15 min,取上层清液加入0.75 mL 异丙醇,充分混匀后再次离心15 min,取出后弃掉上清液,留下沉淀物;将75%乙醇加入沉淀中混匀,再次离心10 min,轻轻倒掉上清液,留取沉淀,置于超净台开风机吹干,再向管中加入DEPC 水20 μL 溶解,并使用分光光度计测量纯度,将提取后的RNA 进行逆转录,以cDNA 为模板,配制相应的反应体系,使用PCR 仪进行扩增。反应结束后保存结果,并进行3 次生物学重复。采用Livak 法对实验数据进行定量分析。
1.3 统计学分析
采用SPSS 26.0 和GraphPad Prism 8 软件对数据进行统计学分析,计量资料采用平均值± 标准差()进行统计描述,组间两两比较采用t检验方法,多组计量资料采用单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 肺肿瘤转移前微环境模型的验证
2.1.1 Western Blot 法检测肺组织中VCAN、LOX和FN 的蛋白表达情况
Western Blot 检测结果显示:对于VCAN、LOX、FN 的蛋白表达,与空白组比较,模型组的VCAN、LOX、FN 蛋白的表达量均显著提高,差异有统计学意义(P<0.05)。从蛋白水平验证肺肿瘤转移前微环境模型的成功建立(见图1)。

图1 Western Blot 法检测肺组织中VCAN、LOX、FN 的蛋白表达水平Note.Compared with blank group,∗∗∗∗P <0.0001.(The same in the following figures and tables)Figure 1 Protein expression levels of VCAN,LOX and FN in lung tissues were detected by Western Blot
2.1.2 RT-qPCR 法检测肺组织中VCAN、LOX 和FN 的mRNA 表达情况
RT-qPCR 法检测肺组织发现:与空白组比较,模型组中VCAN、LOX 和FN mRNA 的表达量均显著提高,差异有统计学意义(P<0.05)。从基因水平上验证肺肿瘤转移前微环境模型的成功建立(见表1)。
表1 RT-qPCR 法检测肺组织中VCAN、LOX 和FN 的mRNA 表达情况(,n=5)Table 1 mRNA expression of VCAN,LOX and FN in lung tissue was detected by RT-qPCR(,n=5)

表1 RT-qPCR 法检测肺组织中VCAN、LOX 和FN 的mRNA 表达情况(,n=5)Table 1 mRNA expression of VCAN,LOX and FN in lung tissue was detected by RT-qPCR(,n=5)
注:与空白组相比,∗∗P <0.01。Note.Compared with blank group,∗∗P <0.01.
2.2 IVIS 的监测和评价
根据小动物活体成像监测结果表明,通过对小鼠尾静脉注射肺癌细胞后第3 天即可在小鼠尾部检测到较为明显的荧光信号,在第7 天监测到肿瘤细胞明显在小鼠肺部聚集并随着天数增加而增多。一方面进一步验证了肺肿瘤转移前微环境模型的成功建立;另一方面经过荧光分析发现,相较于模型组,低、中、高剂量组及FTY720 四组小鼠荧光生物发光增加的强度在逐渐降低,其中高剂量组和FTY720 组降低得较为明显(见图2)。

图2 各组小鼠前14 d 小动物活体成像检测Figure 2 Animals in each group were imaged in the first 14 days
2.3 HE 染色观察转移灶
通过对小鼠肺组织切片进行HE 染色分析,观察小鼠肺组织中的肿瘤转移灶情况,结果如图3 所示。与空白组相比,模型组小鼠肺组织中出现大面积肺泡壁增厚和粒细胞浸润,并出现少量肿瘤转移灶,可以看到肺组织中存在的大量异型、核质比高、胞浆略嗜碱性的肿瘤细胞。与模型组相比,高剂量组和FTY720 组小鼠的肿瘤转移灶点明显减少,肺组织趋于正常,表明一定浓度的APS 对肺肿瘤细胞的转移有抑制作用(见图3)。

图3 各组小鼠第28 天肺组织HE 染色Figure 3 HE staining was performed on lung tissues of mice in each group on the 28th day
2.4 RT-qPCR 法检测肺组织中S100A8、S100A9和HIF-1 的mRNA 的表达情况
RT-qPCR 法检测肺组织发现:与空白组比较,模型组中S100A8、S100A9、HIF-1 mRNA 的表达量显著提高,差异具有显著性(P<0.05)。而与模型组比较,各治疗组中S100A8、S100A9、HIF-1 mRNA的表达量均显著下降,并依次呈阶梯状递减,表明高剂量组与FTY720 组治疗效果相比其他组更好,差异具有显著性(P<0.05)(见图4)。
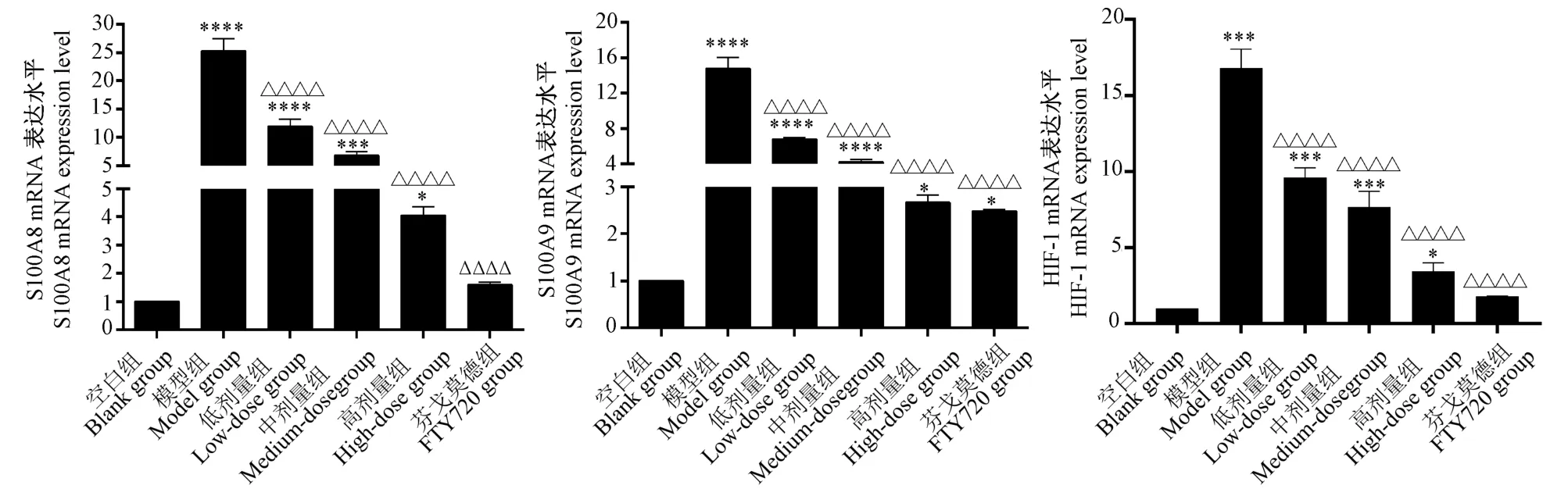
图4 RT-qPCR 法检测肺组织中S100A8、S100A9、HIF-1 mRNA 的表达水平Note.Compared with blank group,∗P <0.05,∗∗∗P <0.001.Compared with model group,△△△△P <0.0001.(The same in the following figures)Figure 4 mRNA expression levels of S100A8,S100A9 and HIF-1 in lung tissues were detected by RT-qPCR
2.5 Western Blot 法检测肺组织中S100A8、S100A9 和HIF-1 的蛋白表达情况
Western Blot 检测结果显示:对于S100A8、S100A9、HIF-1 的蛋白表达,与空白组比较,模型组中S100A8、S100A9、HIF-1 蛋白的表达量显著提高,差异具有显著性(P<0.05)。而与模型组相比,各治疗组中S100A8、S100A9、HIF-1 的蛋白表达量均显著下降,并依次呈阶梯状递减,其中高剂量组和FTY720 组较其他组治疗效果更好,差异具有显著性(P<0.05)(见图5)。

图5 Western Blot 法检测肺组织中S100A8、S100A9、HIF-1 的蛋白表达水平Figure 5 Protein expression levels of S100A8,S100A9 and HIF-1 in lung tissues were detected by Western Blot
3 讨论
非小细胞肺癌是起源于支气管黏膜、腺体和肺泡上的恶性肿瘤,占据我国城市人口中恶性肿瘤死亡原因的首位,尽管近年来其诊断和治疗方面取得了一定的进展,但5 年生存率仅13%左右。早在1889 年,Paget[7]就提出了“种子与土壤”假说用于解释肿瘤的转移。在后来的研究中,Kaplan等[8]最早提出了“转移前微环境(PMNs)”概念。认为原发肿瘤来源的分泌因子在转移前特异性的到达待转移组织器中,通过改变其微环境,从而构建一个适合原发肿瘤转移的环境即PMNs,最终形成转移病灶。因此,如果能有效抑制PMNs 的形成,对控制肿瘤的复发和转移会有一定的积极作用。
本实验首先根据小动物活体成像观察了小鼠在第3、7、14 天中LLC 细胞在体内通过血液转移到肺的情况。既揭示了肿瘤细胞向肺部的转移进程,同时也作为评价转移前微环境模型构建成功与否的方法之一。而实验结果显示,在对小鼠前14 d 进行观察时,小动物活体成像能准确反映接种LUC 标记的LLC 小鼠的肺部肿瘤生长情况,并通过在3、7、14 d 分别对小鼠肺组织进行取材观察,与前3 d 相比,第14 天时肺组织能够肉眼可见类圆形、半透明状的凸起病灶。
目前有研究发现,CD11b+MDSCs 可以通过表达多功能蛋白聚糖(versican,VCAN) 来构建立PMNs[9],同时有研究表明,在PMNs 形成的低氧环境下极大的促进赖氨酰氧化酶(lysyloxidase,LOX)生成,LOX 能够使癌细胞的黏附能力下降,进而促进癌细胞的迁移[10-11]。而BMDCs 高表达FN 受体α4β1,并特异性的与靶器官FN 表位结合,进一步诱导MDSCs 迁移,共同构建肺转移前微环境。故选择具有标志性VCAN、LOX、FN 蛋白通过RT-qPCR 以及Western Blot 技术进一步验证肿瘤转移前微环境模型构建。在本实验中,Western Blot 及RT-qPCR结果均显示空白组小鼠与模型组小鼠在这些标志性蛋白的表达间存在差异,进一步验证了肺肿瘤转移前微环境造模的成功。
同时,在HE 染色的结果中发现,通过观察模型组小鼠,发现肿瘤细胞在肺部聚集数量较多,细胞形态及排列呈不规则状,大多分布在气管周围,而且有形成较明显的转移灶。在肿瘤转移前微环境的形成过程中,营造一个炎性微环境至关重要,而黄芪多糖可有效减少小气管周围如中性粒细胞等炎性细胞的数量,说明黄芪多糖能通过干预转移前炎性微环境,可有效减少肿瘤细胞在肺中的种植或生长。
有报道称在肿瘤的缺氧微环境下能使HIFs 高表达,而表达上调的HIFs 又能够提高它的转录活性从而进一步增加其基因突变的几率,促使肿瘤的增殖和迁移加剧[12-13]。HIF-1 由α 和提取物β 两个亚基组成,最早是在肝癌细胞株Hep3B 经缺氧环境下诱导在细胞核中提取物发现的一种转录因子。在HIF-α 家族目前已经发现的有HIF-1α、HIF-2α、HIF-3α 等因子,而其中HIF-1α 在肿瘤细胞中对于调节低氧环境、改变糖代谢机制中起着十分重要的作用[14],能够影响如VEGF、IL-8、IL-6 及TNF-α 等原癌基因和免疫因子的表达,从而加速肿瘤发展的进程[15]。研究表明,HIF-1 能通过参与多种靶基因调控使细胞和组织适应缺氧环境,也能够通过促进肿瘤细胞的血管生成,加速肿瘤的转移[16]。同时肿瘤内缺氧环境促进LOX 生成,LOX 的生成也依赖HIF,其被认为是PMNs 形成的初始关键因素[17]。在本实验中,RT-qPCR 结果显示低、中、高剂量组中检测相关因子HIF-1 的mRNA 表达均低于模型组,提示黄芪多糖可能通过降低HIF-1 的mRNA 表达,减少HIF-1 生成,进而影响PMNs 的形成。Western Blot 的结果与RT-qPCR 相一致。
PMNs 的形成机制比较复杂,研究发现钙结合蛋白S100A8/A9 在PMNs 形成过程中有重要作用。钙结合蛋白S100A8 和S100A9 是S100 超家族的重要成员,细胞内通常以二聚体的形式存在,在髓细胞中大量表达,如循环单核细胞和中性粒细胞,并在炎症反应中被上调[18]。它的主要作用一方面是与一些特定糖蛋白受体结合通过激活炎性通路促进炎性环境的形成;另一方面能够与髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)上的受体结合促进MDSCs 集聚从而抑制机体的免疫调节[19-20],促进PMNs 的形成。其中S100A8/A9 的过表达能够特异性的诱导MDSCs 的集聚,而MDSCs能通过表达整合素、多功能蛋白聚糖来动态重塑、建立PMNs。正因为钙结合蛋白S100A8/A9 的机制与PMNs 的形成联系密切,所以其在PMNs 的表达情况以及能否作为靶点用于临床诊治值得探讨和研究。而在本实验的研究中RT-qPCR 结果显示低、中、高剂量组中检测相关因子S100A8,S100A9 的mRNA 表达均低于模型组,提示黄芪多糖可能通过降低S100A8/A9 的mRNA 表达,减少S100A8/A9生成,进而影响PMNs 的形成,这与Western Blot 结果一致。
综上,本实验研究发现,黄芪多糖能够通过下调HIF-1、S100A8、S100A9 因子的表达,抑制肺转移前微环境的形成,从而减少肿瘤细胞向远端靶器官的转移。但其具体的免疫学机制仍需进一步研究。

