博来霉素联合脂多糖诱导大鼠特发性肺纤维化急性加重动物模型的建立
于睿智,王天娇,臧凝子,吕晓东,庞立健∗
(1.辽宁中医药大学,沈阳 110032;2.辽宁中医药大学附属医院,沈阳 110032)
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是一种病因不明的间质性肺疾病,病变局限于肺部,胸部影像学和组织病理学表现为普通间质性肺炎[1],部分患者在短期内可能出现显著的急性呼吸功能恶化,被称为特发性肺纤维化急性加重(acute exacerbation of idiopathic pulmonary fibrosis,AE-IPF)[2]。AE-IPF 是IPF 患者死亡的重要原因,其病情危重,进展迅速,治疗困难,预后极差[3]。建立稳定、经济、易行的AE-IPF 动物模型有助于探索AE-IPF 的发病机制,为疾病的预防、预后的康复、新药的研发提供重要支撑,然而现阶段AE-IPF 的动物模型建立相关研究较少。
本研究拟采用先经气管内注射博来霉素(bleomycin,BLM)诱导建立IPF 大鼠模型,后经腹腔内注射脂多糖(lipopolysaccharide,LPS)诱导AEIPF 大鼠模型建立,并基于腹腔内注射LPS 用量的不同,从组织病理学、分子生物学及呼吸系统常规检查等层面,对通过该种方法建立的AE-IPF 大鼠模型进行鉴定,分析诱导剂的合理用量,同时将该模型建立方法与两次经气管内注射BLM 诱导大鼠AE-IPF 模型建立方法对比,探讨该种AE-IPF 大鼠模型建立方法的科学性与可行性。
1 材料与方法
1.1 材料
1.1.1 实验动物
150 只健康Wistar 大鼠,SPF 级,雄性,6 周龄,体重(200 ± 20)g,购于辽宁长生生物技术股份有限公司【SCXK(辽)2020-0001】,饲喂大鼠普通专用饲料购于沈阳茂华生物科技有限公司,实验动物饲养于辽宁中医药大学实验动物中心【SYXK(辽)2019-0004】。实验环境:SPF 级动物室,环境温度(21 ±3)℃,相对湿度60%~ 70%自然采光、昼夜各半。饲养方法:予普通专用饲料喂养、每2 d 投喂1 次,予纯净水喂养、每日加水,予更换垫料并清洁笼具、每周2 次。本实验通过辽宁中医药大学实验动物伦理委员会批准(21000042021110)。
1.1.2 主要试剂与仪器
注射用盐酸博来霉素(瀚晖制药有限公司,国药准字HJ20171103),脂多糖(北京索莱宝科技有限公司,818ED35),戊巴比妥钠(国药集团化学试剂有限公司,20161129),苏木素-伊红染色试剂盒(北京索莱宝科技有限公司,G1120),Masson 三色染色试剂盒(北京索莱宝科技有限公司,G1341),羟脯氨酸测定试剂盒(南京建成生物工程研究所,A03021),Anti-α-SMA(江苏亲科生物研究中心有限公司,AF1032),通用SP 试剂盒(北京中杉金桥生物技术有限公司,SP-9000),Rat TNF-α ELISA KIT(上海酶联生物科技有限公司,m1002859),Rat IL-6 ELISA KIT(上海酶联生物科技有限公司,m1002828),异氟烷(深圳市瑞沃德生命科技有限公司,R510-22-10)。
电子天平(HZY-A100,福州华志科学仪器有限公司,中国),高速冷冻离心机(Heraeus Multifuge X1,赛默飞世尔科技公司,美国),常温台式高速离心机(TDZ5-WS,cence 湘仪,中国),冰箱(BCD-181KZ50,TCL,中国),-80℃超低温冷冻储存箱(中科美菱,中国),电脑全自动脱水机(ATP 700ST,Hestion 公司,澳大利亚),生物组织包埋机(YD-6D,金华市益迪医疗设备有限公司,中国),生物组织冷冻台(YD-6L,金华市益迪医疗设备有限公司,中国),半自动轮转式病理切片机(RM2245,Leica,德国),生物组织摊片机(YD-A,金华市益迪医疗设备有限公司,中国),生物组织烤片机(YD-B,金华市益迪医疗设备有限公司,中国),电热恒温干燥箱(GZX-DH 型,上海龙跃仪器设备有限公司,中国),恒温水浴锅(HH-S2,常州迈可诺仪器有限公司,中国),血气分析仪(GEM3500,实验仪器公司,美国),动物肺功能分析系统(AniRes2005,北京贝兰博科技有限公司,中国),小动物活体三维断层扫描系统(Quantum GX Ⅱ,珀金埃尔默,美国),医用分子筛制氧机(BF-2W,江苏鱼跃医疗设备股份有限公司,中国),全自动血细胞分析仪(XN-3000,希森美康医用电子有限公司,美国),酶标仪(Multiskan FC,赛默飞世尔科技公司,美国),光学显微镜及成像系统(CX41,Olympus 公司,日本)。
1.2 方法
1.2.1 动物分组及干预措施
将150 只大鼠采取随机数字表法随机分成6组,每组25 只:阴性对照组(Control 组)、缓解期对照组(IPF 组)、急性加重期对照组(BLM 组)、脂多糖低剂量组(LPS-low 组)、脂多糖中剂量组(LPSmid 组)、脂多糖高剂量组(LPS-high 组)。适应性饲养3 d 后进行首次造模,于首次造模后第28 天进行二次造模。首次造模:6 组均采用经气管1 次注入给药,其中,Control 组给予0.9%的氯化钠注射液,0.1 mL/100 g;其余5 组给予5 mg/mL 的博来霉素,0.1 mL/100 g。二次造模:BLM 组用经气管1 次注入给药,予7 mg/mL 的博来霉素,0.1 mL/100 g;其余5 组采用经腹腔注入给药,其中Control 组、IPF组给予0.9%的氯化钠注射液、0.5 mL/100 g、连续注射3 d,LPS 三组分别给予2.5 mg/mL、5 mg/mL、7.5 mg/mL 的脂多糖、0.5 mL/100 g、连续注射3 d。
1.2.2 两次造模操作方法详述
首次造模:取各组大鼠,予1.5%的戊巴比妥钠、0.2 mL/100 g 麻醉大鼠;纵向剪开大鼠颈正中皮肤,暴露气管;予0.1 mL/100 g 的诱导剂,注射时经大鼠气管的软骨环间隙朝向心端刺入气管腔,快速推注并拔出针头;逐层缝合大鼠颈部肌肉及皮肤,并用碘伏进行创口消毒,待大鼠自然清醒后置于笼内常规饲养。
二次造模:BLM 组造模方法与首次造模方法一致。其余各组取大鼠,予0.5 mL/100 g 的诱导剂,注射时经大鼠下腹部皮肤穿刺入腹腔,匀速推注并拔出针头;注射后揉按大鼠腹部注射部位以促进药物扩散;观察1 min,无明显异常后将大鼠置笼内常规饲养;连续注射3 d 诱导剂。
1.2.3 标本采集及处理
于首次造模后的第31、35 和42 天采集标本,第31、35 和42 天为本研究的三个取材时间点,三个取材时间点每组取材8 只大鼠,采集标本为大鼠的腹主动脉血浆、肺组织和肺泡灌洗液。具体方法:取各组大鼠麻醉后打开腹腔,暴露腹主动脉,穿刺采血,常温静置2 h 后3500 r/min 离心15 min,取上清密封保存于-80℃冰箱中,每组需有3 只大鼠采血后30 min 内使用血气分析仪进行动脉血气分析检测;打开大鼠胸腔,剥离肺组织,拍照记录,称湿重,计算肺系数;分离左右肺组织,左肺密封保存于-80℃冰箱中;右肺后叶单独剪下后称取湿重,60℃干燥24 h 后称干重,并计算肺湿干重比(W/D);剩余肺组织置于4%的组织固定液中固定备用;每组需有3 只大鼠进行肺泡灌洗液采集,灌洗液回收液回收率>80%,将肺泡灌洗液4℃1500 r/min 离心15 min,取上清液30 min 内使用全自动血细胞分析仪进行血细胞计数,剩余液体于-80℃冰箱保存。
1.2.4 HE 染色、Masson 染色
肺组织固定24 h 后进行脱水并用石蜡包埋;制作组织病理切片,脱蜡、水化后,分别使用HE 染色试剂盒和Masson 染色试剂盒染色;染色后透明、封片。用显微镜观察肺组织形态。
1.2.5 影像学检查
三个取材时间点每组取3 只大鼠进行影像学检查。具体方法:取大鼠,给予1.5%的异氟烷、流量0.8 L/min 吸入麻醉后固定于小动物活体三维断层扫描操作台上;打开系统软件,设定电压为90 kV、光源最大电流为40 μA、光源焦点尺寸为10 μm,镜像视野直径为70 mm。对大鼠肺CT 成像进行描述性比较。
1.2.6 肺功能检查
三个取材时间点每组取3 只大鼠进行肺功能检查。具体方法:取大鼠称重,予1.5%的戊巴比妥钠、0.2 mL/100 g 麻醉大鼠;用手术剪刀纵向剪开大鼠颈正中皮肤,暴露气管,插入气管导管;连接校准后的动物呼吸机,呼吸比为20 ∶10,关闭体描箱,打开系统软件,输入大鼠去尾长度、体重信息,待出现平稳呼吸曲线后,选择FVC 测定,压力值选择30 cmH2O,自动检测,保存检测报告。
1.2.7 支气管肺泡灌洗液TNF-α、血清IL-6 ELISA检测
三个取材时间点每组取3 只大鼠的肺泡灌洗液和血清进行检测。具体方法:取出96 孔板,设置标准品孔,空白孔和样本孔,标准品孔各加不同浓度的标准品50 μL,样本孔中加大鼠肺泡灌洗液或血清50 μL,空白孔什么都不加;除空白孔外,各孔加入辣根过氧化物酶标记的检测抗体100 μL,用封板膜封住反应孔,37℃水浴锅温育60 min;弃去液体,每孔加满洗涤液(350 μL),重复洗板5 次,每孔加入底物A、B 各50 μL,37℃避光孵育15 min;每孔加入终止液50 μL,15 min 内用酶标仪在450 nm 波长处测定各孔的OD 值,绘制标准曲线,计算TNF-α、IL-6 质量浓度。
1.2.8 碱水解法检测肺组织羟脯氨酸含量
三个取材时间点每组取3 只大鼠的肺组织进行羟脯氨酸检测。具体方法:取肺组织100 mg,加入1 mL 水解液,予20 min 沸水浴;肺组织肉眼不见则加入1 滴指示剂,混匀后准确加入1 mL 调pH 甲液,溶液变红后,逐滴加入调pH 乙液,溶液瞬间变为黄绿色,立刻停止滴加;将全部黄绿色液体移至量筒内,用双蒸水定容至10 mL,充分混匀;取3 mL定容后的液体加入25 mg 活性炭,3500 r/min 离心10 min,吸取1 mL 上清液待测;分别设置空白管、标准管、测定管,空白管中加入1 mL 双蒸水,标准管中加入浓度为5 μg/mL 的HYP 标准品1 mL,测定管中加入1 mL 待测样品;向各管滴加HYP 含量检测试剂,混匀后予60℃水浴15 min;冷却后予3500 r/min离心10 min;吸取上清液于酶标板中,每个样品设置3 个复孔,用酶标仪选定波长550 nm,测量吸光度(OD 值)。结果换算:计算公式为:羟脯氨酸含量(μg/mg 湿重)=[(测定OD-空白OD)÷(标准OD-空白OD)] × 标准品含量(5 μg/mL) × [水解液总体积(10 mL)÷ 组织湿重]。
1.2.9 肺组织α-SMA 免疫组化
三个取材时间点每组取3 只大鼠的肺组织进行检测。具体方法:组织包埋、切片、脱蜡和水化的方法与HE 染色方法一致;切片水化后用枸橼酸盐缓冲液高温修复抗原;在组织上滴加适量内源性过氧化物酶阻断剂,室温孵育15 min,PBS 缓冲液冲洗3 min × 3 次;滴加适量正常山羊血清封闭液,勿洗;滴加100 μL 稀释后的α-SMA 抗体,4℃孵育过夜,次日用PBS 缓冲液冲洗3 min × 3 次;滴加100 μL酶标羊抗小鼠/兔IgG 聚合物,37℃孵育15 min,用PBS 缓冲液冲洗3 min × 3 次;滴加100 μL 辣根酶标记链霉卵白素工作液。37℃孵育15 min,用PBS缓冲液冲洗3 min × 3 次;滴加100 μL DAB 显色剂,室温孵育5 min,用自来水冲洗5 min,苏木素染色孵育20 s,盐酸酒精分化3 s,自来水冲洗5 min 反蓝;切片透明、封片;用显微镜观察肺组织α-SMA 表达情况,使用Image J 图像分析软件对免疫组化病理切片进行定量分析。
1.3 统计学分析
实验结果采用SPSS 25.0 和GraphPad Prism 软件进行统计分析和图表绘制。所有计量数据资料均采用平均值± 标准差()方式描述;两组比较用t检验,多组比较用单因素方法分析(One-way ANOVA);回归曲线模型估算和求取回归方程采用曲线拟合(curve fitting)方法,P<0.05 为差异有统计学意义。
2 结果
2.1 生存情况分析
2.1.1 一般情况
适应性饲养3 d,大鼠精神正常、反应迅速、动作敏捷、毛发光泽柔顺、饮食正常、二便正常、爪甲红润、呼吸平稳。首次造模术后,各组大鼠精神萎靡、反应迟钝、行动迟缓、饮食减少,其中Control 组大鼠术后3 d 左右伤口愈合,恢复正常状态,其余各组大鼠相较于Control 组出现了呼吸急促、爪甲发绀、毛发枯槁,二便增多,体重下降,7 d 左右伤口愈合,症状有所减轻,至二次造模前仍可见呼吸急促。二次造模术后,Control 组和IPF 组大鼠无明显变化,其余各组大鼠状态明显恶化,精神极度萎靡、无视外界刺激、倦怠乏力懒动、毛发失去光泽、饮食饮水减少、二便明显增多,体重下降,伴有严重的呼吸急促、胸廓起伏明显、爪甲发绀、反复以爪抹鼻。
2.1.2 死亡情况分析
实验期间共有23 只大鼠死亡,死亡率15.97%。Control 组大鼠死亡1 只,IPF 组大鼠死亡3 只,BLM组大鼠死亡5 只,LPS-low 组大鼠死亡4 只,LPS-mid组大鼠死亡4 只,LPS-high 组大鼠死亡6 只。大鼠死亡原因包括:气管造模术中死亡,鼻部有明显药物液体气泡溢出,考虑气管造模操作不当;气管造模术后未清醒,考虑麻药过量;予诱导剂后死亡,剖腹后未见异常,考虑诱导剂细胞毒性,机体不耐受,而剖腹后见肺部血红色浸润,有明显瘀斑,考虑感染死亡。
2.2 肺组织W/D 测定
结果(表1)显示:IPF 组、BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组的肺W/D 升高,与Control组相比均存在显著性差异(P<0.01);BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组与IPF 组相比均存在显著性差异(P<0.01);LPS-mid 组与BLM组相比无显著性差异(P>0.05);随着时间的增加,肺组织W/D 降低。
表1 各组大鼠不同时间点肺组织W/D 变化情况(,n=6)Table 1 Changes in lung tissue W/D of rats at different time points in each group(,n=6)

表1 各组大鼠不同时间点肺组织W/D 变化情况(,n=6)Table 1 Changes in lung tissue W/D of rats at different time points in each group(,n=6)
注:与Control 组相比,∗∗P <0.01;与IPF 组相比,△△P <0.01;与BLM 组相比,○P <0.05,○○P <0.01。(下图/表同)Note.Compared with control group,∗∗P <0.01.Compared with IPF group,△△P <0.01.Compared with BLM group,○P <0.05,○○P <0.01.(The same in the following figures and tables)
2.3 肺系数
结果(表2)显示:IPF 组、BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组的肺系数升高,与Control 组相比均存在显著性差异(P<0.01);BLM 组、LPSlow 组、LPS-mid 组、LPS-high 组与IPF 组相比均存在显著性差异(P<0.01);LPS-low 组、LPS-mid 组、LPS-high 组与BLM 组相比均无显著性差异组(P>0.05);随着时间的增加,肺系数降低。
表2 各组大鼠不同时间点肺系数变化情况(,n=6)Table 2 Changes in lung coefficient of rats at different time points in each group (,n=6)
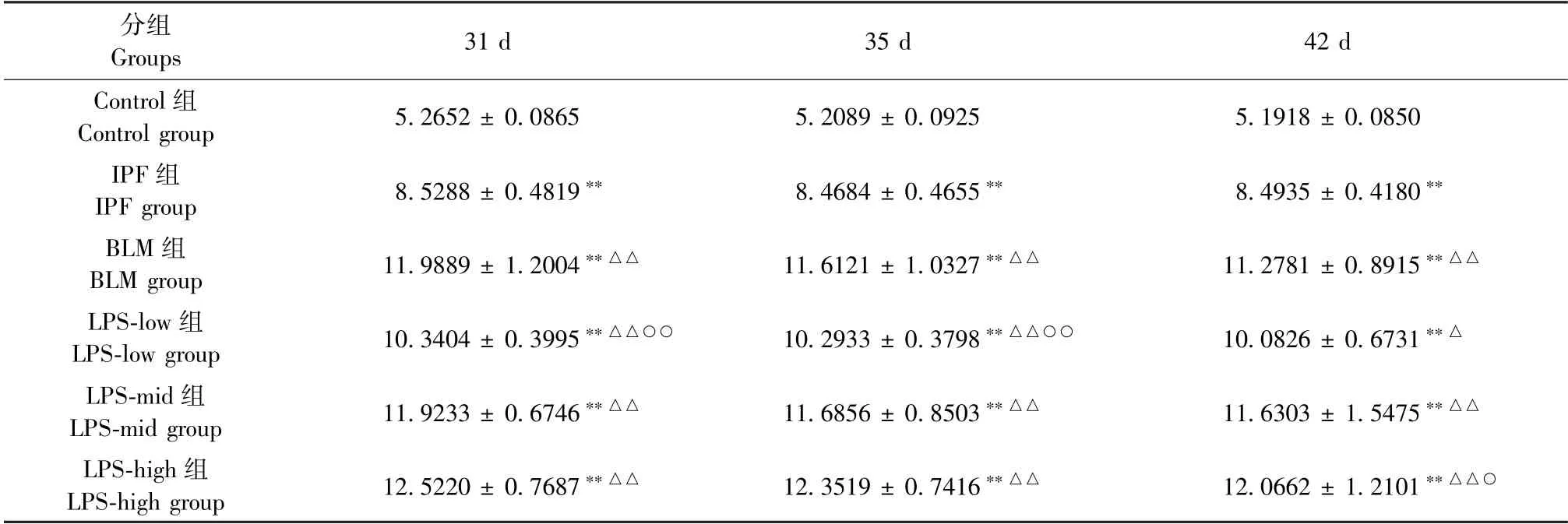
表2 各组大鼠不同时间点肺系数变化情况(,n=6)Table 2 Changes in lung coefficient of rats at different time points in each group (,n=6)
注:与IPF 组相比,△P <0.05。(下图/表同)Note.Compared with IPF group,△P <0.05.(The same in the following figures and tables)
2.4 肺组织形态学观察
结果(图1)显示:Control 组肺组织结构、颜色正常,质地柔软、表面光滑;IPF 组、BLM 组、LPS-low组、LPS-mid 组、LPS-high 组的肺组织出现明显肿大或萎缩,颜色灰白泛黄,质地变硬,表面出现瘀斑瘀点,部分出现囊肿,其中IPF 组肺组织改变较小,LPS-high 组肺组织改变较大,LPS-mid 组与BLM 组肺组织改变相近。

图1 各组大鼠不同时间点肺组织肉眼外观Figure 1 Macroscopic appearance of lung tissue of rats at different time points in each group
2.5 HE 染色
结果(图2)显示:Control 组肺组织结构清晰,未见肺泡壁增厚或塌陷,肺泡腔洁净,未见炎症、充血、水肿;IPF 组、BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组的肺组织结构紊乱,可见肺泡壁增厚或塌陷,肺泡腔内红细胞增多,出现炎性浸润,其中IPF 组病理改变较轻,BLM 组、LPS-mid 组、LPS-high组病理改变较重。
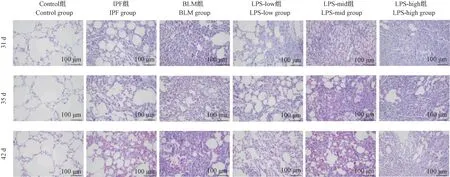
图2 各组大鼠不同时间点肺组织HE 染色Figure 2 HE staining of lung tissue of rats at different time points in each group
2.6 Masson 染色及肺纤维化病理学评分
结果(图3)显示:Control 组肺组织结构正常,肺泡壁无增厚或塌陷,肺泡壁中存在少量纤维沉淀;IPF 组、BLM 组、LPS-low 组、LPS-mid 组、LPS-high组的肺组织的结构紊乱,肺泡壁增厚塌陷,肺泡壁和肺泡腔内出现大量纤维沉积,其中IPF 组病理改变较轻,BLM 组、LPS-mid 组、LPS-high 组病理改变较重。
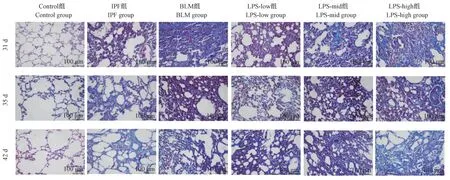
图3 各组大鼠不同时间点肺组织Masson 染色Figure 3 Lung tissue Masson staining at different time points of rats in each group
2.7 肺CT 分析
结果(图4)显示:Control 组肺视野显示充分,肺组织膨胀良好,肺纹理纤细,密度清晰均匀,无明显密度增高影;IPF 组、BLM 组、LPS-low 组、LPS-mid组、LPS-high 组的肺门显示高密度阴影,肺视野周边有片状棉絮样阴影,兼见不规则密度增高影。

图4 各组大鼠不同时间点Micro-CT 检查图Figure 4 Micro-CT examination chart of rats at different time points in each group
2.8 肺功能分析
结果(表3、表4)显示:IPF 组、BLM 组、LPS-low组、LPS-mid 组、LPS-high 组的肺功能FEV/FVC%、CL 均下降,与Control 组在上述各项比较中均存在显著性差异(P<0.01);LPS-mid 组与BLM 组在上述各项比较中均无显著性差异(P>0.05);随着时间的增加,肺功能和肺顺应性无明显变化。
表3 各组大鼠不同时间点肺功能FEV/FVC%比较(,n=3)Table 3 Comparison of FEV/FVC% of lung function of rats at different time points in each group(,n=3)
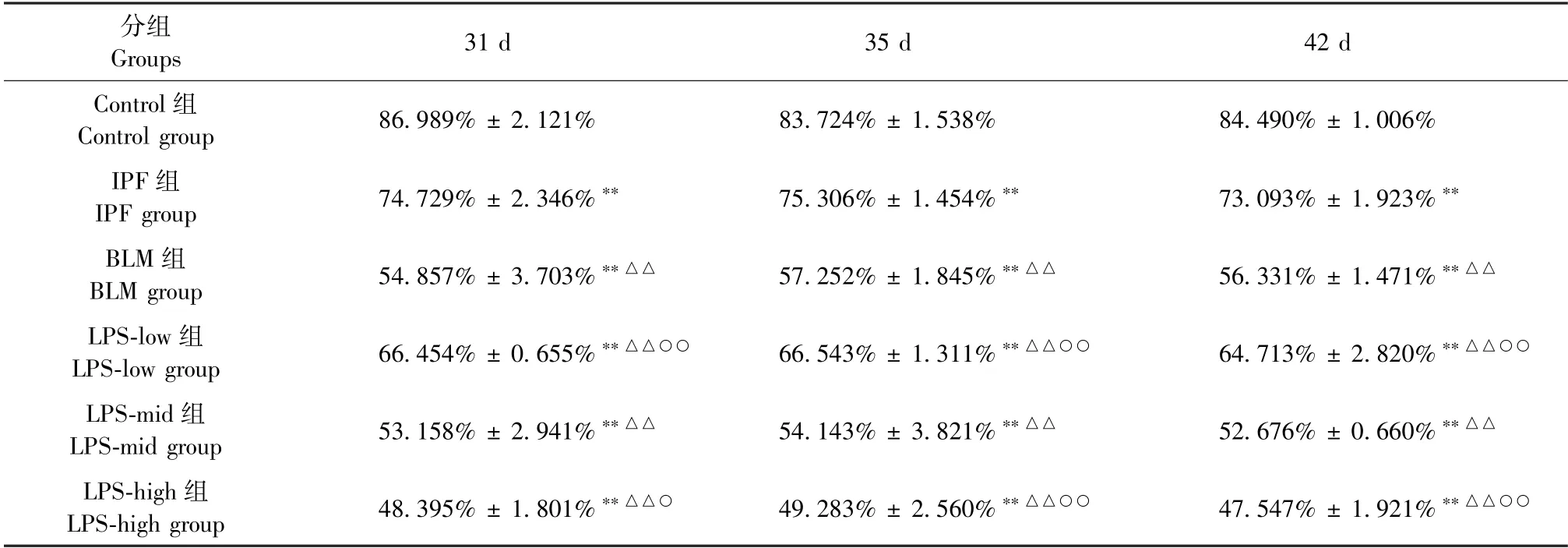
表3 各组大鼠不同时间点肺功能FEV/FVC%比较(,n=3)Table 3 Comparison of FEV/FVC% of lung function of rats at different time points in each group(,n=3)
表4 各组大鼠不同时间点肺功能CL 比较(,n=3,mL/cmH2O)Table 4 Comparison of lung function CL of rats in each group at different time points(,n=3,mL/cmH2O)

表4 各组大鼠不同时间点肺功能CL 比较(,n=3,mL/cmH2O)Table 4 Comparison of lung function CL of rats in each group at different time points(,n=3,mL/cmH2O)
2.9 动脉血气分析
结果(表5)显示:IPF 组、BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组 的PaO2显 著 下 降,与Control 组相比均存在显著性差异(P<0.01);BLM组、LPS-low 组、LPS-mid 组、LPS-high 组与IPF 组相比均存在显著性差异(P<0.01),LPS-mid 组与BLM 组相比无显著性差异(P>0.05);随着时间的增加,PaO2有所恢复。
表5 各组大鼠不同时间点PaO2 比较(,n=3,mmHg)Table 5 Comparison of PaO2 at different time points of rats in each group(,n=3,mmHg)
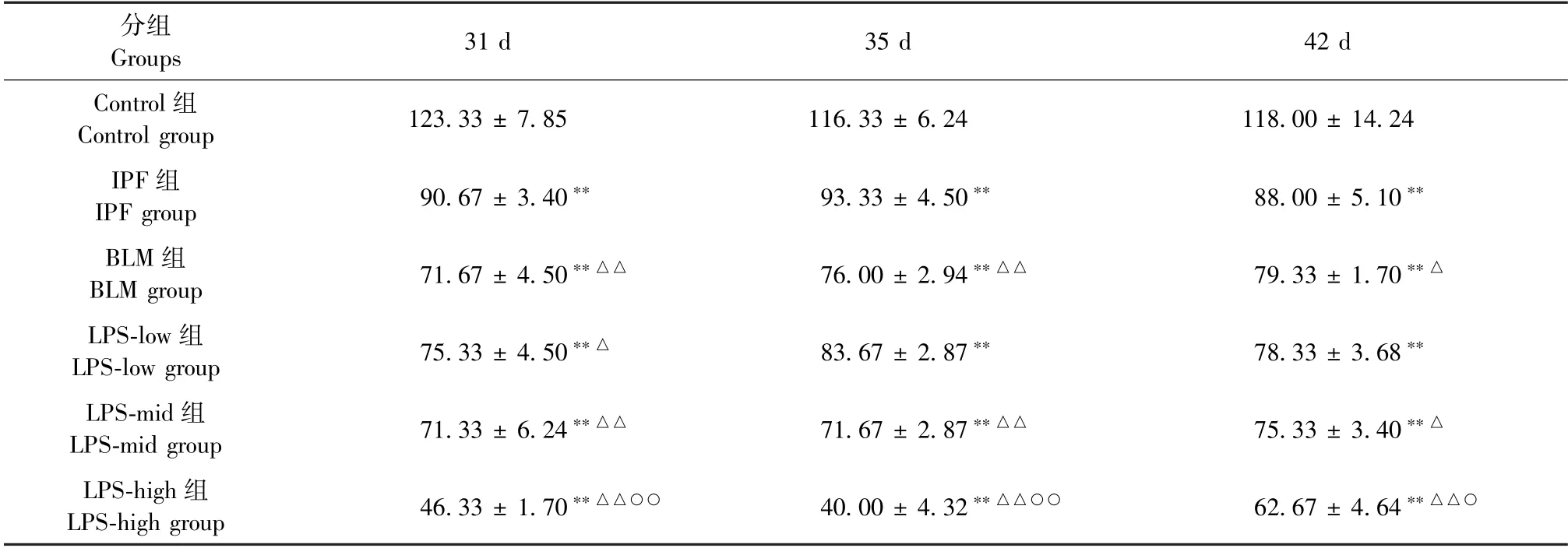
表5 各组大鼠不同时间点PaO2 比较(,n=3,mmHg)Table 5 Comparison of PaO2 at different time points of rats in each group(,n=3,mmHg)
2.10 支气管肺泡灌洗液细胞计数分析
结果(表6)显示:IPF 组、BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组的支气管肺泡灌洗液中性粒细胞计数升高,与Control 组相比均存在显著性差异(P<0.01);BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组与IPF 组相比均存在显著性差异(P<0.01),LPS-mid 组与BLM 组相比,在中性粒细胞计数上无显著性差异(P>0.05);随着时间的增加,肺泡灌洗液中性粒细胞计数无明显。
表6 各组大鼠不同时间点BALF 中性粒细胞计数比较(,n=3,× 109/L)Table 6 Comparison of BALF neutrophil counts at different time points in each group of rats(,n=3,× 109/L)

表6 各组大鼠不同时间点BALF 中性粒细胞计数比较(,n=3,× 109/L)Table 6 Comparison of BALF neutrophil counts at different time points in each group of rats(,n=3,× 109/L)
2.11 支气管肺泡灌洗液TNF-α、血清IL-6 含量分析
结果(图5)显示:IPF 组、BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组的支气管肺泡灌洗液TNF-α 质量浓度升高,与Control 组相比均存在显著性差异(P<0.01);BLM 组、LPS-low 组、LPS-mid组、LPS-high 组与IPF 组相比均存在显著性差异(P<0.01),LPS-mid 组与BLM 组相比无显著性差异(P>0.05);随着时间的增加,肺泡灌洗液中TNF-α质量浓度无明显变化。

图5 各组大鼠不同时间点BALF 中TNF-α 含量(,n=3)Note.Compared with control group,∗P <0.05.(The same in the following figures)Figure 5 TNF-α content in BALF of rats at different time points in each group(,n=3)
结果(图6)显示:IPF 组、BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组的血清IL-6 质量浓度升高,与Control 组相比均存在显著性差异(P<0.01);BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组与IPF组相比均存在显著性差异(P<0.01),LPS-mid 组与BLM 组无显著性差异(P>0.05);随着时间的增加,血清中IL-6 质量浓度无明显变化。
2.12 碱水解法检测肺组织HYP 含量分析
结果(图7)显示:IPF 组、BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组的肺组织HYP 含量升高,与Control 组相比均存在显著性差异(P<0.01);BLM 组、LPS-low 组、LPS-mid 组、LPS-high 组与IPF组相比均存在显著性差异(P<0.01),LPS-mid 组与BLM 组相比无显著性差异(P>0.05);随着时间的增加,肺组织HYP 含量无明显变化。

图7 各组大鼠不同时间点肺组织中HYP 含量(,n=3)Figure 7 HYP content in lung tissue of rats at different time points in each group(,n=3)
2.13 肺组织α-SMA 免疫组化分析
结果(图8、表7)显示:Control 组α-SMA 的表达主要集中在大血管周围和支气管壁中;模型组5 组α-SMA 的表达广泛存在于肺间质中;IPF 组、BLM组、LPS-low 组、LPS-mid 组、LPS-high 组的α-SMA表达量显著升高,与Control 组存相比均在显著性差异(P<0.01);模型组中,BLM 组、LPS-low 组、LPSmid 组、LPS-high 组与IPF 组相比均存在显著性差异(P<0.01,P<0.05),LPS-mid 组与BLM 组相比无显著性差异(P>0.05);随着时间的增加,肺组织α-SMA 的表达无明显变化。

图8 各组大鼠不同时间点肺组织α-SMA 免疫组化Figure 8 α-SMA in lung tissue of rats at different time points in each group
表7 各组大鼠不同时间点肺组织α-SMA 表达水平比较(,n=3,%Area)Table 7 Comparison of α-SMA expression levels in lung tissue of rats at different time points in each group(, n=3,%Area)

表7 各组大鼠不同时间点肺组织α-SMA 表达水平比较(,n=3,%Area)Table 7 Comparison of α-SMA expression levels in lung tissue of rats at different time points in each group(, n=3,%Area)
3 讨论
人类疾病动物模型是指各种医学科学研究中建立的具有人类疾病模拟表现的动物,其意义在于减少人体参与实验的风险,规范实验的条件和进程,促进人类对疾病的认识,其分类可按疾病产生原因分为自发性动物模型和诱发性动物模型[4]。本研究所创新的AE-IPF 疾病动物模型是诱发性动物模型,而其造模关键是采用与人类发病诱因近似的诱导因素。现阶段研究表明[5],AE-IPF 的发生与急性肺损伤、肺部炎症及感染、肺机械损伤、空气污染、胃食管返流、药物副作用有关,上述因素或直接或间接的引起特发性肺纤维化急性加重,而AE-IPF疾病动物模型的建立方法多样,如异硫氰荧光素合γ 疱疹病毒-68 两次造模[6]、博来霉素合阿米福汀两次造模[7]、博来霉素合单纯疱疹病毒Ⅰ型二次造模[8]、博来霉素合肺叶切除术两次造模[9]等,其中认可度较高的是两次气管注射博来霉素的方式,课题组前期实验也通过该方法成功建立了AE-IPF 动物模型[10],该种方法成模率高,操作者不接触有毒物质及病毒病菌,然而该种方法对实验操作要求较高,且博来霉素作为处方药,购买方式受限。脂多糖是内毒素的一种,可通过感染使肺部发生急性损伤,可通过气管注射、腹腔注射、雾化吸入等方法作用于实验动物,其作为常用实验药品,Kimura等[11]曾成功使用博来霉素诱导小鼠制成IPF 模型后使用脂多糖(0.5 mg/kg)进一步诱导形成AE-IPF 疾病动物模型。
动物疾病模型评价是动物模型建立的重要环节,科学的评价方法是动物疾病模型高质量的保障,而高质量的动物疾病模型是疾病、药物实验研究的基础。现阶段,动物模型的评价主要包含两个层面,即设计层面和操作层面,其中设计层面是指动物疾病模型建立后评价其是否出现符合人类疾病的表象,而操作层面则是指通过相关指标评价动物疾病模型是否建立成功[12]。特发性肺纤维化急性加重的表象是出现急剧加重的呼吸困难和普通间质性肺炎合并弥漫性肺损伤的病理改变[13],而其评价指标包含了胸部影像学检查、肺功能、血气分析、外周血液检测、支气管肺泡灌洗、外科肺活检[3],上述指标中外科肺活检和肺CT 是主要检测指标,可直接反映肺纤维化程度,其余指标可间接反应肺组织的损伤和呼吸功能的下降。本研究中,模拟AE-IPF 的BLM 组、LPS-low 组、LPS-mid 组和LPS-high 组大鼠相较于Control 组和模拟IPF 的IPF组大鼠均出现了较为显著的呼吸功能恶化,肺组织出现了新发的弥漫性肺泡损伤,如水肿、肺泡壁增厚或塌陷、肺泡腔内红细胞增多、纤维色素沉积、肺间质炎性浸润[14],符合AE-IPF 的表象;评价指标参考《特发性肺纤维化急性加重诊断和治疗中国专家共识(2019)》[3],其中模拟AE-IPF 的4 组相较于Control 组和IPF 组,肺CT 出现了广泛的磨玻璃阴影[15],肺顺应性[16]、肺功能和动脉血氧下降[17],支气管肺泡灌洗液和动脉血清中炎症因子TNF-α、IL-6 升高[18],肺组织HYP 含量和α-SMA 表达升高[19],上述评价指标均提示了AE-IPF 的发生;而模拟AE-IPF 的4 组中,BLM 组与LPS-mid 组在设计层面和操作层面评价结果较为一致。
综上,本研究所应用的气管注射博来霉素联合腹腔注射脂多糖制作AE-IPF 是模拟由于肺部感染而导致的特发性肺纤维化急性加,在使用博来霉素(浓度:5 mg/mL,剂量:0.1 mL/100 g)气管注射联合脂多糖中剂量(浓度:5 mg/mL,剂量:0.5 mL/100 g)腹腔注射两次诱导时,效果与两次应用博来霉素气管造模相近,可以作为AE-IPF 疾病动物模型制造的方法。

