慢性阻塞性肺疾病急性加重期患者发生肺动脉高压的高危因素研究
余中宝 曹文锋 占玲霞

【摘要】 目的 探讨慢性阻塞性肺疾病急性加重期(AECOPD)患者发生肺动脉高压的高危因素。方法 回顾性分析2017年1月—2020年12月鄱阳县人民医院诊治的43例发生肺动脉高压的AECOPD患者临床资料,作为发生组,同期未发生肺动脉高压的43例AECOPD患者临床资料,作为未发生组。设计基线资料表,分析AECOPD发生肺动脉高压的高危因素。结果 发生组与未发生组患者吸烟史及血清CRP、D-D、Cys-C水平比较,差异有统计学意义(P<0.05);组间其他资料对比,差异无统计学意义(P>0.05)。Logistic回归分析结果显示,吸烟史及CRP、D-D、Cys-C过表达均是AECOPD发生肺动脉高压的独立危险因素(P<0.05)。结论 吸烟史及血清CRP、D-D、Cys-C过表达可能是AECOPD患者发生肺动脉高压的高危因素。
【关键词】 慢性阻塞性肺疾病急性加重期;肺动脉高压;吸烟史;C反应蛋白;D-二聚体
中图分类号:R563.9 文献标识码:A
文章编号:1672-1721(2023)08-0142-03
DOI:10.19435/j.1672-1721.2023.08.046
慢性阻塞性肺病(chronic obstructive pulmonary disease ,COPD)是常见慢性呼吸系统疾病,进行性发展的不完全可逆的气流受限是其主要特征,且随着病程进展,部分患者会有肺动脉高压表现,尤其是COPD急性加重期(acute exacerbation of COPD,AECOPD)患者肺动脉高压的发生风险更高[1]。肺动脉高压是COPD常见并发症,主要是因低氧血症引起,可导致患者脏器发生多种病理性改变,增加急性加重及再入院风险,是AECOPD患者预后不良及死亡的重要原因[2]。因此,探讨AECOPD患者发生肺动脉高压的危险因素十分必要。既往研究指出,尿素氮(blood urea nitrogen,BUN)、二氧化碳分压(Partial pressure of carbon dioxide,PaCO2)等均为AECOPD患者发生肺动脉高压的危险因素[3],但上述影响因素并不能指导预防干预措施的拟定。本研究将对AECOPD患者肺动脉高压发生的危险因素进行分析,报道如下。
1 资料与方法
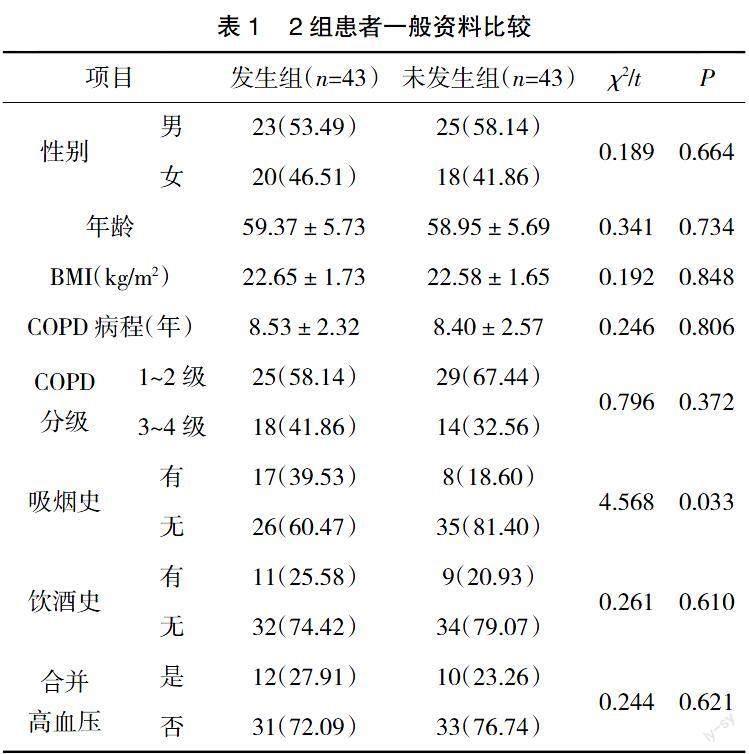
1.1 一般资料 回顾性分析2017年1月—2020年12月鄱阳县人民医院诊治的43例发生肺動脉高压的AECOPD患者临床资料,作为发生组;同期未发生肺动脉高压的43例AECOPD患者临床资料,作为未发生组。纳入标准:符合AECOPD的诊断标准[4];临床资料完整,包括基线资料及实验室检查资料。排除标准:严重肝肾功能不全;合并恶性肿瘤;合并支气管哮喘、先天性心脏病;其他原因导致的肺动脉高压,如药物、毒物、人类免疫缺陷病毒(HIV)感染、睡眠呼吸暂停等;特发性及遗传性肺动脉高压。
1.2 方法
1.2.1 肺动脉高压评估方法 心脏彩超检查肺动脉压力≥35 mm Hg;肺CT检查显示主肺动脉径线/主动脉径线>1∶1或主肺动脉直径≥29 mm。符合上述条件之一即为肺动脉高压,将发生肺动脉高压患者纳入发生组,反之纳入未发生组。
1.2.2 基线资料统计方法 设计基线资料表,包括一般资料:性别(男、女)、年龄、体重指数(Body mass index,BMI)、COPD病程、COPD分级(1~2级、3~4级)、吸烟史[有、无,吸烟指数(每日吸烟支数×吸烟年数)>200则判定有吸烟史]、饮酒史(有、无,男性每天饮酒量达到40 g,女性每天饮酒量达20 g,或2周内有大量饮酒史)、合并高血压(是、否,符合高血压的诊断标准[5])。实验室检查资料:入院时,取患者空腹静脉血5 mL,以3 000 r/min离心10 min,分离上层血清,-70 ℃冻存,采用免疫比浊法测定血清C反应蛋白(C-reactive protein ,CRP)、D-二聚体(D-Dimer,D-D)水平,采用罗氏全自动生化分析仪测定乳酸脱氢酶(lactate dehydrogenase,LDH)、血肌酐(serum creatinine,SCr)、天冬氨酸转氨酶(aspartate aminotransferase,AST)、BUN、丙氨酸转氨酶(alanine aminotransferase,ALT),采用CysC免疫分析试剂盒测定血清胱抑素C(cystatin C,Cys-C)水平。
1.3 统计学方法 采用SPSS 25.0统计学软件分析数据,计量资料行t检验,计数资料行χ2检验,多因素分析采用Logistic回归分析,P<0.05为差异有统计学意义。
2 结果
2.1 2组患者一般资料比较 2组患者吸烟史比较,差异有统计学意义(P<0.05);2组性别、年龄、BMI、COPD病程、COPD分级、饮酒史、合并高血压比较,差异无统计学意义(P>0.05),见表1。
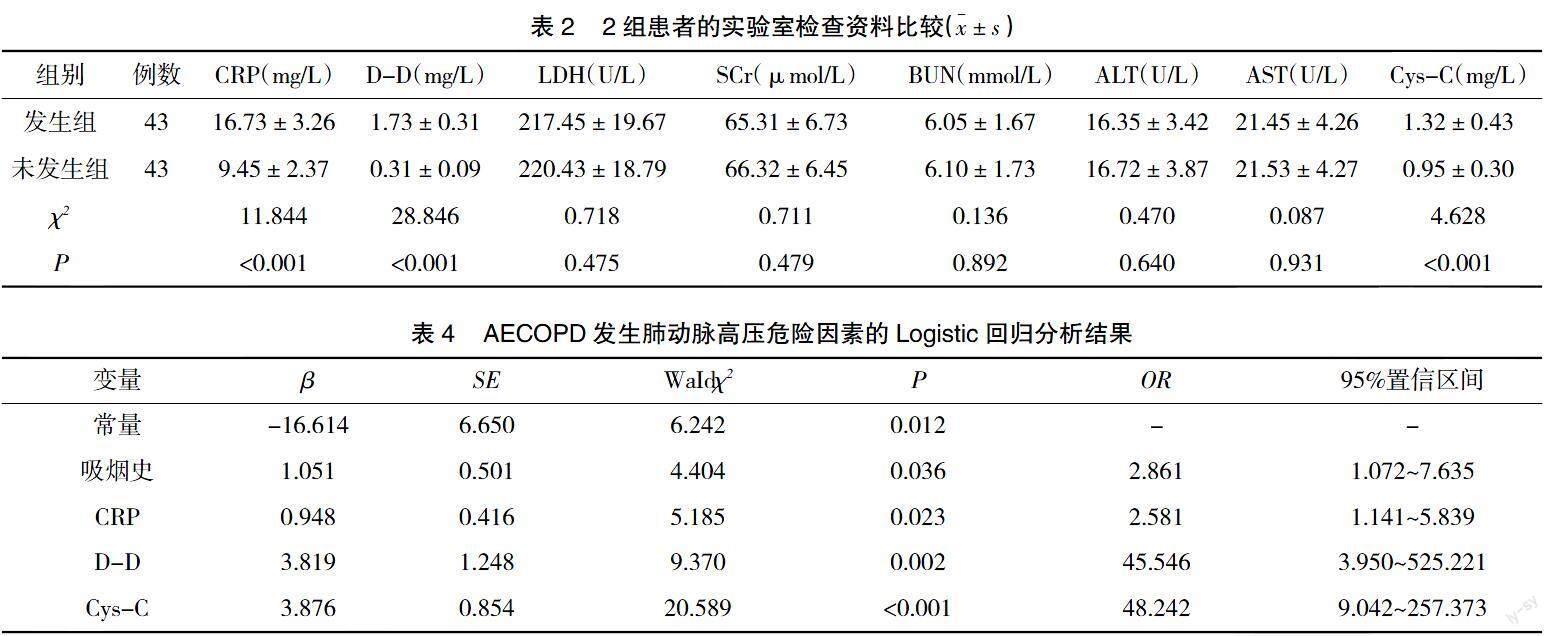
2.2 2组患者的实验室检查资料比较 2组患者的血清CRP、D-D、Cys-C水平比较,差异有统计学意义(P<0.05);2组血清LDH、SCr、BUN、ALT、AST比较,差异无统计学意义(P>0.05),见表2。
2.3 AECOPD发生肺动脉高压危险因素的Logistic回归分析 将基线资料比较中差异有统计学意义的变量作为自变量,经单元Logistic回归分析,后将条件放宽至P<0.02,纳入符合条件的变量(变量说明见表3)作为自变量,将AECOPD发生肺动脉高压情况作为因变量(1=发生,0=未发生),建立多元回归模型。结果显示,吸烟史及血清CRP、D-D、Cys-C过表达均是AECOPD发生肺动脉高压的独立危险因素(OR>1,P<0.05),见表4。
3 讨论
肺动脉高压可引发AECOPD患者诸多病理性改变,可导致肺血流减少及右心室功能不全等,使心血管疾病风险增加,同时增加患者的死亡风险。肺动脉高压临床并无特异性症状,常导致延误诊断[6]。因此,分析AECOPD患者发生肺动脉高压的高危因素,指导临床预防干预措施的拟定十分必要。
本研究经Logistics回归分析结果显示,吸烟史及血清CRP、D-D、Cys-C过表达均是AECOPD发生肺动脉高压的独立危险因素。吸烟史:长期吸烟可对红细胞的携氧能力造成损害,导致线粒体分泌增多,引起小气道阻塞,导致缺氧,引起氧化应激反应,释放大量的反应活性氧物质,导致肺血管重塑及收缩,增加患者肺动脉高压发生风险[7-8]。对此建议,应指导AECOPD患者戒烟,减轻吸烟造成氧化应激程度,可能对减少肺动脉高压发生有所帮助。CRP过表达:CRP是一种急性非特异性的反应蛋白,在炎症因子的刺激、激活下,肺巨噬细胞可产生CRP,若AECOPD患者血清CRP过表达,可刺激各种类型的生长因子及炎症因子合成与释放,引起血管内皮损伤,可促进成纤维细胞增殖,对平滑肌细胞产生刺激,导致肺血管重塑,增加肺动脉高压发生风险[9]。对此建议,应密切关注AECOPD患者血清CRP水平变化情况,若出现血清CRP过表达,可采取积极的抗炎治疗,可能对降低肺动脉高压发生风险有所帮助。D-D过表达:D-D是纤维蛋白降解产物,其水平升高提示机体长时间处于缺氧环境,增加红细胞代偿性及血液黏度,打破凝血、纤溶系统平衡,促使肺微小血栓形成,增加肺动脉高压发生风险[10]。对此建议,应密切监测AECOPD患者血清D-D水平,若其异常过表达,可采取合理的抗凝治疗措施,防止肺部微小血栓形成,可能对降低AECOPD患者肺动脉高压发生风险有所帮助。Cys-C过表达:Cys-C为半胱氨酸蛋白酶抑制剂家族成员,可反映肾小球功能,且不受年龄、肌肉组织影响,而若AECOPD患者血清Cys-C过表达,可能会通过对内源性和外源性蛋白酶水解相关细胞进行抑制,或通过对蛋白酶及抗蛋白酶的平衡造成影响,增加肺动脉高压发生风险[11-12]。对此建议,入院时应测定AECOPD患者血清Cys-C表达情况,对于过表达的患者应针对性采取相关干预措施,来降低肺动脉高压发生风险。
综上所述,吸烟史及血清CRP、D-D、Cys-C过表达均是AECOPD发生肺动脉高压的危险因素,应指导患者戒烟,并密切检测血清CRP、D-D、Cys-C表达情况,合理采取抗炎、抗凝治疗措施,可能会对降低AECOPD患者肺动脉高压风险有所帮助。
参考文献
[1] 武红莉,田瑞雪,叶青,等.B型脑钠肽,超敏C反应蛋白,纤维蛋白原,D-二聚体及血气分析在慢性阻塞性肺疾病急性加重期合并肺动脉高压患者中的表达[J].实用临床医药杂志,2018,22(3):31-33,37.
[2] 孙芸,陆士奇,屠苏,等.血液标志物和心脏彩超检查在慢性阻塞性肺疾病急性加重期相关性肺动脉高压的评估价值[J].中国急救医学,2019,39(11):1058-1064.
[3] 艾月琴,路东明,张文娟,等.AECOPD患者并发肺动脉高压的危险因素分析[J].医学临床研究,2018,35(9):1755-1757.
[4] 慢性阻塞性肺疾病急性加重(AECOPD)诊治专家组.慢性阻塞性肺疾病急性加重(AECOPD)诊治中国专家共识(草案)[J].国际呼吸杂志,2013,33(22):1681-1691.
[5] 中国高血压防治指南修订委员会.中国高血压防治指南2010[J].中华心血管病杂志,2011,39(7):579-616.
[6] 邓泽,冯浩绅,郑海明,等.AECOPD合并PH患者血清Hcy,Cys-C水平与肺功能,动脉血气分析指标及肺动脉收缩压的关系研究[J].现代生物医学进展,2021,21(14):2657-2660.
[7] ENGEL B,SCHINDLER C,LEUPPI J D,et al.Predictors of re-exacerbation after an index exacerbation of chronic obstructive pulmonary disease in the REDUCE randomised clinical trial[J].Swiss Med Wkly,2017,147(1920):w14439.
[8] 赵松林,聂秀红.NT-proBNP、CRP和D-Dimer与慢性阻塞性肺疾病急性加重期合并肺动脉高压的相关性研究[J].标记免疫分析与临床,2019,26(4):555-559.
[9] 黄燕华,张倩,刘茗,等.血清PCT,IL-17与CRP在AECOPD合并肺動脉高压患者中的表达及诊断价值[J].现代生物医学进展,2019,19(16):3141-3145.
[10] 曹秀丽,焦建华,张智慧,等.慢阻肺并发肺动脉高压患者血清CRP,IL-6和TLR4的差异表达及相关性分析[J].标记免疫分析与临床,2019,26(4):645-649.
[11] KONOMI K,MANABU S,SHOTA Y,et al.Early-onset, Severe Chronic Obstructive Pulmonary Disease with Pulmonary Hypertension that was Likely Induced by Toluene Exposure[J].Intern Med,2017,56(17):2329-2334.
[12] 杨静,任春辉,周文龙.血H-FABP,Cys-C及NO检测对AECOPD合并肺动脉高压的诊断价值[J].内蒙古医科大学学报,2020,42(3):311-313,324.
(收稿日期:2022-12-27)

