LncRNA H19通过调控心肌纤维化进程促进急性心肌梗死
苏兵 刘娟 高晓峰 李硕 左莉莉
(衡水市人民医院,河北 衡水 053000)
虽然心脏病临床治疗在降低心血管疾病死亡率方面取得了很大的进展,但缺血性心脏病,尤其是心肌梗死,仍是人类健康的主要威胁〔1,2〕。心肌梗死的病程在临床上可分为超急性、急性、亚急性和慢性〔3〕,急性期的充分护理和治疗对于心肌梗死损伤后患者的预后至关重要〔4,5〕。急性心肌梗死(AMI)的特征之一是心肌纤维化,AMI后心肌纤维化属于心肌重构的重要环节之一,主要的病理变化为缺血诱导心肌成纤维细胞激活并增生合成大量细胞外基质(ECM),导致ECM过度沉积,最终导致器官结构的破坏和器官衰竭〔6,7〕。长链非编码RNA(lncRNAs)被定义为一种长度超过200个核苷酸且不编码蛋白质的RNAs〔8〕。LncRNAs与常见病的发生、发展息息相关〔9~12〕。据报道,LncRNAs 可能作为竞争性内源性 RNAs (ceRNAs) 来调节 miRNAs 的表达〔13〕。LncRNAs被发现参与了纤维化的进程〔14,15〕,LncRNA H19位于人类第11号染色体端粒区附近的H19基因,是最广为人知的印迹基因之一〔16〕。LncRNAs H19表达在纤维化的人近端肾小管上皮细胞及纤维化肝星状细胞中显著上调〔17,18〕。本研究探讨LncRNAs H19在心肌纤维化进程中的作用,以期为AMI有效治疗开拓新视野。
1 材料与方法
1.1细胞培养及处理 原代HCFs购自美国典型培养物保藏中心(ATCC),在37 ℃、5%CO2的条件下,在补充了10%胎牛血清(FBS,美国Invitrogen公司)、1%青霉素和1%链霉素(美国Gibco公司)的加湿培养箱中孵育48 h,37 ℃下血管紧张素(Ang)Ⅱ(美国Sigma-Aldrich公司)处理(0.01 mmol/L)24 h,以诱导心肌纤维化表型。
1.2细胞转染与分组 通过LiPofectamine 2000 (货号:11668-019,美国Invitrogen公司)将si-NC、si-H19#1/2、inhibitor-NC、miR-130a-3p inhibitor、pcDNA3.1-NC、pcDNA3.1-Ⅰ型TGF-β受体(TGFBR1)(上海Genechem公司)转染至HCFs中,正常培养基中恢复24 h。分组:Blank组(未进行处理的HCFs)、AngⅡ组(AngⅡ处理的HCFs)、AngⅡ+si-NC组(转染si-NC后,使用AngⅡ处理的HCFs)、AngⅡ+si-H19#1组(转染si-H19#1,再进行AngⅡ处理的HCFs)、AngⅡ+si-H19#2组(转染si-H19#2,再进行AngⅡ处理的HCFs)、AngⅡ+si-H19+inhibitor-NC组(转染si-H19#1和inhibitor-NC,再进行AngⅡ处理的HCFs)、AngⅡ+si-H19+miR-inhibi组(转染si-H19#1和miR-130a-3p inhibitor,再进行AngⅡ处理的HCFs)、AngⅡ+si-H19+oe-NC组(转染si-H19#1和pcDNA3.1-NC,再进行AngⅡ处理的HCFs)、AngⅡ+si-H19+oe-TGFBR1(转染si-H19#1和pcDNA3.1-TGFBR1,再进行AngⅡ处理的HCFs)。
1.3实时荧光定量-聚合酶链反应(qRT-PCR) 使用Trizol (美国Invitrogen公司)裂解HCFs。RNA提取试剂盒(北京天根生化科技公司)提取总RNA,根据生产商说明书,使用SuperScript Ⅳ试剂盒(美国Thermo Fisher Scientific公司)进行逆转录。在50 ℃ 10 min与80 ℃ 10 min下合成cDNA。根据生产商说明书,使用PowerUpTMSYBRTMGreen Master mix (美国Thermo Fisher Scientific公司) 和 ABI ViiA 7 System (美国Thermo Fisher Scientific公司)进行qRT-PCR。采用以下热循环条件:95 ℃初始变性120 s,95 ℃变性15 s,60 ℃延伸60 s,循环40次。用2-ΔΔCt方法〔19〕进行定量。引物序列:miR-130a-3p正向5′-TTCACATTGTGCTACTGTCTGC-3′,反向5′-GCTCTGACTTTATTGCACTACT-3′;H19正向5′-TCCCAGAACCCACAACATGAA-3′,反向5′-TTCACCTTCCAGAGCCGATTC-3′;TGFBR1正向5′-GACAAC-GTCAGGTTCTGGCTCA-3′,反向5′-CCGCCACTTTCCTCTCCAAACT-3′;GAPDH正向5′-AGCCACATC-GCTCAGACAC-3′,反向5′-GCCCAATACGACCAAA-TCC-3′;U6正向5′-CTCGCTTCGGCAGCACA-3′,反向5′-AACGCTTCACGAATTTGCGT-3′。
1.4CCK-8实验 将细胞以3 000个/孔接种于96孔板中,待细胞贴壁后,培养0、24、48、72 h,在37 ℃下向培养基中加入10 μl CCK-8溶液(上海碧云天生物技术有限公司)。使用多功能酶标仪(英国Hybrid Technology公司)测定450 nm处的吸光度。
1.5细胞划痕实验 将细胞以5×105个/孔接种于6孔板中,培养至达到融合。如1.2中的方法处理细胞后,使用1 000 μl无菌微量移液器吸头在每孔的细胞层中心下方划痕。然后用磷酸盐缓冲液(PBS)清洗细胞两次,并在不含胎牛血清的培养基中培养。在划痕后0、24 h于明视场显微镜(日本Olympus公司)下每组采集3个随机独立视野图像。使用ImageJ软件(版本v1.52a;美国国立卫生研究院)对划痕的宽度进行定量测量,并计算迁移率。
1.6Western印迹 根据生产商说明,使用RIPA裂解缓冲液(上海碧云天生物技术有限公司)从细胞中分离总蛋白。全细胞蛋白提取物经二喹啉甲酸(BCA)法鉴定。用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离等量的蛋白裂解物,并转移至硝酸纤维素膜(美国Bio-Rad公司)上。用含吐温的Tris缓冲盐水(TBST)中的5%脱脂乳封闭后,用TBST清洗膜一次,一抗4 ℃孵育过夜。使用GAPDH作为上样对照。用耦联辣根过氧化物酶的IgG二抗孵育后,使用增强电化学发光(ECL)法(美国Amersham Biosciences公司)显示条带。一抗:胶原蛋白CollagenⅠ(稀释倍数1∶1 000,货号ab138492,英国Abcam公司)、Collagen Ⅲ(稀释倍数1∶1 000,货号ab7778,英国Abcam公司)、α-平滑肌肌动蛋白(SMA,稀释倍数1∶1 000,化号ab5694,英国Abcam公司)、GAPDH(稀释倍数1∶1 000,货号ab9485,英国Abcam公司)。二抗:IgG(稀释倍数1∶1 000,货号ab150077,英国Abcam公司)。
1.7核质分离实验 根据制造商说明书,使用NE-PER核质细胞提取试剂盒(美国Thermo Scientific公司)分别提取质提取物和核提取物。然后通过qRT-PCR检测核质提取物中H19的表达。
1.8双荧光素酶报告实验 通过Starbase网站(https://starbase.sysu.edu.cn/)分析H19与miR-130a-3p及miR-130a-3p与TGFBR1的靶向关系结合位点,通过将结合序列及突变的序列分别克隆至荧光素酶载体pGL3(美国Promega公司)中来建立野生型(H19-wt、TGFBR1-wt)和突变型 (H19-mut、TGFBR1-mut)荧光素酶质粒。将HCFs细胞(美国ATCC)接种在6孔板中(2×105细胞/孔)。孵育24 h,按照说明书使用LiPofectamine 2000(货号11668-019,美国Invitrogen公司)将构建好的荧光素酶载体与mimic-NC或miR-130a-3p mimic同时转染到HCFs细胞中。24 h后,用Dual-Lucy Assay Kit(北京Solarbio公司)对荧光素酶活性进行评估。
1.9RNA免疫沉淀(RIP)实验 根据Magna RIP Kit(美国Millipore公司)的说明,HCFs的裂解物与anti-Ago2/anti-IgG耦联的磁珠孵育4 h,通过qRT-PCR检测免疫沉淀RNA中LncRNA H19和miR-130a-3p的富集。
1.10统计学分析 采用SPSS21.0软件和GraphPad Prism8.0软件进行非配对t检验、单因素方差分析和多因素方差分析,事后检验采用Tukey多重检验。
2 结 果
2.1低表达H19可抑制HCFs纤维化的进程 与Blank组相比,Ang Ⅱ组H19表达水平(1.00±0.02 vs 2.47±0.04)、细胞增殖活力(24、48、96 h)、细胞迁移能力、Collagne Ⅰ、Collagen Ⅲ和α-SMA蛋白表达水平明显增加(P<0.05,P<0.001)。与Ang Ⅱ+si-NC组(2.51±0.05)相比,Ang Ⅱ+si-H19#1组(1.46±0.04)和Ang Ⅱ+si-H19#2组H19表达(1.88±0.05)均显著降低(t=40.167、21.824,均P<0.001),且Ang Ⅱ+si-H19#1组较Ang Ⅱ+si-H19#2组显著更低(t=16.067,P<0.001),故选择si-H19#1作为si-H19进行后续实验(作为Ang Ⅱ+si-H19组)。与Ang Ⅱ+si-NC组相比,Ang Ⅱ+si-H19组细胞增殖活力(24、48、96 h)、细胞迁移能力、Collagne Ⅰ、Collagen Ⅲ和α-SMA蛋白表达水平明显降低(P<0.05,P<0.001)。见图1、表1、表2、图2。

表1 各组不同时间HCFs细胞增殖活力比较

表2 各组迁移实验及Western 印迹实验结果比较

1~8:Blank组、AngⅡ组、AngⅡ+si-NC组、AngⅡ+si-H19组、AngⅡ+si-H19+inhibitor-NC组、AngⅡ+si-H19+miR-inhibi组、AngⅡ+si-H19+oe-NC组、AngⅡ+si-H19+oe-TGFBR1组;图2同图1 Western印迹检测各组CollagenⅠ、CollagenⅢ、α-SMA蛋白表达

图2 各组迁移实验(×400)
2.2H19通过结合miR-130a-3p调控TGFBR1表达 生物信息学网站预测显示H19主要分布于细胞质中(图3A)。RNA-FISH实验分析H19在HCFs中的亚细胞定位也显示H19主要分布于HCFs的细胞质中(图3B)。Starbase数据库显示miR-130a-3p中存在H19和TGFBR1结合的位点(图3C)。双荧光素酶报告实验显示,在转染H19-wt的细胞中,与共转染mimic NC(1.00±0.02)相比,共转染miR-130a-3p mimic的荧光素酶活性(0.36±0.04)明显降低(t=35.054,P<0.05)。在转染TGFBR1-wt的细胞中,与转染mimic NC(1.00±0.03)相比,共转染miR-130a-3p mimic的荧光素酶活性(0.43±0.03)明显降低(t=32.909,P<0.05)。在转染H19-mut的细胞中,与共转染mimic NC(1.00±0.02)相比,共转染miR-130a-3p mimic的荧光素酶活性(1.00±0.03)差异无统计学意义(t=0.001,P>0.05)。在转染TGFBR1-mut的细胞中,与转染mimic NC(1.00±0.02)相比,共转染miR-130a-3p mimic的荧光素酶活性(1.00±0.05)差异无统计学意义(t=0.001,P>0.05)。RIP实验显示,与Anti-IgG相比,Anti-Ago2细胞中H19和miR-103a-3p表达水平均显著升高(P<0.001)。见表3。qRT-PCR显示,与si-NC组相比,si-H19组HCFs中miR-130a-3p表达明显升高,TGFBR1表达明显降低(P<0.05)。见表4。

表3 RIP实验

表4 qRT-PCR检测
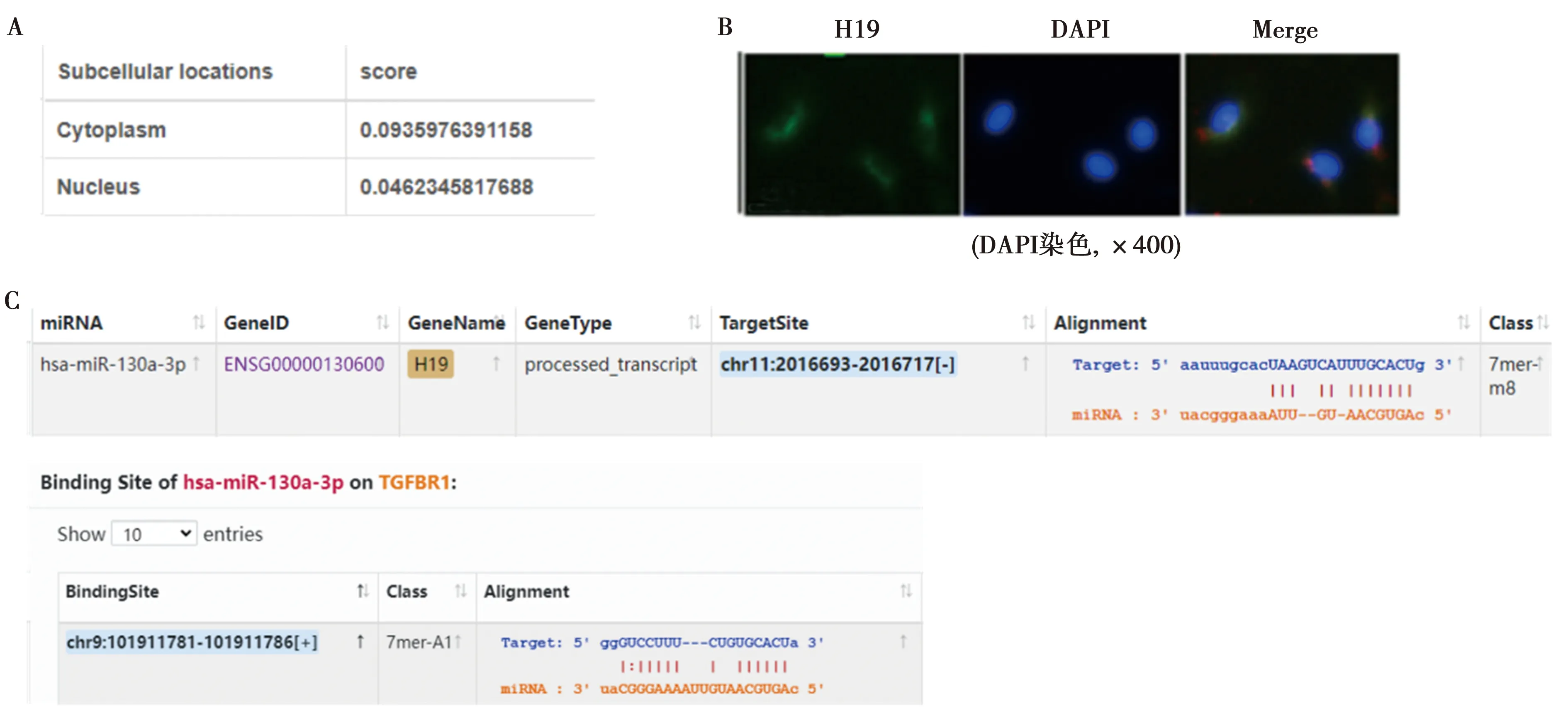
图3 H19通过结合miR-130a-3p调控TGFBR1表达
2.3下调miR-130a-3p可部分逆转si-H19对HCFs纤维化的抑制作用 与Ang Ⅱ+si-H19+inhibitor-NC组(2.38±0.05)相比,Ang Ⅱ+si-H19+miR-inhibi组miR-130a-3p表达水平(1.52±0.04)显著降低,细胞迁移能力、Collagen Ⅰ、Collagen Ⅲ和α-SMA蛋白表达水平显著增加(P<0.001)。CCK-8实验显示,与Ang Ⅱ+si-H19+inhibitor-NC组相比,Ang Ⅱ+si-H19+miR-inhibi组48、96 h细胞活力显著增加(P<0.05)。见图1、表1、表2、图2。
2.4上调TGFBR1可以部分逆转si-H19对HCFs纤维化的抑制作用 与Ang Ⅱ+si-H19+oe-NC组相比,Ang Ⅱ+si-H19+oe-TGFBR1组TGFBR1 mRNA表达水平(0.32±0.04 vs 0.74±0.03)显著升高(t=20.576,P<0.001),细胞迁移能力、Collagen Ⅰ、Collagen Ⅲ和α-SMA蛋白表达水平显著增加(P<0.001)。CCK-8实验显示,与Ang Ⅱ+si-H19+oe-NC组相比,Ang Ⅱ+si-H19+oe-TGFBR1组96 h细胞活力显著增加(P<0.05)。见图1、表1、表2、图2。
3 讨 论
AMI是世界上发病率和死亡率最高的疾病之一〔20〕,并可能诱发心室重构和心力衰竭〔21〕。据报道,心肌纤维化与心脏微血管的稀疏有关,且能导致心力衰竭,心力衰竭是由心肌成纤维细胞积聚和ECM沉积中胶原的合成、代谢和降解失衡引起的〔22〕。CFCs是分泌心肌细胞外基质的主要细胞。在目前的研究中,用Ang Ⅱ处理HCFs诱导心肌纤维化表型。本研究发现H19在用Ang Ⅱ处理的HCFs中高表达,表明H19可能与心肌纤维化的发生和发展有关。研究表明,H19有助于心脏的纤维化进程〔23〕,这与本研究的结果一致。此外,本研究也观察到了H19促进了HCFs的增殖并增强了纤维化相关蛋白的表达,而下调H19的表达则产生了相反的效果。这些数据进一步表明,H19可能促进心肌纤维化的发展。本研究发现miR-130a-3p是H19的潜在靶点之一。在目前的研究中,Ang Ⅱ治疗导致miR-130a-3p 表达减少,而H19下调则显著增加了miR-130a-3p表达。这些数据表明,H19可能直接靶向miR-130a-3p并下调其表达水平。有研究表明,miR-130a-3p可以减轻肝纤维化的发生〔24〕。Feng等〔25〕则报道了 miR-130a-3p通过TGF-β/Smad信号通路减弱心肌梗死后的心肌纤维化。Tan等〔26〕的报道表明TGFBR1信号通路与心肌纤维的发生息息相关,而通过Starbase网站预测预测到miR-130a-3p与TGFBR1存在结合位点。故而猜测H19通过miR-130a-3p/TGFBR1在心肌纤维化中发挥调控作用。在本研究中,miR-130a-3p下调或TGFB1上调均促进了HCFs的增殖、迁移及纤维化蛋白的表达。胶原蛋白(一种不溶性纤维蛋白)是ECM的主要成分〔27,28〕。本研究表明,H19通过海绵化miR-130a-3p促进了HCFs的增殖和纤维化相关蛋白的蛋白表达。
综上,H19沉默抑制了HCFs的增殖和胶原表达,这被miR-130a-3p下调或TGFBR1上调部分逆转;因此,H19通过海绵化miR-130a-3p促进TGFBR1的转录,进一步促进了细胞增殖、迁移和纤维化相关蛋白的表达。因此,H19可能是AMI治疗的一个新的有效靶点。

